Sorafenib联合重组人可溶性TRAIL蛋白对K562细胞增殖抑制和凋亡诱导的研究
2014-05-16王阿慧凌艳英庄秋容邓家德
王阿慧,凌艳英,庄秋容,邓家德
(广州医科大学 附属广州市第一人民医院检验科血液室,广东 广州 510180)
肿瘤坏死因子相关凋亡诱导配体(tumor necrosisfactorrelated apoptosisinducing ligand,TRAIL)又称Apo2L,是Wiley发现的TNF超家族成员,它能选择性地诱导肿瘤细胞和转化细胞凋亡,且与肿瘤系统常用的化疗药物具有协同效应。TRAIL还能克服一部分多药耐药现象,对正常细胞没有显著的毒性效应,这一优势为其在血液肿瘤治疗中的应用提供了前景。
索拉非尼(Sorafenib)是一种新型靶向性治疗的多激酶抑制剂,具有双重抗肿瘤效应,一方面,它可以通过抑制RAFA/MEK/ERK信号传导通路,直接抑制肿瘤生长;另一方面,它又可以通过抑制VEGFR和PDGFR而阻断新生血管的形成,间接抑制肿瘤细胞的生长。目前索拉非尼在肝癌及肾癌的临床治疗方面取得了可喜的成果。但是由于索拉非尼在应用过程中可发生耐药,Ⅱ期临床试验发现索拉非尼单用疗效有限,部分患者在应用的后期对索拉非尼失去反应,导致肿瘤发展,治疗效果下降[1-2]。因此,目前提倡联合用药以提高疗效。
笔者选择联用这两种靶向药物,以期两种不同的分子靶向药物可以对人慢性髓系白血病细胞株K562产生更大的增殖抑制及凋亡诱导作用。
1 材料与方法
1.1 材料
索拉非尼(Sorafenib BAY43-9006,Bayer)为德国拜耳医药保健股份公司产品;人慢性髓系白血病细胞株K562购自中科院上海细胞生物所;重组人可溶性TRAIL/Apo2L购自美国Pe Protech公司;CCK-8试剂盒为日本同仁化学研究所产品;Annexin V-FITC细胞凋亡检测试剂盒购自深圳晶美生物有限公司;RPMI1640及胎牛血清均为美国GIBCO BRL公司产品;其他试剂为分析纯。
1.2 方法
1.2.1 索拉非尼药物的配制 将索拉非尼药片轻轻刮净糖衣,并将药片研成粉末状,称重后溶于DMSO液,配制成浓度为100μmol/L的母液待用,-20℃保存。每次实验前用新鲜培养液按一定比例稀释到所需浓度,并使得DMSO的最终浓度不超过0.1%
1.2.2 细胞培养 人慢性髓系白血病细胞株K562在37℃,5%CO2条件下悬浮培养于RPMI1640液中,后者加入10%胎牛血清,2 mmol/L谷氨酰胺,和100U/mL青霉素、链霉素,根据生长情况每天换液,隔天传代1次。实验用细胞均处于对数生长期。
1.2.3 CCK-8法测定细胞增殖抑制率 取对数生长期的K562细胞制成单细胞悬液以4×105个/mL浓度100μL接种于96孔培养板(4×104个/孔)中,置于37℃,5%CO2孵育箱内以无血清培养液“饥饿细胞”24 h。空白及对照组以不含药物的培养液常规培养,并加入DMSO以其最终浓度不超过0.1%。各实验组加入不同浓度的Sorafenib或/和重组人可溶性TRAIL/Apo2L蛋白,并设3个复孔。CCK-8实验的边缘孔用PBS填充。培养24 h/48 h后每孔加入10μL WST-8溶液,37℃,5%CO2条件下继续培养6 h,用Bio-Rad酶标仪在450 nm处测定吸光值。实验重复3次;求得抑制率:抑制率={1-[(A药物-A空白)(/A对照-A空白)]}×100%。
1.2.4 流式细胞术检测 K562细胞以对数生长期细胞1×106个/孔接种于6孔板,每孔加入不同浓度的Sorafenib或/和重组人可溶性TRAIL/Apo2L蛋白,对照组以常规培养基培养,并加入DMSO(最终浓度<0.1%)。按时间收集细胞,PBS洗涤两次后离心,将细胞重悬于500μL结合缓冲液,分别加入5μL AnnexinⅤ-FITC和5μL碘化吡啶(PI)染液,混匀,于4℃避光孵育15 min后,收集细胞,1 h内以流式细胞仪(Beckman公司产品)荧光标记分析诱导凋亡活性。
1.3 统计学分析
采用SPSS19.0统计软件进行,实验数据以均数±标准差()来表示,多组样本之间均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 索拉非尼、TRAIL对K562细胞增殖的影响
见表 1,图 1。将 1.25、2.5、5、10、15、20和50μmol/L 的索拉非尼及 50、75、100、150、200、300、400 ng/mL的重组人可溶性TRAIL/Apo2L蛋白分别与K562细胞株共培养24 h/48 h,CCK-8法检测结果显示:索拉非尼及TRAIL蛋白组均能抑制人慢性髓系白血病细胞K562的增殖,与对照组之间比较差异有统计学意义(P<0.05)。不同浓度的索拉非尼对K562细胞的增殖抑制作用呈现出明显的时间-剂量依赖效应,TRAIL蛋白对K562细胞的增殖抑制作用呈现的时间-剂量依赖效应不如索拉非尼明显,仅出现低幅度的增长趋势,抑制作用有限,见表1,图2。
表1 CCK-8法检测不同浓度索拉非尼(S)及TRAIL(T)对K562细胞的增殖抑制作用()/%Tab.1 Growth inhibitory effect of Sorafenib or TRAIL on K562 cells with CCK-8()/%

表1 CCK-8法检测不同浓度索拉非尼(S)及TRAIL(T)对K562细胞的增殖抑制作用()/%Tab.1 Growth inhibitory effect of Sorafenib or TRAIL on K562 cells with CCK-8()/%
Sorafenib的抑制作用TRAIL的抑制作用24 h 48 h control S1.25/(μmol·L-1)S2.5/(μmol·L-1)S5/(μmol·L-1)S10/(μmol·L-1)S15/(μmol·L-1)S20/(μmol·L-1)S50/(μmol·L-1)24 h 0.50±0.5481.52±1.142.20±1.164.86±2.319.16±3.1741.98±1.3253.28±0.6663.80±1.5348 h 0.50±0.8372.50±0.864.22±1.2015.18±1.7839.10±2.2155.90±2.0965.22±2.0881.72±1.19 T50/(ng·mL-1)T75/(ng·mL-1)T100/(ng·mL-1)T150/(ng·mL-1)T200/(ng·mL-1)T300/(ng·mL-1)T400/(ng·mL-1)0.08±0.133.60±0.565.78±1.6311.20±1.3212.80±0.9816.90±1.5321.40±4.372.08±2.967.62±1.0712.76±0.3916.96±2.2823.71±2.3228.01±1.2839.14±3.63
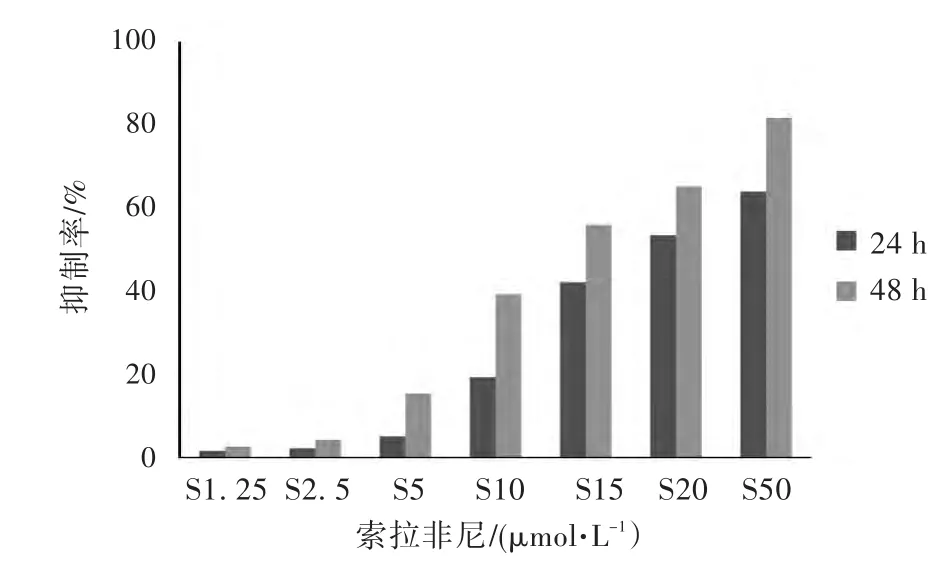
图1 不同浓度索拉非尼(Sorafenib)对K562细胞的增殖抑制作用Fig.1 Growth inhibitory effect of Sorafenib on K562 cells

图2 不同浓度TRAIL对K562细胞的增殖抑制作用Fig.2 Growth inhibitory effect of TRAIL on K562 cells
2.2 索拉非尼联合TRAIL对K562细胞增殖的影响
见表2,图3。在计数好的K562细胞中,加入Sorafenib至终浓度为2.5~50μmol/L,再分别加入重组人可溶性TRAIL/Apo2L蛋白至终浓度为75ng/mL和100ng/mL,继续培养24 h/48 h,以CCK-8法检测其对细胞的增殖抑制作用。结果显示:75、100 ng/mL的TRAIL与(2.5~50)μmol/L的Sorafenib分别联合给药,对K562细胞的增殖抑制率均高于两者单独给药组(P<0.05),且48 h抑制率大多高于24 h抑制率;低浓度的TRAIL和Sorafenib单独用药时对K562细胞的抑制作用虽不显著,但联合用药及延长用药时间均能显著加强对K562细胞的生长增殖抑制作用(P<0.05)(见表2,图3)。
表2 75、100 ng/mL的TRAIL与不同浓度Sorafenib对K562细胞的增殖抑制作用()/%Tab.2 Growth inhibitory effect of 75,100 ng/mL TRAIL combined Sorafenib on K562 cells()/%
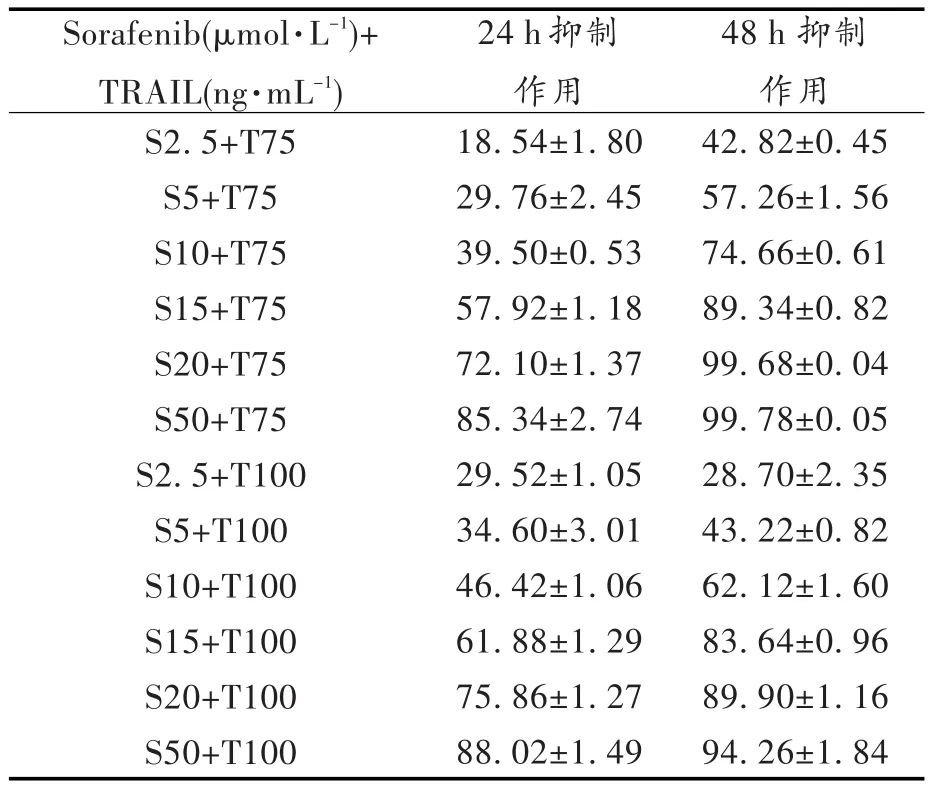
表2 75、100 ng/mL的TRAIL与不同浓度Sorafenib对K562细胞的增殖抑制作用()/%Tab.2 Growth inhibitory effect of 75,100 ng/mL TRAIL combined Sorafenib on K562 cells()/%
Sorafenib(μmol·L-1)+TRAIL(ng·mL-1)S2.5+T75 S5+T75 S10+T75 S15+T75 S20+T75 S50+T75 S2.5+T100 S5+T100 S10+T100 S15+T100 S20+T100 S50+T10024 h抑制作用18.54±1.8029.76±2.4539.50±0.5357.92±1.1872.10±1.3785.34±2.7429.52±1.0534.60±3.0146.42±1.0661.88±1.2975.86±1.2788.02±1.4948 h抑制作用42.82±0.4557.26±1.5674.66±0.6189.34±0.8299.68±0.0499.78±0.0528.70±2.3543.22±0.8262.12±1.6083.64±0.9689.90±1.1694.26±1.84
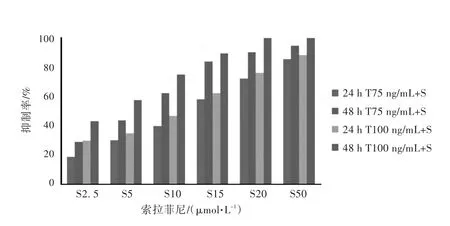
图3 75、100 ng/mL的TRAIL与不同浓度Sorafenib对K562细胞的增殖抑制作用Fig.3 Growth inhibitory effect of 75,100 ng/mL TRAIL combined Sorafenib on K562 cells
2.3 索拉非尼及TRAIL对K562细胞的凋亡诱导作用
如图4,5μmol/L的索拉非尼及75、100 ng/mL的TRAIL作用于K562细胞24 h/48 h后在流式细胞仪得到的Annexin V/PI双染双变量散点图。散点图左下角为Annexin V低染/PI低染的正常活细胞,左上角是检测范围允许的误差,右下角为Annexin V高染/PI低染的早期凋亡细胞,右上角是Annexin V高染/PI高染的继发性坏死/晚期凋亡细胞。双变量散点图提示索拉非尼及TRAIL作用于K562细胞24 h即出现凋亡,且既有早期凋亡也有晚期凋亡。75 ng/mL TRAIL与100 ng/mL TRAIL相比,后者对K562细胞的凋亡率高于前者,差异有统计学意义(P<0.05),即TRAIL对K562的细胞凋亡率呈现出一定的浓度依赖性;75ng/mL TRAIL与100 ng/mL TRAIL在48 h对K562的细胞凋亡率高于其在24 h的细胞凋亡率,差异有统计学意义(P<0.05),即TRAIL对K562的细胞凋亡率呈现出一定的时间依赖性。5μmol/L索拉非尼分别联合75、100 ng/mL TRAIL对K562作用24 h/48 h后出现明显的凋亡峰,显著高于其单独应用时的细胞凋亡率,差异有统计学意义(P<0.05)。说明Sorafenib能增强K562细胞对TRAIL的敏感性。

图4 Annexin V/PI双染法检测索拉非尼及TRAIL对K562细胞的凋亡诱导作用Fig.4 Apoptotic effect of K562 cells determined with Annexin V/PI double staining after exposure to TRAIL combined with sorafenib
3 讨论
肿瘤坏死因子相关凋亡诱导配体(TRAIL)又称Apo2L,是Wiley发现的TNF超家族成员,广泛表达于多种正常组织中,且在多种因子如丝裂原、白细胞介素、干扰素及炎症性的细胞毒素等的刺激下可被诱导表达[3]。TRAIL能选择性的诱导肿瘤细胞和转化细胞发生凋亡而对正常细胞无明显的杀伤作用。TRAIL与血液系统肿瘤常用的化疗药物还具有协同性,并能克服一部分多药耐药现象,不影响正常造血[4-5]。对于TRAIL凋亡诱导的机制,目前的理论是其与放疗、化疗等常规治疗引起的凋亡途径不同:TRAIL可直接通过激活caspase酶级联反应而引起,不依赖于p53基因的表达。TARIL能有效的调控一些对常规药物耐药的肿瘤细胞的凋亡,与放疗、化疗协同用于肿瘤的治疗,并且TRAIL基因联合其他生物靶向治疗方法的研究也取得了令人鼓舞的结果[6]。
索拉非尼是一种新型靶向性治疗的多激酶抑制剂,已被批准用于临床治疗肝癌及肾癌。它能同时抑制多种存在于细胞内及细胞表面的激酶,其中包括Raf激酶,VEGFR-2,VEGFR-3,PDGFR-β,Kit和 Fit-3[7]。近期研究显示索拉非尼同时抑制BCR-ABL,活化的多条生存信号,包括JAK2/STAT5及RAF/MEK/ERK,提示索拉非尼用于治疗CML以及伊马替尼耐药的CML具有潜在的前景[8]。索拉非尼具有双重抗肿瘤效应,一方面,它可以通过抑制RAFA/MEK/ERK信号传导通路,直接抑制肿瘤生长;另一方面,它又可以通过抑制VEGFR和PDGFR而阻断新生血管的形成,间接抑制肿瘤细胞的生长[9]。但近期报道索拉非尼在应用过程中可发生耐药,部分患者在应用的后期对索拉非尼失去反应,肿瘤因此发展,导致治疗效果下降,因此,目前提倡联合用药以提高疗效[10]。
本研究中,通过体外低浓度索拉非尼对K562细胞的应用,观察到与TRAIL联用时,K562细胞的增殖抑制率及凋亡率较同浓度单独应用时均有明显的增加。低浓度的索拉非尼可增强TRAIL对K562细胞的凋亡诱导作用。
作为多激酶抑制剂的Sorafenib,可通过阻断由BCR-ABL持续活化的下游信号Raf/MEK/ERK,JAK/STAT5来增强caspase-3活化;通过减少GSK-3B蛋白失活,抑制WNT通路关键效应分子β-catenin进入核内,进而抑制CCND1基因转录活性,下调cyclinD1蛋白,诱导细胞阻滞于G0/G1,最终影响细胞周期进程,导致细胞增殖抑制和凋亡;也可通过下调Mcl-1等多种抗凋亡蛋白的表达,来促进细胞凋亡[11]。慢性粒细胞白血病患者急性变时常伴有c-Myc的过表达,文献报道,索拉菲尼应用于K562细胞后c-Myc蛋白下调,这可能是索拉菲尼诱导白血病细胞凋亡的机制之一[12]。
TRAIL对肿瘤细胞及转化细胞具有选择性凋亡诱导作用,而对正常细胞没有明显的毒副作用,且TRAIL也能杀伤许多由于p53基因发生突变而对放疗和化疗药物耐受的肿瘤细胞。基于以上原由,TRAIL成为一种具有开发前景的癌症治疗药物。然而,许多癌细胞如慢性淋巴细胞白血病产生TRAIL耐受,反复使用TRAIL可产生获得性耐受[13],因此需要克服TRAIL的耐药,将其优势应用于临床。研究表明:TRAIL主要通过与细胞膜表面的死亡受体结合,激活细胞下游凋亡信号而诱导细胞凋亡,研究发现caspase-8表达量下降或者缺失以及Mcl-1过表达与肝细胞癌和胆管细胞癌都与TRAIL耐受性有关。某些化疗药物减少c-FLIP表达量而使肿瘤细胞对TRAIL敏感,或者减少Bcl-2表达量也可以促进TRAIL诱导肿瘤细胞凋亡[7]。
TRAIL作为一种很有前景的抗肿瘤靶向治疗的药物目前仍在临床试验研究阶段,多种药物联用可进一步揭示其抗肿瘤机制及耐受原因,可能是克服TRAIL耐受性并获得协同效应的有效途径之一。本研究中将索拉非尼与TRAIL联合应用于K562细胞后,观察到各药单用时,K562细胞的细胞凋亡率远低于联合应用时的细胞凋亡率。可能两者在某些通路上起到了增敏互补作用,增加了TRAIL的敏感性。进一步研究中,会对相关通路的某些分子进行研究,以了解其相关的作用机制。
本研究证实:索拉非尼在体外可通过诱导细胞凋亡来抑制K562细胞的增殖,并呈现出一定的量效-时效关系。由于临床上单用或与常规的化疗药物联用可能并不能使患者获益,以索拉非尼,TRAIL等为基础的联合靶向治疗可能将成为未来肿瘤治疗的方向。综上所述,索拉非尼与TRAIL可协同抑制K562细胞的增殖,这种协同抑制作用与其诱导细胞凋亡增加有关。但其相关的分子机制仍有待进一步研究。
(References)
[1]EL-KHOUEIRY A B,RANKIN C J,BEN-JOSEF E,et al.SWOG 0514:a phaseⅡstudy of sorafenib in patients with unresectable or metastatic gallbladder carcinoma and cholangiocarcinamo[J].Invest New Drugs,2012,30(4):1646-1651.
[2]BENGALA C,BERTOLINI F,MALAVASI N,et al.Sorafenib in patients with advanced biliary tract carcinoma:a phase Ⅱ trail[J].Br J Cancer,2009,102(1):68-72.
[3]WILEY S R,SCHOOLEY K,SMOLAK P J,et al.Identification and characterization of a new member of the TNF family that induces apoptosis[J].Immunity,1995,3:673-682.
[4]许俐,陈艳,宋丽娜.TRAIL联合紫杉醇对卵巢癌细胞凋亡影响的研究[J].中国妇幼保健,2006,21(14):1999-2001.
[5]胥瑜,闫娟,李旭锋等.TRAIL联合顺铂和IFN-α对人肝癌细胞凋亡的影响[J].华西药学杂志,2007,22(4):390-392.
[6]马远方.TRAIL及其受体的研究进展[J].河南大学学报:医学版,2007,26(2):1-5.
[7]SEOK-HYUN K,STACEY RICCI M,WAFIK S.El-Deiry.Mcl-1:A gateway to TRAIL sensitization[J].Cancer Res,2008,68(7):2062-2064.
[8]肖若芝,王立琳,阮星星,等.索拉菲尼联合柔红霉素对K562细胞株协同作用的研究[J].中国实验血液学杂志,2010,18(3):621-624.
[9]WILHELM S M,CARTER C,TANG L,et al.BAY 43-9006 exhibits board spectrum oral antitumor activity and targets the BAF/MEK/ERK pathway and receptor tyrosine kinases involved in tumor progression and angiogenenesis[J].Cancer Res,2004,64(19):7099-7109.
[10]HUYNH H,NGO V C,KOONG H N,et al.Sorafenib and rapamycin induce growth suppression in mouse models of hepatocellular carcinoma[J].J Cell Mol Med,2009,13(8):2673-2683.
[11]RAHMANI M,NGUYEN T K,DENT P,et al.The multikinase-inhibitor sorafenib induces apoptosis in highly imatinib mesylate-resistant bcr/abl+human leukemia cells in association with signal transducer and activator of transcription 5 inhibition and myeloid cell leukemia-1 down regulation[J].Mol Pharmacol,2007,72(3):788-795.
[12]ADVANI A S,PENDERGAST A M.Bcr-Abl variants:biological and clinical aspects[J].Leuk Res,2002,26(8):713-720.
[13]聂金梅,徐雅君,邢永梅,等.肿瘤细胞对TRAIL耐受机制以及克服耐受性的研究进展[J].中国医药科学,2011(15):43-45.
