G蛋白偶联受体56基因敲除抑制少突胶质前体细胞成熟*
2014-05-16邓医宇朱高峰曾文新蒋文新曾红科
邓医宇, 朱高峰, 方 明, 曾文新, 蒋文新, 曾红科
(广东省人民医院,广东省医学科学院急危重症医学部,广东广州 510080)
G蛋白偶联受体56基因敲除抑制少突胶质前体细胞成熟*
邓医宇, 朱高峰, 方 明, 曾文新, 蒋文新, 曾红科△
(广东省人民医院,广东省医学科学院急危重症医学部,广东广州 510080)
目的:探讨G蛋白偶联受体56(GPR56)基因敲除对小鼠脑胼胝体内轴突髓鞘化和少突胶质前体细胞(OPCs)成熟的影响。方法:筛选出GPR56基因杂合型(GPR56+/-)和敲除型(GPR56-/-)小鼠36只,分为GPR56+/-和GPR56-/-组,每组18只。每组根据小鼠出生后时间分为出生后7 d(P7)、14 d(P14)、21 d(P21)和28 d(P28)4个亚组。应用FluoroMyelin染色观察P14、P21和P28 GPR56+/-和GPR56-/-小鼠脑胼胝体内髓鞘形成。用电镜观察P28 GPR56+/-和GPR56-/-小鼠胼胝体内轴突髓鞘化,比较髓鞘的厚度。用荧光免疫组化染色观察P7 GPR56+/-和GPR56-/-小鼠胼胝体内血小板源性生长因子α受体阳性(PDGF-αR+)细胞(即OPCs)的数量。用原位杂交监测P28 GPR56+/-和GPR56-/-小鼠胼胝体内髓鞘蛋白脂质蛋白阳性(PLP+)细胞数。用出生后1 d的GPR56+/-和GPR56-/-小鼠脑皮质做体外OPCs培养并诱导其分化成熟,观察pro-oligodendroblast、immature oligodendrocyte和mature oligodendrocyte阶段 O4+细胞百分比。结果:与 GPR56+/-小鼠比较,在 P14、P21和 P28 GPR56-/-小鼠脑胼胝体中髓鞘的形成明显减少。电镜见P28 GPR56-/-小鼠脑胼胝体内髓鞘化轴突的数量明显减少,髓鞘g-ratio值变大,髓鞘厚度变薄。荧光免疫组化和原位杂交结果显示P7 GPR56+/-和GPR56-/-小鼠胼胝体内PDGF-aR+细胞数量无差异,但P28 GPR56+/-小鼠胼胝体内PLP+细胞数明显多于P28 GPR56-/-小鼠。体外细胞培养结果显示在pro-oligodendroblast阶段GPR56-/-O4+细胞百分比明显多于GPR56+/-O4+细胞,在immature oligodendrocyte和mature oligodendrocyte阶段 GPR56-/-O4+细胞百分比明显少于 GPR56+/-O4+细胞。结论:GPR56蛋白可能参与了脑白质轴突髓鞘化和OPCs的成熟。
G蛋白偶联受体56;胼胝体;少突胶质细胞;髓鞘化
轴突的髓鞘化是一个复杂的生理过程,需要大量的信号分子参与[1]。少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)分化成熟、神经元轴突发育、成熟少突胶质细胞(oligodendrocytes,OLs)向目标轴突的迁移和OLs突起黏附到神经元轴突上发生相互作用均是轴突髓鞘化的重要环节[2]。近年来研究发现一些黏附性G蛋白偶联受体(Adhesion G-protein-coupled receptors,adhesion GPRs)可能参与了轴突的髓鞘化过程[3-4]。有研究发现Gpr126突变可导致金鱼轴突髓鞘化障碍[5],Gpr126基因突变的老鼠也表现严重的低髓鞘化周围神经病变[6]。GPR17在少突胶质细胞系特异地表达,但在轴突髓鞘化的高峰期和成熟的OLs中表达减少,Gpr17过度表达或敲除均会导致轴突髓鞘化异常[7-8]。
GPR56属于黏附性G蛋白偶联受体家族。既往报道表明:人GPR56基因发生突变会导致双侧大脑皮层多小脑沟回畸形和白质发育缺陷[9]。GPR56基因突变所致的白质萎缩和局灶MRI-T2强信号类似于多发性硬化的病理改变[10],提示GPR56有可能参与了脑白质的发育和轴突髓鞘化。为了证实GPR56蛋白是否参与神经元轴突的发育和髓鞘化,本研究利用GPR56基因敲除(GPR56-/-)小鼠,用Fluoro-Myelin染色观察不同年龄阶段 GPR56+/-和GPR56-/-小鼠胼胝体内髓鞘形成情况,用电镜观察成年GPR56+/-和GPR56-/-小鼠胼胝体内轴突髓鞘比例及髓鞘的厚度,从而证实GPR56基因敲除是否导致轴突髓鞘化障碍。同时,采用血小板源性生长因子 α受体(platelet-derived growth factor alpha receptor,PDGF-aR)免疫荧光染色、蛋白脂质蛋白(proteolipid protein,PLP)原位杂交技术及体外OPCs培养进一步证实GPR56基因敲除是否会导致OPCs分化成熟障碍,从而引起轴突低髓鞘化。
材料和方法
1 材料
GPR56基因敲除小鼠从美国哈佛大学医学院附属波士顿儿童医院Piao Xianhua博士实验室赠获。GPR56+/-和GPR56-/-小鼠在暨南大学医学院实验动物中心饲养,实验条件下自然饮食。购买商业化抗体和试剂盒:兔抗PDGF-aR(Santa Cruz)、鼠抗O4 (Chemicon)和 FluoroMyelin试剂盒(Life Technologies)。
2 方法
2.1 实验设计 将出生后小鼠进行基因分型,分为GPR56+/-和GPR56-/-组。每组在出生后7 d(P7)、14d(P14)、21d(P21)和28d(P28)各取3只小鼠进行灌流固定后行FluoroMyelin染色、免疫荧光组织化学染色或PLP原位杂交。每组在出生后28 d各取3只小鼠进行电镜检测。各组动物数见表1。
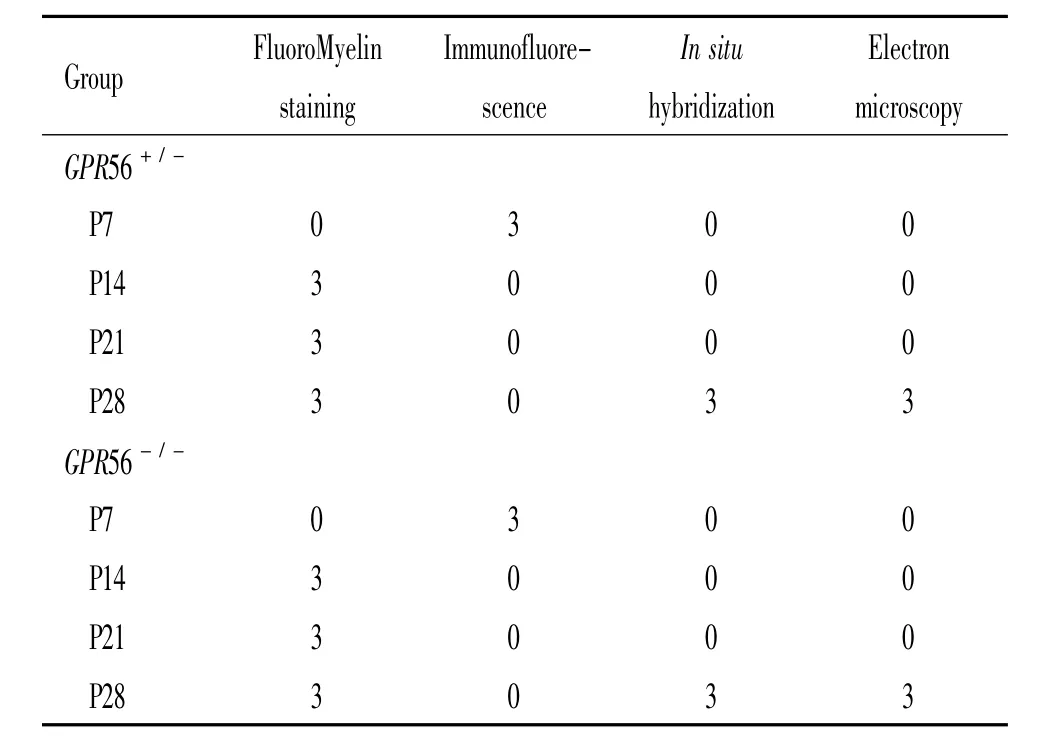
表1 GPR56+/-和GPR56-/-组在不同时点使用小鼠的数量Table 1.Numbers of mice at various time points in GPR56+/-group and GPR56-/-group
2.2 FluoroMyelin染色 FluoroMyelin染色能够快速和选择性标记冰冻脑切片内髓鞘的分布。将脑切片放在室温下用PBS漂洗20 min,同时将FluoroMyelin原液稀释300倍,随后将稀释的FluoroMyelin染色液滴加到脑切片上,在室温下染色20 min。染色完成后,用PBS漂洗3次,每次10 min。最后封片,在荧光显微镜下观察脑胼胝体内髓鞘的分布。
2.3 免疫组织化学染色 每组动物灌流、固定后移入30%蔗糖溶液过夜。冰冻切片机-20℃低温取视交叉水平冠状切片,片厚20 μm。正常工作血清封闭。用兔抗PDGF-aRⅠ抗4℃孵育过夜后,PBS清洗3次,每次10 min,滴加带红色荧光的Ⅱ抗工作液室温下孵育1 h。PBS清洗3遍后用 mounting medium封片。在荧光显微镜(Olympus System Microscope Model BX53)下观察结果。
2.4 PLP探针原位杂交 -70℃保存的切片在室温下放置30 min,直至切片回到室温,再放到50℃杂交炉中烤片烤20 min;DEPC-PBS洗片5 min;4% DEPC的多聚甲醛中前固定20 min,洗片;蛋白酶K缓冲液处理组织切片,洗片;后固定30 min;置于新配制的TEA缓冲液洗10 min;将切片浸在预杂交液中放入63~65℃的杂交炉中预杂交3~4 h;制备湿盒(干的杂交盒底部加用过的预杂交液),将含8 ng/ 100 μL地高辛标记PLP探针的杂交液加在切片上;放入65℃的杂交炉中杂交12~16 h;65℃,在预热的0.2 mol/L SSC中洗掉盖玻片;用PBT洗2次,每次20 min;10%血清(PBT稀释)封闭30 min;倒去切片上的血清,不洗,加含1∶2 000的抗地高辛抗体的血清孵育3 h;PBT洗6次,每次10 min;碱性磷酸酶缓冲液洗2次,每次5 min;加显色液,避光,显色; PBS终止显色反应;4%多聚甲醛固定1~2 h;PBS漂洗,甘油封片剂封片,室温保存。
2.5 电镜 出生后28 d GPR56+/-和GPR56-/-小鼠各3只用2%甲醛+3%戊二醛溶液灌流固定后,取大脑胼胝体制成1 mm×1 mm×1 mm组织块。用振荡切片机将组织块切成80~100 μm的切片。0.1 mol/L磷酸盐缓冲液漂洗后,用1%四氧化锇后固定2 h,脱水、树脂包埋。切超薄切片,在Philips CM 120电镜(FEI Company)下观察。从每只动物胼胝体近中侧取 4个非重叠视野,拍不同倍数的照片。用ImageJ软件测量每个神经纤维轴突和总神经纤维(轴突+髓鞘)的直径。用公式g-ratio=神经纤维轴突直径/总神经纤维(轴突+髓鞘)的直径计算g-ratio值。这个公式等同于神经纤维轴突横截面积除以总神经纤维的横截面积。比较 GPR56+/-和GPR56-/-小鼠神经纤维直径的大小。
2.6 体外OPC培养、诱导分化成熟及O4免疫组化染色 将新生 1 d小鼠进行基因分型后分为GPR56+/-和GPR56-/-组,分别进行少突胶质前体细胞培养。将小鼠断头,分离鼠脑,置于PBS中,剥去血管脑膜,分离皮质,剪碎。胰酶消化15 min后吹散,筛网过滤。800 r/min离心2 min后弃上清,细胞沉淀用DMEM培养基悬浮,计数细胞密度,接种于25 cm2塑料培养瓶中,在37℃、5%CO2的培养箱中培养。每隔3 d换液1次,培养至第7~10天,细胞融合。将培养瓶置于恒温水平摇床上,37℃、120~150 r/min、1 h,以除去小胶质细胞。丢弃细胞悬液,加入混合细胞培养基,再在恒温水平摇床上,37℃、230~260 r/min、18~20 h。吸出悬液静置于未涂多聚赖氨酸的培养瓶内,37℃、5%CO2的培养箱中静置30 min,去除少量胞体较大的星形胶质细胞和成纤维细胞。吸取细胞悬液,1 500 r/min离心5 min,弃上清,加入OPCs培养基,重悬细胞,以1×104/cm2密度接种于赖氨酸包被的24孔板中,用OPC分化培养基诱导OPCs分化成熟。培养5 d后用PBS漂洗,4%多聚甲醛固定30 min,按常规免疫荧光细胞化学方法进行O4染色。在荧光显微镜下随意选取不同的视野拍照,根据O4+细胞特异性形态计算pro-oligodendroblast、immature oligodendrocyte和 mature oligodendrocyte阶段O4+细胞百分比。
3 统计学处理
计量资料以均数±标准差(mean±SD)表示,两组之间比较用t检验。以P<0.05为差异有统计学意义。
结果
1 GPR56+/-和GPR56-/-小鼠胼胝体内髓鞘形成和分布
FluoroMyelin染色显示髓鞘主要分布在脑胼胝体内。同时,与 GPR56+/-小鼠相比,髓鞘在 P14、P21和P28 GPR56-/-小鼠胼胝体中形成和分布明显降低,见图1。
2 电镜观察GPR56+/-和GPR56-/-小鼠胼胝体中轴突髓鞘化
在低倍镜下可以观察到P28 GPR56-/-小鼠胼胝体中发生髓鞘化的轴突数目明显减少,而在P28 GPR56+/-小鼠胼胝体中发生髓鞘化的轴突数目明显增多。在P28 GPR56+/-小鼠胼胝体中轴突髓鞘在高倍电镜下为明暗相间的同心圆板层排列,结构完整,板层致密,边缘光滑。在P28 GPR56-/-小鼠胼胝体中轴突髓鞘在高倍电镜下可见髓鞘板层紊乱,髓鞘与轴索间隙增大,外形不规则,有空泡出现;高倍镜下显示P28d GPR56-/-小鼠胼胝体中轴突髓鞘厚度明显变薄。与P28 GPR56+/-小鼠轴突髓鞘相比,P28 GPR56-/-小鼠胼胝体中轴突髓鞘的g-ratio值明显变大(P<0.05),见图2。g-ratio值越大,轴突髓鞘越薄。这些结果进一步表明GPR56基因敲除使轴突髓鞘变薄,轴突髓鞘化发生障碍。
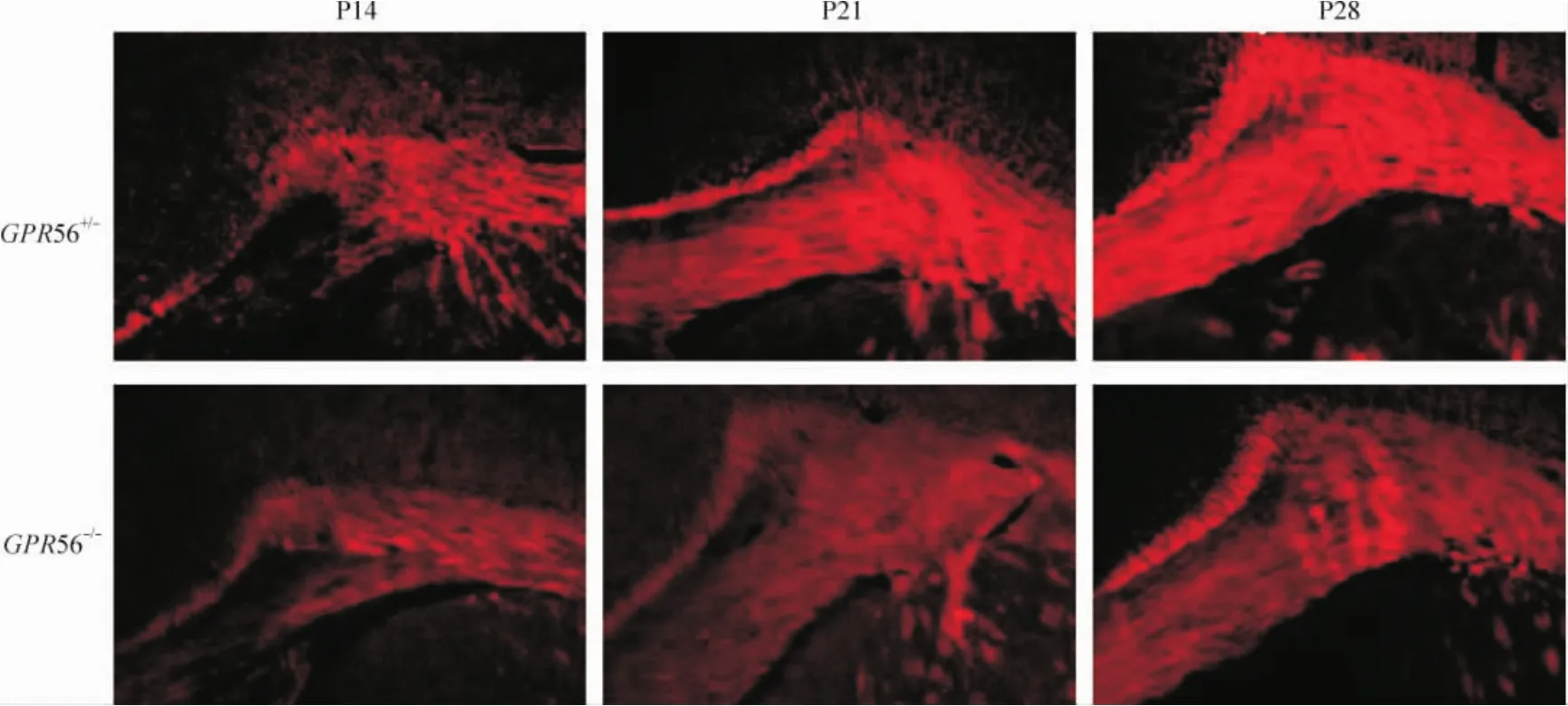
Figure 1.Distribution of myelin sheath in the corpus callosum of P14,P21 and P28 GPR56+/-and GPR56-/-mice(FluoroMyelin staining,×100).图1 髓鞘在GPR56+/-和GPR56-/-小鼠胼胝体内分布
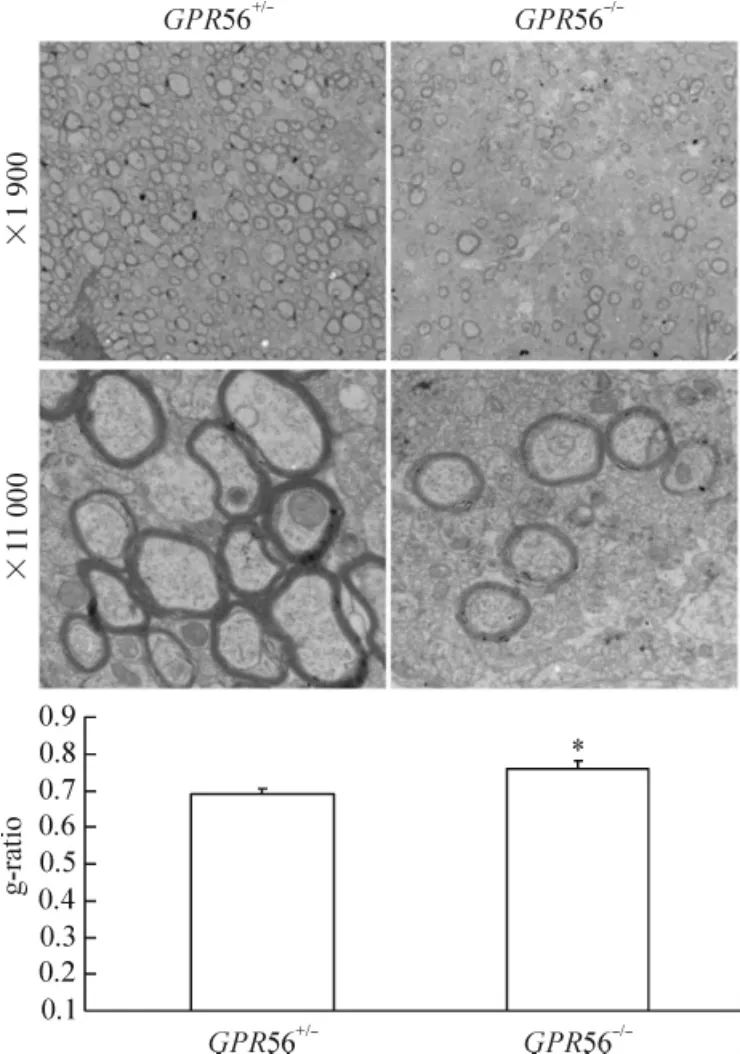
Figure 2.Electron microscopy showing axonal myelination in the corpus callosum cross-sections collected from P28 GPR56-/-and littermate control GPR56+/-mice.Mean±SD.n=3.*P<0.05 vs GPR56+/-.图2 电镜示P28 GPR56+/-和GPR56-/-小鼠胼胝体中轴突髓鞘化
3 GPR56基因敲除对OPCs成熟的影响
用PDGF-aR抗体特异染色发现,PDGF-aR阳性细胞主要分布在脑胼胝体内,见图3。细胞计数发现,在P7 GPR56-/-小鼠胼胝体内PDGF-aR+细胞数与P7 GPR56+/-小鼠,比较没有显著差异,见图3。在低倍镜下,原位杂交显示在P28 GPR56-/-小鼠胼胝体内PLP+细胞数明显少于P28 GPR56+/-小鼠,见图4。在高倍镜下,我们选不同的视野进行统计学分析发现在P28 GPR56+/-小鼠胼胝体内PLP+细胞数明显多于P28 GPR56-/-小鼠(P<0.01),见图4。这些结果表明GPR56基因敲除不影响早期OPCs的生存,而抑制了OPCs分化成熟。

Figure 3.The numbers of PDGF-aR+cells in the corpus callosum of P7 GPR56+/-and GPR56-/-mice(immunofluorescence staining,×200).Mean±SD.n=3.图3 P7 GPR56+/-和GPR56-/-小鼠胼胝体内PDGF-aR+细胞数
4 Pro-oligodendroblast、immature oligodendrocyte和mature oligodendrocyte阶段O4+细胞百分比
在pro-oligodendroblast阶段O4+细胞形态有较少的突起,在immature oligodendrocyte阶段O4+细胞有很多突起,相互交错成网格状,在mature oligodendrocyte阶段O4+细胞有髓鞘形成,呈现地图状,见图5A。在同等诱导成熟条件下,相同数目GPR56+/-和GPR56-/-OPCs在诱导分化成熟5 d后进行O4染色发现,在pro-oligodendroblast阶段GPR56-/-O4+细胞百分比明显多于GPR56+/-O4+细胞,而在im-mature oligodendrocyte和 mature oligodendrocyte阶段GPR56-/-O4+细胞百分比明显少于GPR56+/-O4+细胞,见图5B。这些结果进一步在体外表明GPR56基因敲除可以抑制OPCs分化和成熟。
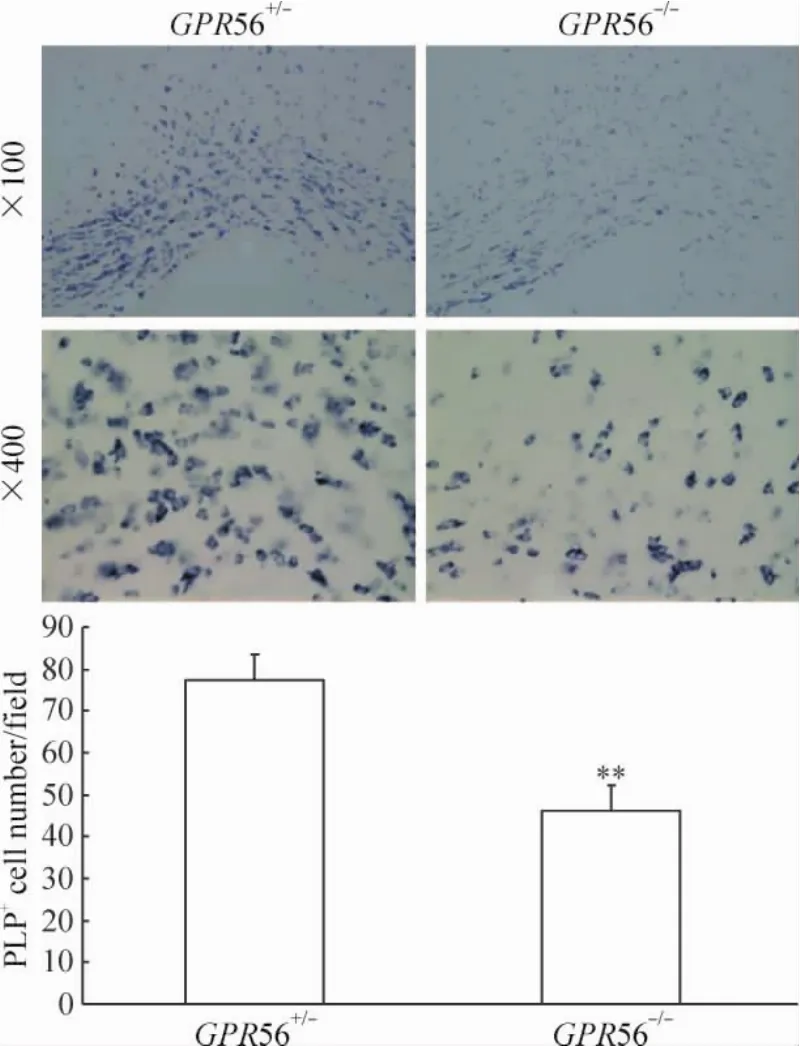
Figure 4.In situ hybridization showing the numbers of PLP+cells in the corpus callosum of P28 GPR56+/-and GPR56-/-mice.Mean±SD.n=3.**P<0.01 vs GPR56+/-.图4 原位杂交示P28 GPR56+/-和GPR56-/-小鼠胼胝体内PLP+细胞数
讨论
FluoroMyelin染色是利用轴突髓鞘含脂量高进行的一种亲脂性染色[11]。与传统的髓鞘染色方法相比FluoroMyelin染色步骤简短,耗时短,只需20 min就可以显示出轴突髓鞘的定位和含量[11]。另外,特异性好,它对细胞膜的脂质亲和力低,对髓鞘内脂质的亲和力高,因此能够特异地显示轴突髓鞘[11]。目前很多研究者采用此方法研究轴突髓鞘[12]。我们的研究结果显示:GPR56基因敲除后在小鼠胼胝体内轴突髓鞘形成明显减少。电镜结果发现:在 P28 GPR56-/-小鼠胼胝体内髓鞘化轴突的数目明显减少,髓鞘的厚度变薄。电镜发现与FluoroMyelin染色结果一致,进一步证实了GPR56基因参与了轴突的髓鞘化过程。
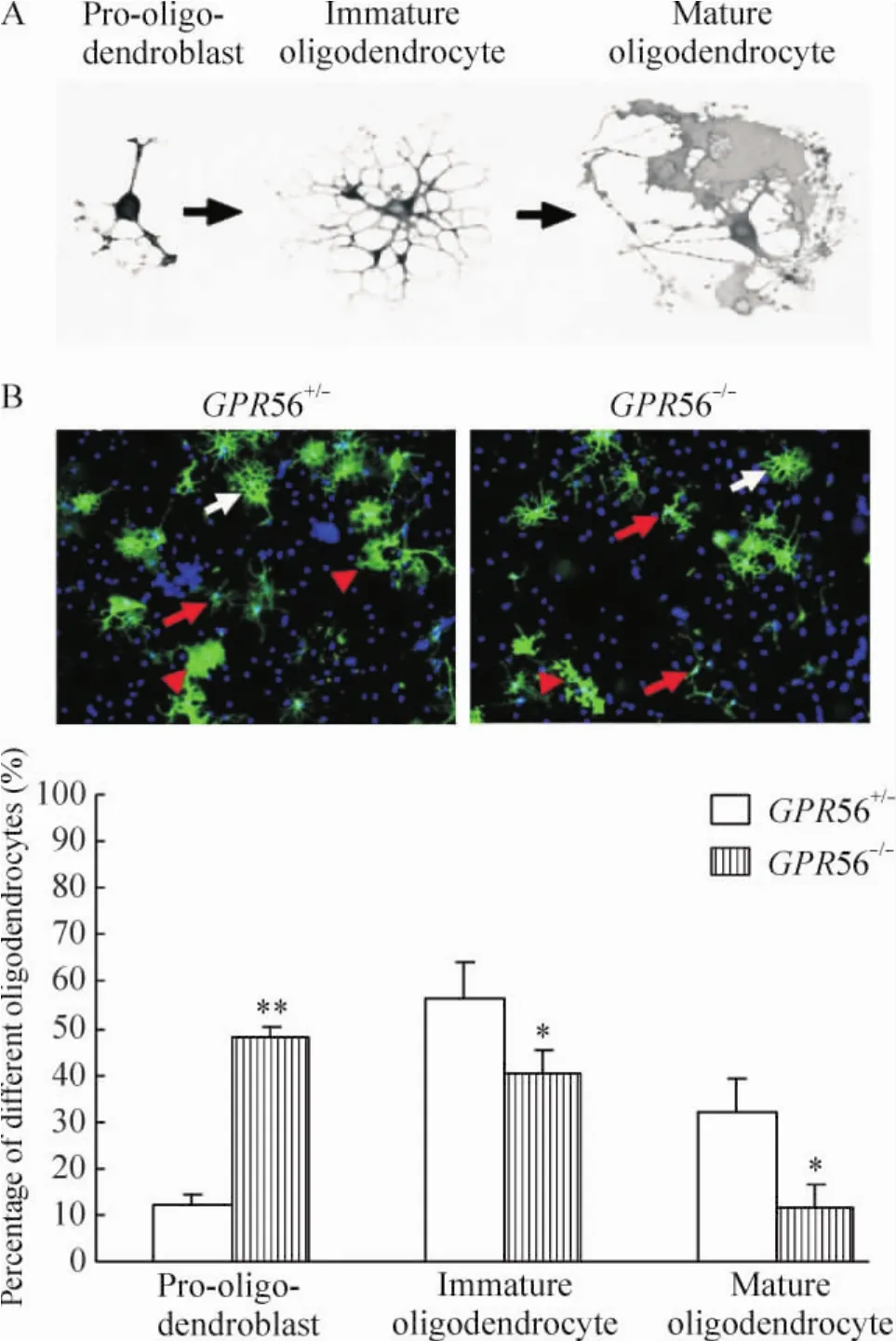
Figure 5.O4 staining showing GPR56+/-and GPR56-/-OPCs differentiation in vitro.A:schematic diagram of the morphology of O4+oligodendrocytes at different stages;B:O4 immunostaining of the primary oligodendrocytes(×200).The red arrows represent OPCs at pro-oligo-dendroblast stage.The white arrows represent OPCs at immature oligodendrocyte stage.The red arrow heads represent OPCs at mature oligodendrocyte stage.Mean±SD.n=3.*P<0.05,**P<0.01 vs GPR56+/-.图5 O4染色显示GPR56+/-和GPR56-/-少突胶质细胞体外分化情况
轴突的髓鞘化是成熟少突胶质细胞突起缠绕轴突形成的多层脂质髓鞘,此过程包括3个方面:(1) OPCs分化成熟;(2)神经元轴突成熟;(3)成熟OLs向目标轴突的迁移、OLs突起黏附到神经元轴突上和OLs突起缠绕轴突形成髓鞘[13]。OPCs的分化和成熟在轴突髓鞘化中起着关键作用。成熟的OLs来源于OPCs。OPCs分化为成熟的OLs要经历Pre-O-2A、O-2A progenitor、pro-oligodendroblast、immature oligodendrocyte和 mature oligodendrocyte 5个发育阶段[14]。有很多基因参与OPCs上述的分化成熟的调控[15-16]。那么,GPR56基因是否参与了OPCs分化成熟的调控?为了证实这一点,我们对P7 GPR56+/-和GPR56-/-小鼠胼胝体进行PDGF-aR免疫染色,对P28 GPR56+/-和GPR56-/-小鼠胼胝体进行PLP原位杂交染色,然后进行PDGF-aR+和PLP+细胞计数,比较两者差异。PDGF-aR+细胞是OPCs发育早期阶段的细胞,PLP+细胞是成熟的OLs。我们研究发现:P7 GPR56+/-和 GPR56-/-小鼠胼胝体内PDGF-aR+细胞数没有明显差别,但P28GPR56-/-小鼠胼胝体 PLP+细胞即成熟的 OLs明显少于 P28 GPR56+/-小鼠。这表明 GPR56基因不影响早期OPCs生存,而影响OPCs分化成熟。为了进一步证实这个结论,我们在体外进行 GPR56+/-和GPR56-/-OPCs培养并诱导分化成熟,发现GPR56-/-OPCs分化成熟能力明显降低。因此,体外细胞培养实验结果与动物实验结果一致。建立在这些实验基础之上,我们可以推测GPR56蛋白是OPCs分化成熟所必需,缺乏它会导致OPCs成熟障碍,从而也会导致脑白质低髓鞘化。这一发现对于我们理解和治疗轴突髓鞘化障碍相关性疾病有极其重要的意义。
[1]Zuccaro E,Arlotta P.The quest for myelin in the adult brain[J].Nat Cell Biol,2013,15(6):572-575.
[2]Emery B.Regulation of oligodendrocyte differentiation and myelination[J].Science,2010,330(5):779-782.
[3]Bjarnadottir TK,Fredriksson R,Schioth HB.The adhesion GPCRs:a unique family of G protein-coupled receptors with important roles in both central and peripheral tissues[J].Cell Mol Life Sci,2007,64(16):2104-2119.
[4]Strokes N,Piao X.Adhesion-GPCRs in the CNS[J].Adv Exp Med Biol,2010,706:87-97.
[5]Monk KR,Naylor SG,Glenn TD,et al.A G protein-coupled receptor is essential for Schwann cells to initiate myelination[J].Science,2009,325(5946):1402-1405.
[6]Monk KR,Oshima K,Jors S,et al.Gpr126 is essential for peripheral nerve development and myelination in mammals[J].Development,2011,138(13):2673-2680.
[7]Chen Y,Wu H,Wang S,et al.The oligodendrocyte-specific G protein-coupled receptor GPR17 is a cell-intrinsic timer of myelination[J].Nat Neurosci,2009,12(11): 1398-1406.
[8]Ceruti S,Vigano F,Boda E,et al.Expression of the new P2Y-like receptor GPR17 during oligodendrocyte precursor cell maturation regulates sensitivity to ATP-induced death[J].Glia,2011,59(3):363-378.
[9]Luo R,Jeong SJ,Jin Z,et al.G protein-coupled receptor 56 and collagen III,a receptor-ligand pair,regulates cortical development and lamination[J].Proc Natl Acad Sci U S A,2011,108(31):12925-12930.
[10]Chang BS,Piao X,Bodell A,et al.Bilateral frontoparietal polymicrogyria:clinical and radiological features in 10 families with linkage to chromosome 16[J].Ann Neurol,2003,53(5):596-606.
[11]Monsma PC,Brown A.FluoroMyelinTMRed is a bright,photostable and non-toxic fluorescent stain for live imaging of myelin[J].J Neurosci Methods,2012,209(2):344-350.
[12]Payne SC,Bartlett CA,Harvey AR,et al.Myelin sheath decompaction,axon swelling,and functional loss during chronic secondary degeneration in rat optic nerve[J].Invest Ophthalmol Vis Sci,2012,53(10):6093-6101.
[13]Nave KA.Myelination and support of axonal integrity by glia[J].Nature,2010,468(7321):244-252.
[14]Armstrong RC.Isolation and characterization of immature oligodendrocyte lineage cells[J].Methods,1998,16 (3):282-292.
[15]Emery B.Transcriptional and post-transcriptional control of CNS myelination[J].Curr Opin Neurobiol,2010,20 (5):601-607.
[16]夏君慧,翁益云,李 佳,等.重组人髓鞘少突胶质细胞糖蛋白的表达、纯化及免疫原性[J].中国病理生理杂志,2011,27(6):1245-1248.
Knockout of GPR56 gene inhibits maturation of oligodendrocyte progenitor cells
DENG Yi-yu,ZHU Gao-feng,FANG Ming,ZENG Wen-xin,JIANG Wen-xin,ZENG Hong-ke
(Emergency and Critical Care Department,Guangdong General Hospital,Guangdong Academy of Medical Sciences,Guangzhou 510080,China.E-mail:zenghongke@vip.163.com)
AIM:To explore the effect of G-protein-coupled protein 56(GPR56)gene knockout on axonal myelination and the maturation of oligodendrocyte progenitor cells(OPCs)in the corpus callosum of mouse brain.METHODS:Thirty-six GPR56+/-and GPR56-/-mice were selected and divided into GPR56+/-group and GPR56-/-group (18 mice in each group).According to the postnatal days,the mice in each group were further divided into P7,P14,P21 and P28 subgroups.Myelin formation in the corpus callosum of P14,P21 and P28 GPR56+/-and GPR56-/-mice was observed by FluoroMyelin staining.The number of myelinated axons and thickness of myelin sheaths were measured by electron microscopy.The numbers of platelet-derived growth factor alpha receptor-positive(PDGF-aR+)and proteolipid protein-positive(PLP+)cells in the corpus callosum of GPR56+/-and GPR56-/-mice were compared by the methods of immunofluorescence and in situ hybridization.GPR56+/-and GPR56-/-OPCs were cultured using P1 GPR56+/-and GPR56-/-mouse brain cortex and induced differentiation and maturation in vitro.The percentage of GPR56+/-and GPR56-/-O4+cells in pro-oligodendroblast,immature oligodendrocyte and mature oligodendrocyte stages was compared by O4 immunostaining.RESULTS:The myelin formation was obviously reduced in the corpus callosum of P14,P21 andP28 GPR56-/-mice as compared with GPR56+/-mice.The number of myelinated axons was obviously reduced and the gratio value was increased significantly in the corpus callosum of P28 GPR56-/-mice.No significant difference of the PDGF-aR+cell number in the corpus callosum between P7 d GPR56+/-and GPR56-/-mouse brains was observed.The number of PLP+cells was significantly decreased in the corpus callosum of P28 GPR56-/-mice as compared with GPR56+/-mice.The percentage of GPR56-/-O4+cells in pro-oligodendroblast stages was obviously higher than that of GPR56+/-O4+cells.On the contrary,the percentages of GPR56-/-O4+cells in immature oligodendrocyte and mature oligodendrocyte stages were significantly reduced.CONCLUSION:GPR56 may be involved in axonal myelination and OPCs maturation in the corpus callosum of mouse brain.
G-protein-coupled receptor 56;Corpus callosum;Oligodendrocytes;Myelination
R363
A
10.3969/j.issn.1000-4718.2014.03.013
1000-4718(2014)03-0454-06
2013-11-06
2014-01-13
国家自然科学基金资助项目(No.81271329)
△通讯作者Tel:020-83837812-60228;E-mail:zenghongke@vip.163.com
