吗啡对μ阿片受体介导的ERK磷酸化的影响
2014-05-15边佳明张梅
边佳明,张梅
(北京军区总医院药理科,北京 100700)
吗啡对μ阿片受体介导的ERK磷酸化的影响
边佳明,张梅
(北京军区总医院药理科,北京 100700)
目的 利用表达μ阿片受体的中国仓鼠卵巢细胞,研究吗啡急慢性处理下对细胞外信号调节激酶(ERK)磷酸化的影响。方法免疫印迹检测磷酸化ERK水平,获取1 h急性处理的ERK磷酸化变化时程和36 h慢性处理以及纳洛酮催促下的ERK磷酸化变化。结果1 μmol·L-1吗啡可以快速诱导ERK磷酸化水平短暂升高,5 min时达峰(P<0.01),吗啡诱导的ERK磷酸化水平升高具有显著的浓度依赖性。10 μmol·L-1吗啡慢性处理36 h后ERK磷酸化水平与对照组比较,差异无统计学意义,但纳洛酮急性催促5或10 min均导致ERK磷酸化显著下降(与对照比较,P<0.01)。结论吗啡急慢性刺激下以及纳洛酮催促下ERK磷酸化表现出不同的变化形式,提示μ阿片受体介导下ERK相关的信号通路发生了代偿。
吗啡;μ阿片受体;卵巢细胞;细胞外信号调节激酶;磷酸化
阿片受体是典型的G蛋白耦联受体,通过耦联Gi/o蛋白,激活腺苷酸环化酶(adenylate cyclase,AC)Ⅰ、Ⅴ、Ⅵ(ACⅠ、Ⅴ、Ⅵ),从而抑制环单磷酸腺苷(cyclic adenosine monophosphate,cAMP)信号通路[1]。细胞内信号转导存在广泛的对话(cross talk)机制,研究不同信号转导通路间的对话对了解信号转导机制,寻找新的干预靶点十分有意义。酪氨酸激酶受体激活的有丝分裂原激活的蛋白激酶(mitogen-activated protein kinase,MAPK)通路是细胞内另一条极其重要的信号通路,其家族中Raf-MEK-ERK级联通路与细胞的生长、分化、存活密切相关[2]。笔者利用表达外源性μ阿片受体的中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞,研究吗啡急慢性处理下细胞外信号调节激酶(extracellular regulated kinase,ERK)磷酸化的变化,以期了解吗啡刺激下μ阿片受体介导的ERK磷酸化的变化规律。
1 材料与方法
1.1 材料 硫酸吗啡,购自青海制药公司(批号: 040618,纯度:99%);盐酸纳洛酮(批号:1028107,纯度:99%)、苯甲基磺酰氟(phenylmethyl sulfonylfluoride,PMSF,批号:378212,纯度:99%)等购自Sigma-Aldrich(美国);小鼠抗磷酸化ERK(T204)单克隆抗体(批号:I1009)、兔抗ERK单克隆抗体(批号: I0408)购自Santa Cruz(美国);辣根过氧化物酶标记的二抗(批号:20100112)购自北京中杉金桥生物技术有限公司;DMEM/F12培养液(批号:M76598)和G418 (批号:K27184)购自Invitrogen(美国);高灵敏增强化学发光试剂(enhanced chemiluminescence,ECL,批号: S120987)购自Millipore(美国);其余所用化学试剂均为分析纯。
1.2 仪器 蛋白电泳和转印采用Bio-rad电泳仪(美国),凝胶成像和分析采用Alpha凝胶成像系统(美国),蛋白浓度测定通过岛津UV160-A型紫外分光光度仪(日本)完成。
1.3 细胞培养和药物处理 稳定表达μ阿片受体的CHO细胞(CHO/μ)由军事医学科学院提供(2.9 pmol·mg-1膜蛋白)[3],维持于含10%胎牛血清的DMEM/F12培养液中,含1×105U·L-1青霉素, 100 mg·L-1链霉素和200 mg·L-1的G418,37℃,5%二氧化碳(CO2)培养。细胞正常传代培养。
对于药物急性刺激,药物处理前24 h,细胞以4×105个种于6孔板,待细胞达到80%~90%融合,撤血清过夜,根据图注中描述的方法处理细胞;对于慢性给药,细胞以密度1×105个种于6孔板,贴壁后用含药完全培养液继续培养细胞36 h(期间换含药培养液1次)。
1.4 免疫印迹 细胞经药物处理完毕后,立即将6孔板置于冰面,倾倒含药培养液,4℃磷酸缓冲液(phosphat buffered solution,PBS)洗2次,吸干残留液体,加入4℃细胞裂解液60 μL[含三羟甲基氨基甲烷( tris hydroxylmethyl aminomethane,TRIS)50 mmol·L-1,氯化钠(NaCl)150 mmol·L-1,乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)1 mmol·L-1,依他酸(egtazic acid,EGTA)1 mmol·L-1,1%聚氧乙烯壬基苯醚40[Nonyl phenoxypoly(ethyleneoxy)ethanol-40,NP-40],PMSF1 mmol·L-1;以及蛋白酶抑制剂cocktail和磷酸酶抑制剂(pH=7.4),立即用细胞刮将细胞刮下收集入1.5 mL离心管,所有操作在冰上进行。冰上继续裂解20 min,之后12 000 r·min-1(r=70 mm),4℃,离心20 min,小心吸取上清液,考马斯亮蓝法测定蛋白浓度。
蛋白免疫印迹参照文献[4]中蛋白免疫印迹法进行。取各组样品蛋白20 μg用12%聚丙烯酰胺凝胶电泳分离,半干转印法将蛋白转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜上,5%脱脂奶粉室温封闭1 h,一抗4℃孵育过夜。ECL显影,凝胶成像仪拍照,对每个条带的光密度值进行分析。需要再生的膜用适量膜再生液37℃,80 r·min-1,孵育1 h,洗净膜再生液后,孵育其他一抗。图1~4中所示印记条带上方为p44(ERK1),下方为p42(ERK2)。
1.5 统计学方法 采用Alpha View软件中自带的光密度分析模块,自动扣除背景,获取光密度值。所有数据来源于3或4次独立的实验,以均数±标准差(±s)表示,ERK的磷酸化水平(pERK1/2)用总ERK量(ERK1/2)均一化,并设定对照组为1,其余给药组表示为对照组的倍数。全部数据统计分析由GraphPad 5.0软件完成,统计方法见图注,P<0.05为差异有统计学意义。
2 结果
2.1 吗啡急性刺激下激活ERK磷酸化的时效关系和量效关系 1 h时效曲线显示,与对照(0 min)相比, 1 μmol·L-1吗啡处理5 min(q=4.770)和10 min(q= 3.814)时,导致ERK磷酸化水平显著升高,并在5 min达峰,约是对照的2.3倍,随后逐渐降低,20 min时接近对照水平,与对照比较,差异无统计学意义(图1)。吗啡急性处理5 min的量效关系结果显示,1~10 μmol·L-1吗啡可以浓度依赖性地引起ERK磷酸化水平升高,与对照(无药物刺激)比较, 0.1 μmol·L-1(q=3.607)、1 μmol·L-1(q=6.885)和10 μmol·L-1(q=9.309)吗啡均可显著诱导ERK磷酸化水平升高,诱导程度与吗啡浓度呈正比(图2)。为确证ERK磷酸化是由μ阿片受体激动所致,使用阿片受体拮抗药纳洛酮(NLX)预处理细胞后再用吗啡刺激,结果显示纳洛酮预处理使吗啡诱导的ERK激活完全消失(q=6.776,图3),提示ERK磷酸化是由于μ阿片受体激动所致。
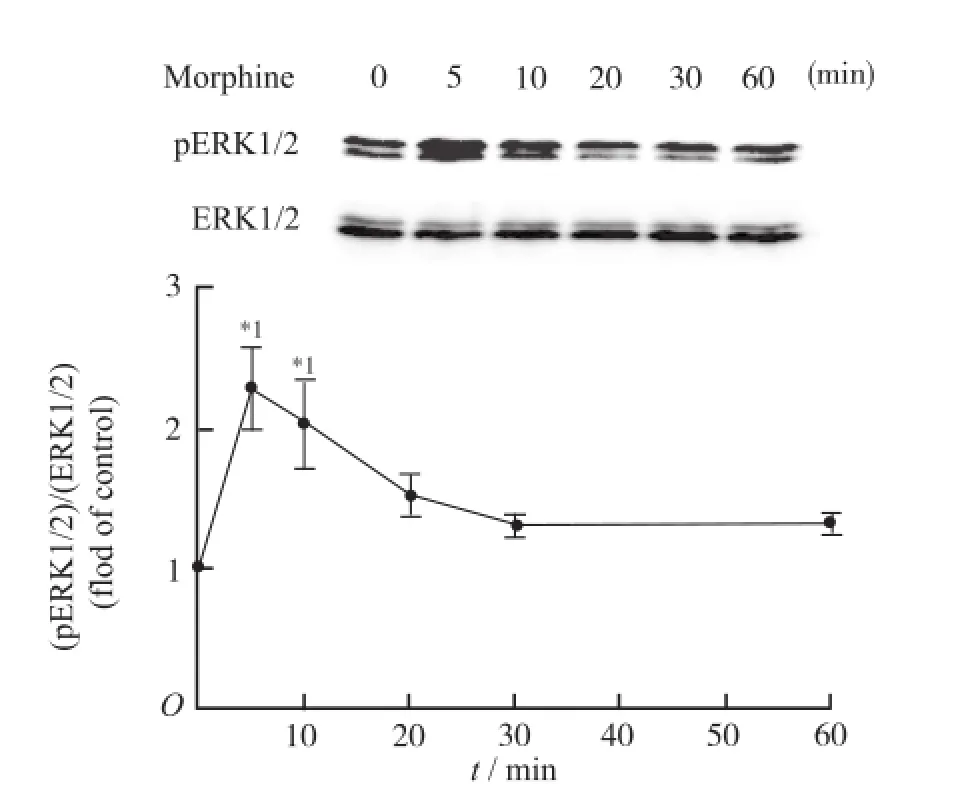
1 μmol·L-1吗啡不刺激或刺激细胞5,10,20,30,60 min,结束后立即裂解收集,蛋白免疫印迹分析;n=3,单因素方差分析,Dunnett's post-hoc检验,与对照(0 min)比较,*1P<0.01图1 吗啡诱导ERK磷酸化的时效曲线Cells were exposed in vehicle or 1 μmol·L-1morphine for 5, 10,20,30,60 min,then lysed and collected for immunoblots.n=3. One-way ANOVA was used followed by Dunnett's post-hoc test,*1P<0.01,compared with control(0 min)Fig.1 Time-effect curve of morphine-induced ERK phosphorylation
2.2 慢性吗啡处理对ERK磷酸化的影响 本实验通过吗啡慢性处理来了解ERK通路做出的反应,同时为模仿吗啡长期用药后引起的戒断反应,在吗啡处理36 h后,再用纳洛酮催促戒断。观察ERK磷酸化的变化模式。因此将细胞分为对照组(0.9%氯化钠溶液处理36 h),吗啡慢性处理组(吗啡处理36 h),纳洛酮催促5 min组和纳洛酮催促10 min组。结果显示(图4),10 μmol·L-1吗啡慢性处理细胞36 h后,与对照组比较,ERK磷酸化水平无显著性改变,提示ERK磷酸化对吗啡的持续刺激表现为脱敏。但纳洛酮催促后,与对照组比较,ERK磷酸化水平显著降低(均P<0. 01,5 min:q=18.64,10 min:q=20.29),5 min纳洛酮催促与10 min纳洛酮催促比较差异无统计学意义。

不同浓度吗啡刺激细胞5 min,结束后立即裂解收集,蛋白免疫印迹分析;n=3,单因素方差分析,Dunnett's post-hoc检验,与对照组(0 min)比较,*1P<0.01,*2P<0.05图2 吗啡诱导ERK磷酸化的量效曲线Cells were stimulated by serial concentration of Morphine for 5 min,then lysed and collected for immunoblots.n=3.One-way ANOVA was used followed by Dunnett's post-hoc test,*1P<0.01,*2P<0.05,compared with the control group(0 min)Fig.2 Dosage-effect curve of morphine-induced ERK phosphorylation
3 讨论
ERK通路是一条将胞外信号转移至细胞核的重要途径,该通路通过三级蛋白激酶(Raf-MEK-ERK)级联磷酸化而逐次激活,其中ERK包括ERK1和ERK2两个亚型,ERK1和ERK2的活化(即磷酸化)是将信号转移至核的关键[5]。研究发现,阿片受体通路与ERK通路的对话可能参与到阿片依赖当中[6],ERK活性对于药物引起的关联性记忆来说是不可或缺的[7]。阿片受体通路与ERK通路之间对话的机制尚不清楚,但正是这种对话机制的存在,阿片受体既可通过经典的cAMP通路调节基因表达;又可通过ERK通路调节基因表达,从而实现转录水平的精细调控[1]。利用表达μ阿片受体的CHO细胞,研究经典药物吗啡急慢性刺激下对ERK活性的影响,以便在体外水平阐述阿片受体在不同激活状态下ERK通路的活性变化模式。

Con:对照溶剂处理细胞;NLX+morphine:10 μmol·L-1纳洛酮预处理细胞30 min后,再加1 μmol·L-1morphine处理5 min;morphine:对照溶剂处理30 min后,再用1 μmol·L-1吗啡处理5 min。n=4,单因素方差分析,Dunnett's post-hoc检验,与对照组(Con)比较,*1P<0.01图3 纳洛酮完全拮抗吗啡诱导的ERK磷酸化Con:cells were stimulated by vehicle;NLX plus morphine: cells were pretreated by 10 μmol·L-1of Naloxone for 30 min,and then stimulated by 1 μmol·L-1of Morphine for 5 min;Morphine: cells were pretreated by vehicle for 30 min,and then stimulated by 1 μmol·L-1of Morphine for 5 min.n=4,One-way ANOVA was used followed by Dunnett's post-hoc test,*1P<0.01,compared with the control group(Con)Fig.3 Antagonism of naloxone on morphine-induced ERK phosphorylation
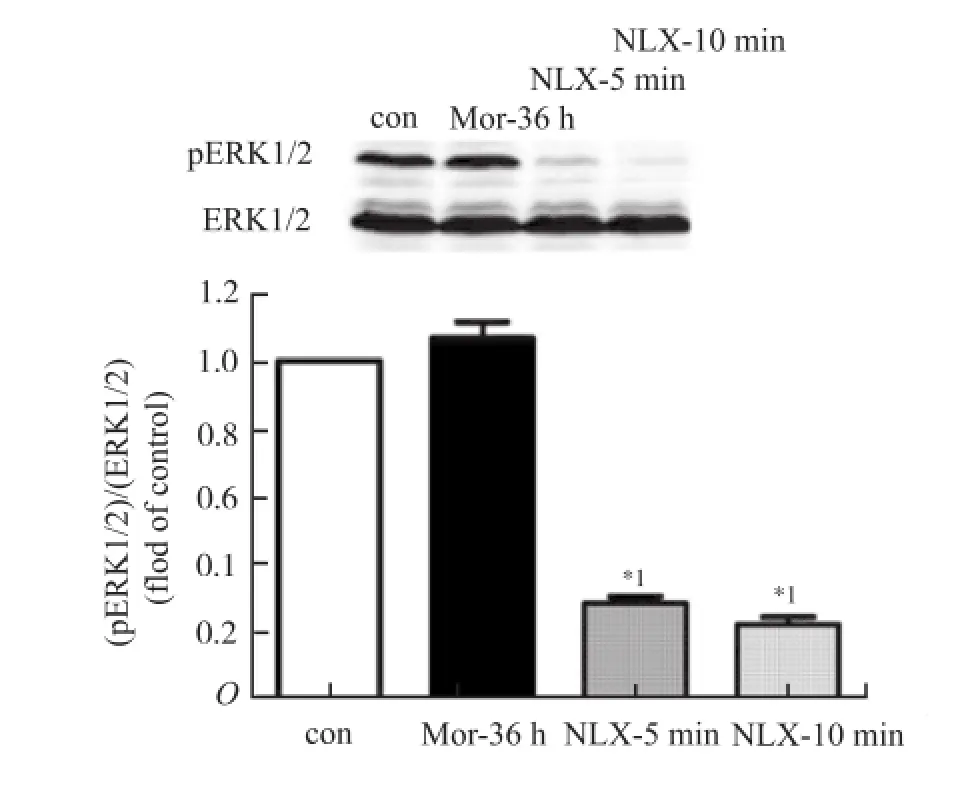
对照组(Con)以对照溶剂慢性处理细胞36 h,Mor-36 h组, Nlx-5 min组以及Nlx-10 min组以10 μmol·L-1吗啡处理细胞36 h,之后催促组(Nlx-5 min,Nlx-10 min)用完全培养液润洗2次,纳洛酮5 μmol·L-1处理5或10 min。处理完成后,蛋白免疫印迹分析。n=3,单因素方差分析,Dunnett's post-hoc检验,与con比较,*1P<0.01图4 吗啡慢性处理36 h以及纳洛酮催促对ERK磷酸化的影响Cells were exposed in 10 μmol·L-1morphine(Mor-36 h)or vehicle(Con)for 36 h,and then were washed twice with culture medium,and the withdrawal was preceded by precipitating the cells with 5 μmol·L-1naloxone for 5 min(NLX-5 min)or 10 min (NLX-10 min).n=3,One-way ANOVA was used followed by Dunnett's post-hoc test,*1P<0.01,compared with control groupFig.4 Effect of chronic morphine treatment for 36 h and naloxone precipitation on ERK phosphorylation
时效数据显示,1 μmol·L-1吗啡可以瞬时刺激细胞磷酸化ERK水平显著升高,5 min时即达到最大刺激水平,随后下降,至20 min时已差异无统计学意义,提示MOR的激活可以立即通过ERK通路对下游靶基因进行调节,但这种调节是瞬时的,ERK的活性很快恢复到了静息水平。量效数据显示,在10-9~10-5mol·L-1浓度范围内吗啡可以剂量依赖性的增强急性ERK磷酸化升高的程度,提示吗啡给予的剂量与ERK活性正相关。吗啡长时间的刺激将导致信号通路的代偿性适应,以cAMP为例,吗啡急性刺激抑制cAMP合成,但长时间的吗啡刺激将导致AC活性代偿性的升高,此时一旦去除吗啡并给予阿片受体拮抗药纳洛酮处理,将导致cAMP水平迅速大幅升高,形成所谓的cAMP超射现象[8]。同样,吗啡慢性处理下ERK通路一定也存在某种形式的代偿性适应,而且纳洛酮催促后可能会出现某种形式的“戒断”反应。本实验数据显示,10 μmol·L-1吗啡慢性处理细胞36 h后,ERK的活性水平与对照比较没有显著性变化,提示存在某种机制使得ERK磷酸化对吗啡的刺激脱敏;而用纳洛酮催促戒断后立即观察可见ERK活性的极其显著下降,提示这种代偿性机制在没有了吗啡的刺激后得到放大,可能因此导致了ERK磷酸化水平的显著下降。笔者推测,纳洛酮催促导致的ERK活性下降或许与cAMP超射有关。有文献显示,PKA可以磷酸化Raf-1 (Raf激酶的一个重要亚型)的一个抑制型位点导致Raf-1活性被抑制[9],因此,纳洛酮诱导的cAMP水平迅速升高或许引起了PKA活性的快速升高,从而导致Raf-1活性被抑制,继而导致ERK磷酸化水平下降。但这种代偿机制的设想还需要进一步研究。
[1] BIAN J M,WU N,SU R B,et al.Opioid receptor trafficking and signaling:what happens after opioid receptor activation [J].Cell Mol Neurobiol,2012,32(2):167-184.
[2] ROUX P P,BLENIS J.ERK and p38 MAPK-activated protein kinases:a family of protein kinases with diverse biological functions[J].Microbio Mol Bio Rev,2004,68 (2):320-344.
[3] WU N,SU R B,ZHAO Y,et al.Role of I1-imidazoline receptor on naloxone-induced cAMP overshooting in chronic morphine treated CHO-μ/I1 cells[J].Biochem Pharmcol, 2005,70(7):1079-1087.
[4] LI F,WU N,SU R B,et al.Comparison of agmatine with moxonidine and rilmenidine in morphine dependence in vitro:role of imidazoline I1 receptors[J].Eur J Pharmacol, 2009,612(1-3):1-8.
[5] THOMAS G M,HUGANIR R L.MAPK cascade signalling and synaptic plasticity[J].Nat Rev Neuros,2004,5(3): 173-183.
[6] LIGEZA A,WAWRZCZAK-BARGIEL A,KAMINSKA D,et al.Regulation of ERK1/2 phosphorylation by acute and chronicmorphine-implicationsfortheroleofcAMP-responsive element binding factor(CREB)-dependent and Ets-like protein-1(Elk-1)-dependent transcription;small interfering RNA-based strategy[J].FEBS J,2008,275 (15):3836-3849.
[7] GIRAULT J A,VALJENT E,CAHOCHE J,et al.ERK2:a logical and gate critical for drug-induced plasticity[J].Curr Opin Pharmacol,2007,7(1):77-85.
[8] SHY M,CHAKRABARTI S,GINTZLER A R.Plasticity of adenylyl cyclase-related signaling sequelae after long-term morphine treatment[J].Mol Pharmacol,2008,73(3):868-879.
[9] DHILLON A S,VON KRIEGSHEIM A,GRINDLAY J,et al. Phosphatase and feedback regulation of Raf-1 signaling[J]. Cell Cycle,2007,6(1):1-7.
DOI 10.3870/yydb.2014.11.012
Effects of Morphine on μ Opioid Receptor-mediated ERK Phosphorylation
BIAN Jia-ming,ZHANG Mei
(Department of Pharmacology,Military General Hospital of Beijing PLA,Beijing 100700,China)
ObjectiveTo study the phosphorylation mode of extracellular regulated kinase(ERK)induced by acute and chronic morphine treatment on Chinese hamster ovary(CHO)cells expressed with μ opioid receptors.MethodsThe time course of ERK phosphorylation 1 h and 36 h after morphine exposure as well as naloxone-precipitated withdrawal was detected by immunobloting.ResultsA transient enhancement of ERK phosphorylation was induced by 1 μmol·L-1morphine with the peak effect at 5 min(P<0.01),and the effect was dose-dependent.No difference in ERK phosphorylation was found after 36h of treatment with 10 μmol·L-1morphine compared with the control.However,5 or 10 min-naloxone precipitation induced remarkable decrease in ERK phosphorylation compared with the control(P<0.01).ConclusionDifferent changes of ERK phosphorylation were found under acute and chronic morphine treatment and naloxone precipitation,indicating a compensation of ERK related pathway induced by μ opioid receptors.
Morphine;μ opioid receptor;Ovary cells;ERK;Phosphorylation
R971;R965
A
1004-0781(2014)11-1446-04
2013-11-15
2013-12-05
边佳明(1976-),男,内蒙古集宁人,主管药师,博士,研究方向:分子药理学、遗传药理学。电话:010-66721898,E-mail:bianbenjamin@163.com。
