17β雌二醇对氯胺酮所致神经元凋亡的影响
2014-05-15李建立梁巍吴红海侯艳宁
李建立,梁巍,吴红海,侯艳宁
(1.河北省人民医院麻醉科,石家庄 050051;2.河北省人民医院小儿外科,石家庄 050051;3.白求恩国际和平医院药剂科,石家庄 050082)
17β雌二醇对氯胺酮所致神经元凋亡的影响
李建立1,梁巍2,吴红海3,侯艳宁3
(1.河北省人民医院麻醉科,石家庄 050051;2.河北省人民医院小儿外科,石家庄 050051;3.白求恩国际和平医院药剂科,石家庄 050082)
目的 研究17β雌二醇对氯胺酮所致原代培养皮质神经元凋亡的影响及其机制。方法原代培养皮质神经元,体外培养7 d,随机分为空白对照组(给予相同体积的DMSO),雌二醇组(17β雌二醇终浓度为0.1 μmol·L-1),氯胺酮组(氯胺酮终浓度为100 μmol·L-1),氯胺酮+雌二醇组(氯胺酮,17β雌二醇终浓度分别为100 μmol·L-1,0.1 μmol·L-1)。噻唑蓝(MTT)法检测神经元存活率,Hoechest33258染色法检测皮质神经元凋亡,Western-blot法测定cleaved-Caspase-3及Bcl-2蛋白表达。结果氯胺酮组神经元存活率(54.02±7.78)%,明显低于空白对照组;氯胺酮+雌二醇组神经元存活率(88.09±6.54)%,明显高于氯胺酮组。神经元经Hoechest33258染色在荧光显微镜下观察,氯胺酮组神经元凋亡[凋亡率(49.50±4.34)%]较空白对照组明显增加,氯胺酮+雌二醇组[凋亡率(15.74±3.40)%]较氯胺酮组神经元凋亡下降。氯胺酮组cleaved-Caspase-3表达明显增加,Bcl-2明显下降,而氯胺酮+雌二醇组较氯胺酮组cleaved-Caspase-3表达明显下降,Bcl-2表达明显升高。结论17β雌二醇通过抑制神经元凋亡对抗氯胺酮诱导的皮质神经元损伤,产生保护作用。
17β雌二醇;氯胺酮;皮质神经元;凋亡
氯胺酮是一种N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)拮抗药。最近的研究表明,在中枢神经系统快速发育期反复应用氯胺酮可影响神经系统的发育,导致神经元凋亡增加,甚至影响成年后的学习记忆能力[1]。目前,大量的研究表明,氯胺酮可导致原代培养的皮质神经元凋亡[2-3]。因此,对于氯胺酮引起的发育期大脑损伤,寻找有效的预防治疗措施已成为麻醉医师关注的重要课题。17β雌二醇为一种神经活性甾体,不仅参与调节神经系统的发育,还影响神经系统的功能,发挥神经保护作用,该药对神经系统的保护作用及机制已成为国内外研究的热点[4]。17β雌二醇对氯胺酮引起的皮质神经元凋亡是否有保护作用以及其可能的机制,笔者未见文献报道。本实验从细胞凋亡的形态学变化及与凋亡相关蛋白cleaved-caspase-3及Bcl-2表达变化等方面研究17β雌二醇对氯胺酮导致原代培养皮质神经元凋亡的影响。
1 材料与方法
1.1 药物及试剂 氯胺酮注射液(福建古田药业有限公司,规格:100 mg/2 mL,批号:H35020148),达尔伯克改良伊格尔培养液(Dulbecco's modification of Eagle'smedium,DMEM,批号:11965-092)、Neurobasal培养液(批号:21103049)、B27促生长剂(批号:17504)购自美国Gibco公司,17β雌二醇(规格:1 mg,批号:E8875)、二甲亚砜(dimethyl sulfoxide, DMSO,批号:D2650)、噻唑蓝(thiazole blue,MTT,批号:M5655)均购自美国Sigma公司。Hoechest33258 (批号:23491-45-4)与胰蛋白酶(批号:T1320)购自北京索来宝公司。cleaved-Caspase-3(批号:9661S)和Bcl-2(批号:6516S)抗体购自美国Cell signal Technology公司。
1.2 皮质神经元原代培养 参照文献[5]方法,略加改进。取新生24 h内的SD幼鼠[清洁级,体质量5~6 g,雌雄不限,河北省实验动物中心提供,生产许可证号:SCXK(冀)2008-1003,合格证号:1306107],在无菌操作下迅速取出大脑,用D-Hanks液清洗后取出大脑皮质,剪成约1 mm×1 mm×1 mm大小组织块,经0. 125%胰蛋白酶37℃消化15 min,用含10%胎牛血清的DMEM培养液终止消化,把细胞转移到含10%胎牛血清的DMEM培养液中制成细胞悬液,经100目钢丝筛(筛孔内径0.149 mm)过滤,计数后按1×106·mL-1密度接种于经多聚赖氨酸处理的培养板,37℃、5%二氧化碳(CO2)培养箱内培养24 h后全量换neurobasal +B27培养液,以后每隔2 d半量换液1次。体外培养7 d的神经元用于实验。
1.3 实验分组 随机分为空白对照组(给予相同体积的DMSO),雌二醇组(17β雌二醇终浓度为0.1 μmol·L-1),氯胺酮组(氯胺酮终浓度为100 μmol·L-1),氯胺酮+雌二醇组(氯胺酮,17β雌二醇终浓度分别为100 μmol·L-1,0.1 μmol·L-1)。
1.4 MTT法检测神经元存活率 将细胞接种于96孔板,体外培养至第7天,分别加入不同的药物处理24 h,翻板法弃去培养液,每孔加入MTT液10 μL, 37℃孵育4 h,弃去上清液,加入DMSO 200 μL,轻轻振荡溶解甲瓒结晶,在多功能酶标仪上测定570 nm波长处的吸光度,以对照组平均吸收值为100%,以各处理组吸收值与对照组的比值计算存活率。存活率(%)=实验组吸光度/对照组吸光度×100%。
1.5 Hoechest33258核染色法检测神经元凋亡 将神经元接种于6孔培养板,按上述方法培养,分组处理后,移去培养液,用4℃磷酸盐缓冲液(phosphate buffer solution,PBS)冲洗1遍,加入4%多聚甲醛固定30 min,弃固定液,用冷PBS液冲洗3遍,加入Hoechest33258染色8 min,PBS液漂洗2遍,荧光显微镜下随机选取5个视野进行形态学观察和计数,计算凋亡率。凋亡率(%)=凋亡细胞数/细胞总数× 100%。
1.6 Western-blot法测定cleaved-Caspase-3和Bcl-2蛋白表达 细胞经处理后,收集细胞,裂解液裂解细胞提取细胞总蛋白,二喹啉甲酸(bicinchoninic acid, BCA)法检测样品蛋白含量。取待测蛋白质50 μg加上样缓冲液煮沸变性,于10%十二烷基硫酸钠-聚丙烯酰胺凝胶中100 V电泳1.5 h,转膜1 h,加入cleaved-Caspase-3和Bcl-2抗体(1∶2 000),4℃过夜,常规洗涤,加羊抗鼠二抗(1∶5 000)37℃孵育60 min,洗涤,电化学法发光、显影、扫描,用凝胶图像处理系统分析目标条带与内参条带吸光度的比值。实验重复3次,设β-actin蛋白为内参。
2 结果
2.1 17β雌二醇处理对氯胺酮诱导的皮质神经元损伤保护作用 空白对照组神经元存活率为[(99.98± 5.76)%],与空白对照组比较,雌二醇组神经元存活率[(99.85±8.43)%]未见明显变化,氯胺酮组神经元存活率[(54.02±7.78)%]明显下降(P<0.01)。与氯胺酮组比较,氯胺酮+雌二醇组神经元存活率[(88.09±6.54)%]明显增加(P<0.01)。图1。
2.2 17β雌二醇处理对氯胺酮诱导皮质神经元凋亡的影响 经Hoechest33258染色荧光在显微镜下观察,空白对照组与雌二醇组细胞核内呈均匀分布的淡蓝色荧光,内有较深的蓝色颗粒,有少量凋亡细胞呈亮蓝色,凋亡率(5.15±0.21)%。氯胺酮组凋亡细胞明显增加(P<0.01),大多细胞呈亮蓝色,部分细胞核呈碎片状,部分染色质边集,凋亡率(49.50±4.34)%。氯胺酮+雌二醇组神经元凋亡数量较氯胺酮组明显减少(P<0.01),凋亡率为(15.74±3.40)%。见图2,图3。
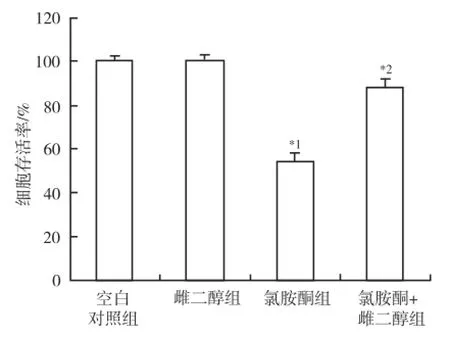
与空白对照组比较,*1P<0.01;与氯胺酮组比较,*2P<0.01图1 不同处理对神经元存活率的影响Compared with blank control group,*1P<0.01;compared with ketamine group,*2P<0.01Fig.1 Effect of different treatments on neuron viability
2.3 17β雌二醇处理对氯胺酮诱导皮质神经元凋亡时cleaved-Caspase-3表达的影响 采用Western-blot法检测,空白对照组神经元cleaved-Caspase-3水平为(0.56±0.02)。雌二醇组为(0.58±0.03),与空白对照组比较未见明显变化。氯胺酮组为(1.24±0.08),较对照组明显增加(P<0.01)。氯胺酮+雌二醇组神经元cleaved-Caspase-3水平为(0.78±0.10),较氯胺酮组明显下降(P<0.01)。见图4,5。
2.4 17β雌二醇处理对氯胺酮诱导皮质神经元凋亡时Bcl-2表达的影响 采用Western-blot法检测,空白对照组神经元Bcl-2水平为(1.12±0.1),雌二醇组为(1.16± 0.2),与空白对照组比较,未见明显变化。氯胺酮组神经元Bcl-2水平为(0.58±0.04),较对照组明显降低(P<0.01)。氯胺酮+雌二醇组神经元Bcl-2水平为(0.84± 0.08),较氯胺酮组明显增加(P<0.01)。见图6,7。
3 讨论
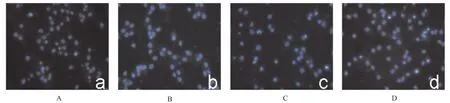
A.空白对照组;B.雌二醇组;C.氯胺酮组;D.氯胺酮+雌二醇组图2 不同处理对神经元凋亡的影响(×100)A.blank control group;B.estradiol group;C.ketamine group;D.ketamine plus estradiol groupFig.2 Effect of different treatments on neuron apoptosis(×100)

与空白对照组比较,*1P<0.01;与氯胺酮组比较,*2P<0.01图3 4组神经元凋亡率测定结果Compared with blank control group,*1P<0.01;compared with ketamine group,*2P<0.01Fig.3 Detection results of neuron apoptosis in four groups of neurons

图4 不同处理对神经元Cleaved-caspase-3表达的影响Fig.4 Effect of different treatments on expression of Cleaved-caspase-3
氯胺酮自1965年用于临床以来,在临床麻醉中一直享有独特的地位,广泛用于儿童麻醉。但是IKONOMIDOU等[6]研究发现,出生14 d内的新生大鼠,使用NMDAR拮抗药MK-801后能引起广泛的神经细胞凋亡变性,成年大鼠却没有出现此现象,这说明在大鼠脑发育高峰期(出生前l d至出生后14 d),使用NMDAR拮抗药会干扰中枢神经系统发育。氯胺酮是NMDAR拮抗药,近年来大量研究证明氯胺酮对发育期大脑和原代培养的皮质神经元产生损伤[1-3]。因此寻找安全有效的预防治疗措施来减少发育期氯胺酮的神经毒性,显得尤为重要。
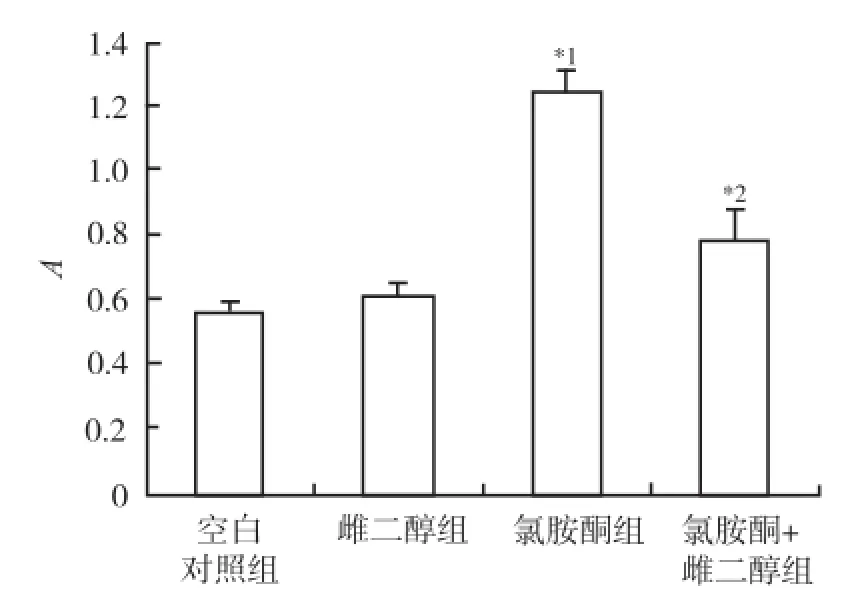
与空白对照组比较,*1P<0.01;与氯胺酮组比较,*2P<0.01图5 4组神经元Cleaved-caspase-3表达测定结果Compared with blank control group,*1P<0.01;compared with ketamine group,*2P<0.01Fig.5 Detection on Cleaved-caspase-3 expression in four groups of neurons
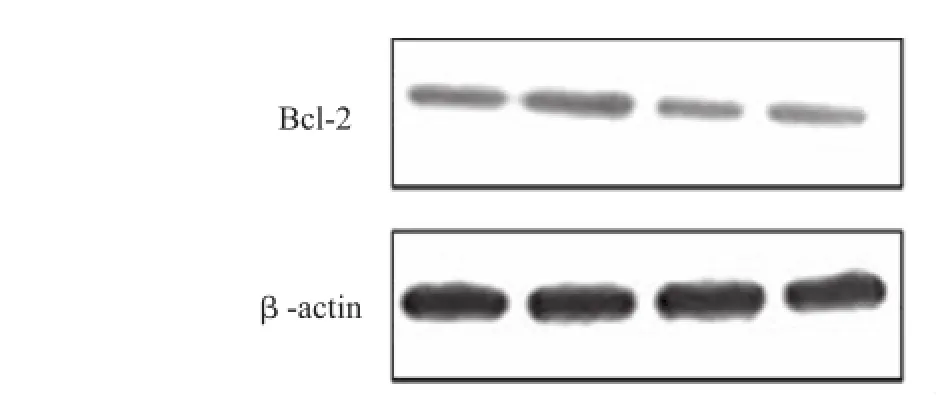
图6 不同处理对神经元Bcl-2表达的影响Fig.6 Effect of different treatments on expression of Bcl-2
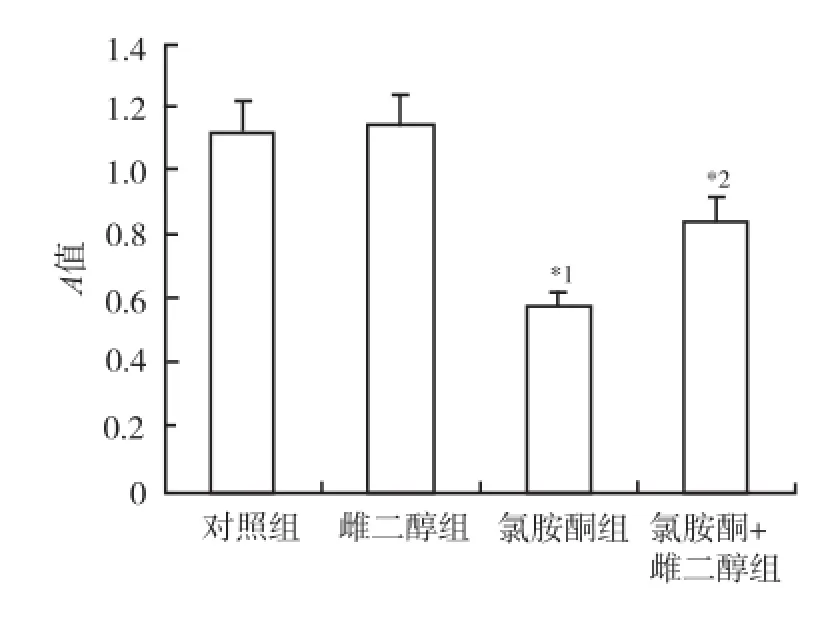
图7 4组神经元Bcl-2表达测定结果Fig.7 Detection on Bcl-2 expression in four groups of neurons
已有研究发现,锂、促红细胞生成素、可乐定等可对氯胺酮引起的神经损伤产生保护作用[7-9],但它们在婴幼儿应用的安全性需要进一步研究。17β雌二醇为一种神经活性甾体,目前大量的研究证实其具有神经保护作用,如对老年痴呆、缺血缺氧性损伤、兴奋性毒性损伤以及氧化应激等损伤产生保护作用[10]。另外有研究报道,17β雌二醇可对NMDA受体拮抗剂MK-801诱导的发育期大脑凋亡样损伤以及由麻醉药异氟醚、氧化亚氮、咪达唑仑联合应用引起的发育期大脑损伤产生保护作用[11-12]。然而17β雌二醇是否对氯胺酮引起的发育期大脑损伤产生保护作用以及机制,国内外未见报道。
目前研究认为凋亡是氯胺酮引起发育期大脑损伤的重要机制[13]。荧光显微镜检测法因结果可靠,易于操作而成为细胞凋亡检测的常用手段,尤其适用于体外培养细胞的检测[14]。Hoechest是一种细胞膜通透性的荧光染料,Hoechest33258是其中一种常见染料。正常细胞和中早期凋亡细胞均可被Hoechest着色。正常细胞核呈圆形,淡蓝色,而凋亡的细胞核呈碎片状,边集的结构特征,由于浓集而使染色增强,荧光更为明亮,呈亮蓝色。本研究采用Hoechest33258染色来观察凋亡的神经元,发现氯胺酮导致凋亡神经元明显增加,而17β雌二醇处理后会使凋亡的神经元明显减少。Caspase-3是各种细胞凋亡通路的最终执行者。Bcl-2作为抗凋亡蛋白,通过抑制线粒体细胞色素C以及Caspase-3的活化而产生抗凋亡作用[15]。本实验首次对17β雌二醇处理保护原代培养的皮质神经元免受氯胺酮引起的损伤进行了研究。结果显示100 μmol·L-1氯胺酮使原代培养的皮质神经元存活率明显下降,同时神经元凋亡明显增加,cleaved-Caspase-3表达明显增加,抗凋亡蛋白Bcl-2表达明显下降,17β雌二醇处理能对抗氯胺酮引起的神经元损伤,使神经元存活率增加,神经元凋亡减少, cleaved-Caspase-3表达明显下降,抗凋亡蛋白Bcl-2表达增加。本研究表明氯胺酮可通过激活神经元凋亡途径导致神经元存活率降低,而神经活性甾体17β雌二醇可通过抗凋亡机制来抑制氯胺酮的神经毒性作用,维持神经元的正常成长。
总之17β雌二醇具有保护神经元免受氯胺酮损伤的作用,其机制是通过抗凋亡作用实现的。本研究为围术期应用17β雌二醇预防麻醉药对婴幼儿大脑产生神经损伤提供了初步的实验依据。
[1] PAULE M G,LI M,ALLEN R R,et al.Ketamine anesthesia during the first week of life can cause long-lasting cognitive deficits in rhesus monkeys[J].Neurotoxicol Teratol,2011, 33(2):220-230.
[2] CAMPBELL L L,TYSON J A,STACKPOLE E E,et al. Assessment of general anaesthetic cytotoxicity inmurine cortical neurones in dissociated culture[J].Toxicology, 2011,283(1):1-7.
[3] LIU F,PATTERSON T A,SADOVOVA N,et al.Ketamineinduced neuronal damage and altered n-methyl-d-aspartate (NMDA)receptor function in rat primary forebrain culture [J].Toxicol Sci,2013,131(2):548-557.
[4] AREVALO M A,RUIZ-PALMERO I,SCERBO M J,et al. Molecularmechanismsinvolvedintheregulationof neuritogenesis by estradiol:recent advances[J].J Steroid Biochem Mol Biol,2012,131(1-2):52-56.
[5] 于洋,薛改,吴红海,等.Aβ25-35对大鼠大脑皮质皮质神经元神经甾体水平的影响[J].中国药理学通报,2010,26 (6):783-786.
[6] IKONOMIDOU C,BOSCH F,MIKSA M,et al.Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain[J].Science,1999,283(5398):70-74.
[7] STRAIKO M M,YOUNG C,CATTANO D,et al.Lithium protectsagainstanesthesia-induceddevelopmental neuroapoptosis[J].Anesthesiology,2009,110(4):862-868.
[8] SHANG Y,WU Y,YAO S,et al.Protective effect of erythropoietinagainstketamine-inducedapoptosisin cultured rat cortical neurons:involvement of PI3K/Akt and GSK-3 beta pathway[J].Apoptosis,2007,12(12):2187-2195.
[9] PONTEN H,VIBERG T,GORDH P,et al.Clonidine abolishes the adverse effects on apoptosis and behaviour after neonatal ketamine exposure in mice[J].Acta Anaesthesiol Scand,2012,56(8):1058-1065.
[10] MELCANG R C,PANZICA G,GARCIA-SEGURAL L M. Neuroactivesteroids:focusonhumanbrain[J]. Neuroscience,2011,191:1-5.
[11] ASIMIADOU S,BITTIGAU P,FELDERHOFF-MUESER U, et al.Protection with estradiol in developmental models of apoptotic neurode generation[J].Ann Neurol,2005,58 (2):266-276.
[12] LU L X,YON J H,CARTER L B,et al.General anesthesia activates bdnf-dependent neuroapoptosis in the developing rat brain[J].Apoptosis,2006,11(9):1603-1615.
[13] WANG C,SADOVOVA N,FU X,et al.The role of theN-methyl-D-aspartate receptor in ketamine-induced apoptosis in rat forebrain culture[J].Neuroscience,2005,132(4): 967-977.
[14] LEKIEWICZN M,JANTAS D,BUDISZEWSKAN B,et al. Excitatoryneurosteroidsattenulatesapoptoticand excitotoxic cell death in primary cortical neurons[J].J Physiol Pharmacol,2008,59(3):457-475.
[15] CORY S,HUANG D C,ADAMS J M.The Bcl-2 family: roles in cell survival and oncogenesis[J].Oncogene,2003, 22(53):8590-8607.
DOI 10.3870/yydb.2014.11.009
Effects of 17β-estradiol on Ketamine-induced Neuroapoptosis
LI Jian-li1,LIANG Wei2,WU Hong-hai3,HOU Yan-ning3
(1.Department of Anesthesiology,Hebei General Hospital,Shijiazhuang 050051,China;2.Department of Pediatric Surgery,Hebei General Hospital,Shijiazhuang 050051,China;3.Department of Pharmacy,Bethune International Peace Hospital of Chinese PLA,Shijiazhuang 050082,China)
ObjectiveTo investigate the protective effect and the mechanisms of 17β-estradiol on ketamine-induced apoptosis on primary cultured rat cortical neurons.MethodsCortical neurons were primarily cultured for seven days,then divided into four groups:control group(treated with equal valume of DMSO),estradiol-treated group(treated with 0.1 μmol·L-117β-estradiol),ketamine-treated group(treated with 100 μmol·L-1ketamine),ketamine plus 17β-estradioltreated group(treated with 0.1 μmol·L-117β-estradiol+100μmol·L-1ketamine).The neurons were treated for 24 hours.The neuron viability was determined by MTT.Neuroapoptosis was measured by nuclear morphometry after Hoechest 33258 dying. Western blotting was performed to detect the expression levels of cleaved-caspase-3 and Bcl-2protein.ResultsThe neuron viability in the ketamine group was(54.02±7.78)%,significantly decreased from the control group,whereas ketamine plus 17βestradiol increased the cell viability to(88.09±6.54)%,significantly higher than the ketamine group.The neuroapoptosis rate in the ketamine group was(49.50±4.34)%,significantly increased from the control group,while that in the drug combination group was(15.74±3.40)%,significantly lower compared with the ketamine group.Meanwhile,the cleaved-caspase-3 expression increased,and Bcl-2 expression decreased remarkably after ketamine treatment,while which was reversed in the drug combination group.Conclusion17β-estradiol can protect against ketamine-induced injury by inhibiting neuron apoptosis.
17β-estradiol;Ketamine;Cortex neurons;Neuroa apoptosis
R971.2;R965
A
1004-0781(2014)11-1434-05
2013-11-12
2014-01-05
李建立(1976-),男,河北赵县人,副主任医师,在读博士,主要从事麻醉药理学研究。E-mail:hblijianli@163. com。
侯艳宁(1957-),女,河北高阳人,教授,博士生导师,博士,主要从事神经药理学研究。电话:0311-87978503, E-mail:biph2011@163.com。
