高效液相色谱-四极杆飞行时间质谱法分析克拉屈滨注射液中主要杂质及其来源
2014-05-15杨丽珍杨伟峰石云峰
杨丽珍,杨伟峰,,石云峰
(1.浙江工业大学化学工程学院,杭州 310014;2.浙江省食品药品检验研究院,杭州 310004)
高效液相色谱-四极杆飞行时间质谱法分析克拉屈滨注射液中主要杂质及其来源
杨丽珍1,杨伟峰1,2,石云峰2
(1.浙江工业大学化学工程学院,杭州 310014;2.浙江省食品药品检验研究院,杭州 310004)
目的 利用高效液相色谱-四极杆飞行时间质谱(HPLC-Q-TOF-MS)法对克拉屈滨注射液的主要杂质进行结构鉴定,并分析其来源。方法色谱柱Grace C18(250mm×4.6mm,5μm),流动相为10 mmol·L-1乙酸铵溶液-甲醇(80∶20),柱温35℃,检测波长为265 nm。以ESI为离子源,在正离子模式下获得克拉屈滨及其主要杂质的质谱图,并推测杂质结构式。分别考察克拉屈滨注射液在pH为4.5,5.0,5.5,6.0,6.5,7.0,7.5,8.0溶液及光强为4 500 lx,5%过氧化氢(H2O2),60℃环境中的稳定性。结果通过比较克拉屈滨和主要杂质的裂解途径及其高分辨质量数,结合合成工艺,推断出该杂质为2-氯腺嘌呤,由降解试验推测该杂质可能是克拉屈滨在pH偏低和有氧条件下降解产生。结论HPLC-Q-TOF-MS可快速鉴定克拉屈滨注射液的主要杂质,通过分析杂质的来源,为药品质量控制和工艺优化提供支持。
克拉屈滨注射液;质谱法,高效液相色谱-四极杆飞行时间;鉴定,杂质;分析,杂质来源
克拉屈滨为耐腺苷脱氨酶的脱氧腺苷类似物,为核苷类抗白血病药,化学名为2-氯-6-氨-9-嘌呤,用于治疗毛细胞白血病和Walden-Strom氏巨球蛋白血病,效果显著,作为2-脱氧核苷类代表性药物已列为一线药[1]。在检验克拉屈滨注射液的实验中发现在相对保留时间为0.63处有一峰面积达0.23%的杂质,人用药物注册技术要求国际协调会(International Conference on Harmonization of Technical Requirements for Registration of Pharmaceuticals for Human Use,ICH)要求任何未知杂质当其限度超过0.1%时,应对该杂质进行结构确定和生物安全性验证[2],而国家食品药品监督管理局标准(试行)YBH33322005中未对其单独进行控制[3]。由于药物的杂质通常与合成工艺和药物主成分的降解途径有关,可以对比杂质和主成分的质谱裂解特征来鉴定杂质的化学结构[4],笔者在本实验利用高效液相色谱-四极杆飞行时间质谱法(high performance liquid chromatography-quadrupole-time of flight-mass spectrometry,HPLC-Q-TOF-MS)的高分辨率和准确质量数对克拉屈滨注射液中的主要杂质进行确认。
1 仪器与试药
1.1 仪器 岛津LC-20AD高效液相色谱仪(配DAD检测器)及Agilent 1290高效液相色谱仪(配VWD紫外检测器)-Agilent6538四极杆飞行时间质谱仪(美国Agilent公司)。
1.2 试药 克拉屈滨注射液由浙江海正药业有限公司提供(批号:120101,规格:10 mL∶10 mg),甲醇为色谱纯,购自Merck公司(批号:1719107349);乙酸铵(分析纯,国药化学试剂集团,批号:120901);水为超纯水,由Milli-Q纯水仪(Milli-pore,USA,SAS67120)制得。
2 方法与结果
2.1 方法
2.1.1 色谱条件 色谱柱为Grace-C18柱(250 mm× 4.6 mm,5μm),流动相为10 mmol·L-1乙酸铵溶液-甲醇(80∶20),流速为1.0 mL·min-1,柱温为35℃,进样方式为自动进样,进样量为10μL,检测波长为265 nm[5]。
2.1.2 质谱条件 电喷雾离子源,正离子检测模式,毛细管电压4 kV,锥孔电压65 V,喷雾气压0.24 MPa,干燥气温度320℃,裂解电压150 V,氮气作为干燥气和雾化气,分别设为10 mL·min-1和262.0 kPa。样品从高效液相色谱仪通过T型三通阀以3∶1的分流比引入质谱离子源内。
2.1.3 溶液配制 精密量取克拉屈滨注射液1.0 mL,置100 m L量瓶,用甲醇-水(10∶90)稀释制成质量浓度为10μg·mL-1溶液,作为色谱分析的供试品溶液。取供试品溶液1.0 mL,置100 mL量瓶,用甲醇-水(10∶90)稀释至刻度,作为有关物质自身对照溶液,直接取克拉屈滨注射液作为质谱分析的供试品溶液,浓度为1 mg·m L-1。
2.1.4 稳定性影响因素考察 取克拉屈滨注射液分别考察光照、氧化、热和pH对产品稳定性的影响,在规定条件下放置后,于第5天和第10天分别取1.0 m L,置25 mL量瓶,用甲醇-水(10∶90)稀释至刻度,按“2.1”项色谱条件进样分析。
2.2 结果
2.2.1 色谱分析 参照国家食品药品监督管理局标准(试行)YBH33322005的HPLC条件对克拉屈滨注射液进行有关物质检测时,发现相对保留时间0.63处有一较大杂质峰,按归一化法计算达0.23%;另取色谱分析用供试品溶液按“2.1”项色谱条件进样,分离效果与国家标准基本一致,见图1。
2.2.2 质谱分析 在ESI(+)不同能量下,克拉屈滨的二级质谱见图2,克拉屈滨杂质的二级质谱图见图3。
图3中杂质的[M+H]+峰m/z为170,为偶数,属于偶电子离子,应含奇数个氮,且离子丰度[M+1]+/ [M+2]+为3∶1,说明杂质中含一个氯原子,克拉屈滨的二级质谱中m/z 308为克拉屈滨的[M+Na]+峰, m/z 170是由[M+H]+中性丢失1分子2'-脱氧核苷产生的碎片离子1,根据质谱裂解规律,并通过高分辨质量数的确证(见表1),推断出杂质为克拉屈滨C-N键断裂后的腺苷结构,为2-氯腺嘌呤,形成和裂解途径见图4。
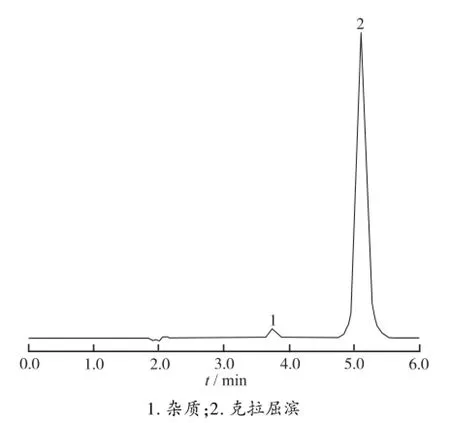
图1 克拉屈滨注射液高效液相色谱图
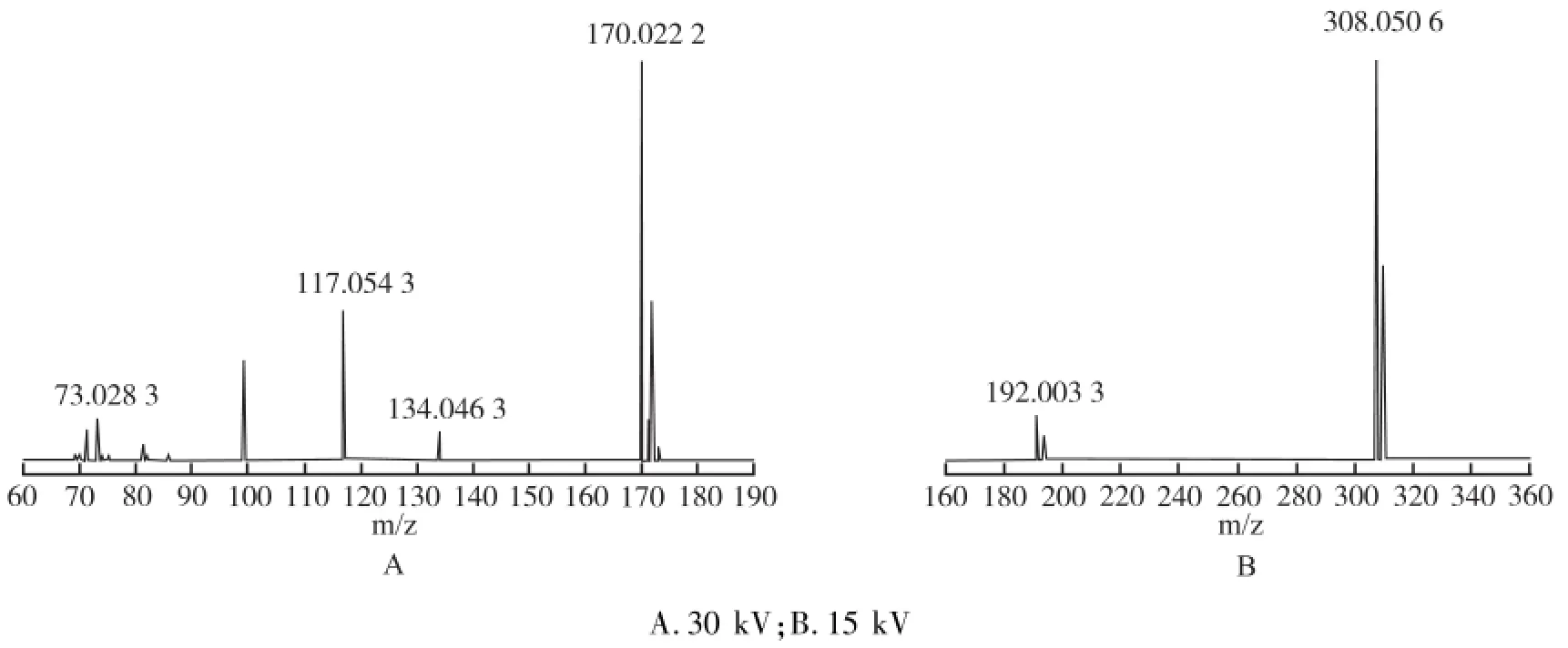
图2 克拉屈滨不同能量下的二级质谱图

图3 克拉屈滨杂质不同能量下的二级质谱图

图4 克拉屈滨杂质的形成和裂解途径
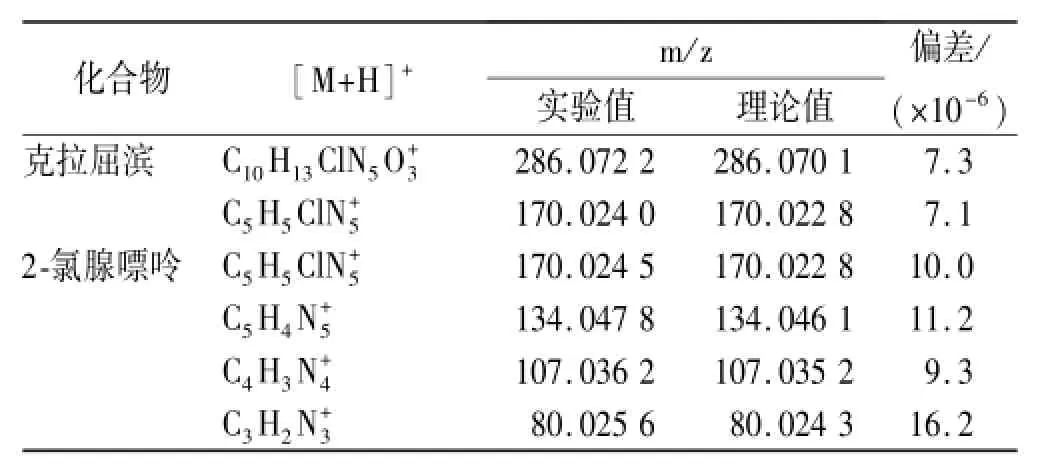
表1 克拉屈滨及其主要杂质的高分辨质谱数据
2.2.3 稳定性分析 克拉屈滨注射液在不同pH, 4 500 lx光强,5%过氧化氢(H2O2)及60℃烘箱中放置5,10 d后的色谱分析结果见表2。由表2得知,克拉屈滨注射液在pH为6.5~8.0环境下最稳定,酸性越强,越不稳定;克拉屈滨易氧化,而受光照和温度的影响较小。
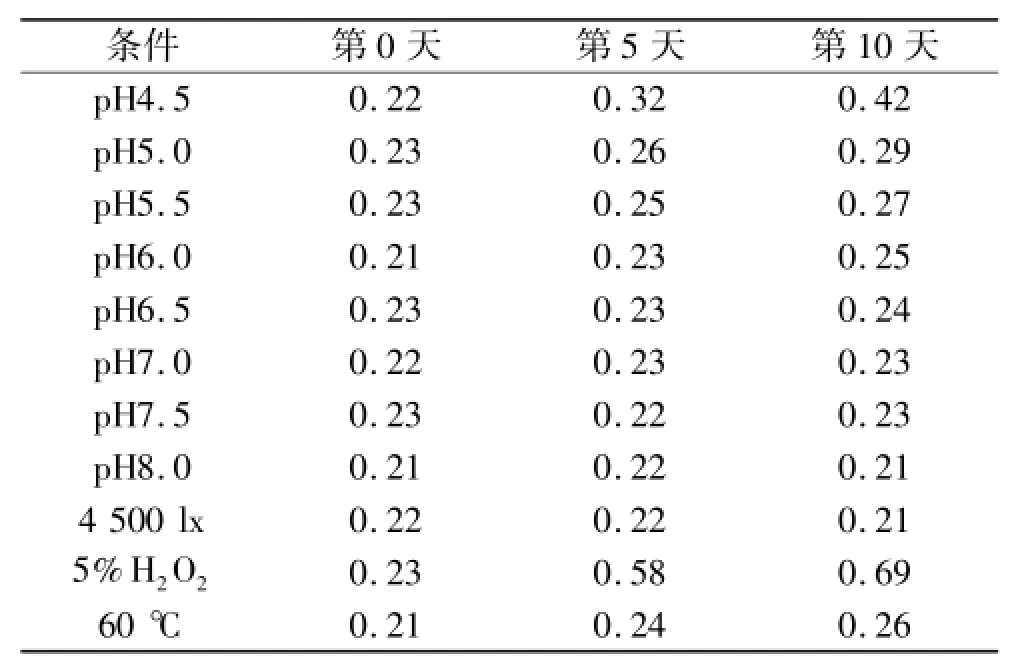
表2 不同环境下杂质按归一化法计算的百分含量
3 讨论
克拉屈滨中杂质2-氯腺嘌呤在《美国药典》[6]和《欧洲药典》[7]均有收载,但考虑到国内外合成工艺可能有所不同及2-氯腺嘌呤对照品难以获得,利用四极杆-飞行时间串联质谱高分辨率和高准确度的特点,能获得待测物质的准确分子量,计算出可能的分子式,根据二级碎片裂解信息,结合合成工艺[8],推测出药物杂质的分子结构,为药物杂质鉴定提供一种快速、灵敏、准确的方法[9-10]。
稳定性实验可知,溶液酸度对克拉屈滨降解的影响较大,而现行标准中克拉屈滨注射液的pH范围为5.5~7.5,建议定为更稳定的pH范围6.5~8.0。在氧化剂高的环境中,克拉屈滨分子中脱氧核苷与腺苷相连的C-N键容易断裂,生成杂质2-氯腺嘌呤,因此克拉屈滨注射液中杂质2-氯腺嘌呤在原料药得到有效控制的情况下,主要是因溶液pH偏低且有氧气存在条件下降解产生,故在生产和储存时应特别注意溶液pH控制和容器密封,必要时充氮,避免克拉屈滨降解。
[1] MICHAEL D M,TRICIA J.Determination of 2-chlorodeoxyadenosine(cladribine,2-CdA)in human plasma by liquid chromatography atmospheric pressure chemical ionization mass spectrometry[J].JPharm Biomed Anal,1998,17:45-51.
[2] 药品注册的国际技术要求[S].北京:人民卫生出版社, 2007:99-126.
[3] 国家食品药品监督管理局标准(试行)[S].2005. YBH33322005.
[4] 胡昌勤.化学药品杂质控制的现状与展望[J].中国科学,2010,40(6):679-687.
[5] 张春燕,朱宝英,赵立波,等.高效液相色谱-串联质谱法测定人血浆中氯法拉滨的浓度[J].中国药学杂志, 2010,45(19):1497.
[6] United States Pharmacopeia-National Formulary(USP36NF-31)[S].2013.
[7] European Pharmacopoeia 7.0[S].2011:1707.
[8] 陈莉莉,岑均达.克拉屈滨的合成[J].中国医药工业杂志,2005,36(7):387-389.
[9] 潘芳芳,朱培曦,黄巧巧,等.液相色谱-四极杆飞行时间质谱法分析头孢拉定中的主要杂质[J].药物分析杂志, 2013,33(1):133-137.
[10] 朱培曦,陈娟娟,李会林,等.液质联用快速确定尼群地平原料药中的杂质[J].药物分析杂志,2012,32(1):88-92.
DOI 10.3870/yydb.2014.06.029
R979.1;R927.2
A
1004-0781(2014)06-0794-03
2013-06-22
2013-07-20
杨丽珍(1990-),女,江西赣州人,硕士,研究方向:药物分析与仪器分析。电话:(0)15868839451,E-mail:15807975068@163.com。
杨伟峰(1965-),男,主任药师,硕士生导师,研究方向:药物分析与仪器分析。电话:(0)13588175658,E-mail:ywfhz@163.com。
