蛋白酶激活受体-2激动药对重症急性胰腺炎大鼠肠道SIgA的影响*
2014-05-15夏亮曾振国刘丕曾皓朱勇吕农华
夏亮,曾振国,刘丕,曾皓,朱勇,吕农华
(南昌大学第一附属医院1.重症医学科;2.消化内科,南昌 330006)
蛋白酶激活受体-2激动药对重症急性胰腺炎大鼠肠道SIgA的影响*
夏亮1,曾振国1,刘丕2,曾皓2,朱勇2,吕农华2
(南昌大学第一附属医院1.重症医学科;2.消化内科,南昌 330006)
目的 研究重症急性胰腺炎(SAP)大鼠肠黏膜免疫屏障的变化及蛋白酶激活受体(PAR)-2激动药对其的影响。方法制备SAP大鼠模型,采用PAR-2激动药进行预处理,检测假手术组、模型组及预处理组造模后6,12,24 h大鼠小肠黏液分泌性免疫球蛋白A(SIgA),小肠组织病理学、小肠组织肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6。组间数据比较采用单因素方差分析,小肠组织TNF-α、IL-6与小肠黏液SIgA,小肠组织病理学评分之间的相关性采用线性相关分析。结果模型组与假手术组相比,随造模时间的延长,小肠黏液SIgA浓度降低,小肠组织病理学评分及小肠组织TNF-α、IL-6水平升高(P<0.05),预处理组与模型组相比,小肠黏液SIgA浓度升高,小肠组织病理学评分及小肠组织TNF-α、IL-6水平降低(P<0.05),小肠组织TNF-α、IL-6水平与小肠组织病理学评分具有明显的正相关(P<0.01),与小肠黏液SIgA之间具有明显的负相关(P<0.01)。结论SAP大鼠早期即发生肠黏膜免疫功能下降,免疫屏障受损; SLIGKV-NH2预处理SAP大鼠后,能显著降低小肠局部主要炎症因子水平,改善肠黏膜免疫屏障损伤程度。
蛋白酶激活受体-2激动药;胰腺炎,急性,重症;肠黏膜屏障;分泌性免疫球蛋白A;肿瘤坏死因子-α;白细胞介素-6
胰腺继发感染是重症急性胰腺炎(severe acute pancreatitis,SAP)最严重的并发症,研究表明SAP早期发生的肠黏膜屏障功能障碍是导致胰腺继发感染的重要因素,其中免疫屏障受损是肠黏膜屏障功能障碍的重要组成部分[1],但其病理生理过程并不十分清楚。蛋白酶激活受体-2(protease-activated receptors 2,PAR-2)是一种细胞膜表面受体,广泛分布于胃肠道,可被多种蛋白酶激活,产生多种生物学效应,本研究前期实验表明PAR-2与SAP大鼠肠黏膜屏障关系密切,在病情进展过程中PAR-2基因和蛋白表达均明显上调[2],因此,PAR-2作为肠黏膜的保护性受体之一,激活后很可能对SAP大鼠起到保护作用。笔者在本研究应用人工合成PAR-2的选择性激动药——SLIGKV-NH2对SAP大鼠进行预处理,通过观察肠黏膜组织主要炎症递质水平的变化、肠黏膜免疫屏障相关指标改变,综合评估SLIGKV对SAP 炎症反应调节和肠黏膜屏障的生物学作用,初步探讨其作用机制。
1 材料与方法
1.1 材料
1.1.1 动物 健康清洁级SD大鼠(合格证号: 0032135)108只,8~12周龄,体质量为200~250 g,雌雄不拘,由南昌大学实验动物中心提供,许可证号: SYXK(赣)2010-0002,实验过程中对动物的处理严格遵循《实验动物管理条例》。
1.1.2 主要试剂 SLIGKV-NH2(批号:C0803070001,纯度:98%)为西安联美生物科技有限公司产品,牛磺胆酸钠为美国Sigma公司产品,大鼠细胞因子试剂盒、SIgA试剂盒为美国R&D公司产品(批号分别为: 213547,217261,21471),水合氯醛为北京Solarbio公司产品。
1.2 实验方法
1.2.1 动物分组 108只大鼠按拆信封法随机分成假手术组、模型组与预处理组,各组再分别按6,12, 24 h三个时间点分成3小组,每组12只,实验前各组大鼠均禁食12 h,自由饮水。
1.2.2 模型制备 ①模型组大鼠采用逆行胰胆管注射5%牛磺胆酸钠溶液0.15 mL·(100 g)-1方法制备SAP模型[2]。术后于大鼠背部皮下注射无菌0.9%氯化钠溶液2 mL·(100 g)-1,以补充失液,术后大鼠仍禁食,清醒后自由饮水。②假手术组开腹后仅翻动胰腺和十二指肠后关腹,术后处理同模型组。③预处理组造模前5 min腹腔注射10%SLIGKV-NH2(2 mg·kg-1),造模后1 h背部皮下注射相同剂量SLIGKV-NH2,余同模型组。
1.2.3 肠黏膜标本的采集和处理 实验结束后,处死所有大鼠,开腹在距离回盲部近端约3 cm处剪取肠段约2 cm,固定于10%中性缓冲甲醛溶液中,用于苏木精-伊红(hematoxylin and eosin,HE)染色;在距离回盲部近端约9 cm处剪取肠段约2 cm,用于制备小肠组织匀浆。在距离回盲部近端约12 cm处剪取肠段约10 cm,用于检测小肠黏液SIgA。①小肠组织匀浆制备:将剪取肠段放入冰0.9%氯化钠溶液中洗净,在4℃条件下,准确称量小肠组织0.5 g,加预冷0.9%氯化钠溶液5 mL制备匀浆,而后4℃离心,取上清液置-80℃冰箱冻存待检。②小肠黏液制备:将剪取肠段纵行剖开,暴露黏膜面,轻轻刮除肠腔内成型大便,称定质量,再用载玻片刮取肠黏液5次,收集于EP管中,加入0.01 mol·L-1磷酸盐缓冲液(phosphate buffered solution,PBS)1 mL,充分溶解, 20 000 r·min-1离心10 min,取上清液,置-80℃冰箱冻存待检。
1.2.4 检测指标
1.2.4.1 肠黏膜组织肿瘤坏死因子α(tumor necrosis factorα,TNF-α)、白细胞介素(interleukin,IL)-6,小肠黏液SIgA 前一晚将待测标本从-80℃冰箱中取出,放入-4℃冰箱,而后再放入4℃冰箱中复温待检;各试剂在使用前平衡至室温,集中采用酶联免疫吸附测定(enzyme-linked immuno-sorbent assay,ELISA)检测小肠组织匀浆中TNF-α、IL-6,小肠黏液SIgA。
1.2.4.2 小肠组织学 常规制作石蜡切片,HE染色,光镜下观察小肠组织病理学改变,参照Chiu评分法对小肠病理损伤程度进行评分[3]。
1.3 统计学方法 应用SPSS17.0版统计学软件进行统计分析。数据以均数±标准差(±s)表示,组间数据比较采用单因素方差分析,小肠组织匀浆TNF-α、IL-6与小肠黏液SIgA、小肠组织学评分之间的相关性采用线性相关分析。P<0.05为差异有统计学意义。
2 结果
2.1 小肠组织匀浆TNF-α的测定 模型组及预处理组造模后,6 h小肠组织匀浆TNF-α浓度升高,并持续升高至24 h,各时点与假手术组比较,均差异有统计学意义(F=992.23,P<0.05);预处理组造模后各时间点小肠组织匀浆TNF-α浓度均低于同时间点模型组,差异有统计学意义(F=808.52,P<0.05);假手术组关腹后,小肠组织匀浆TNF-α浓度无明显变化,各时点相比均差异无统计学意义(P>0.05)。见表1。
2.2 小肠组织匀浆IL-6的改变 模型组及预处理组造模后,6 h小肠组织匀浆IL-6浓度升高,并持续升高至24 h,各时间点与假手术组比较,均差异有统计学意义(F=643.24,P<0.01);预处理组造模后各时间点小肠组织匀浆IL-6浓度均低于同时间点模型组,均差异有统计学意义(F=261.55,P<0.05);假手术组关腹后,小肠组织匀浆IL-6浓度无明显变化,各时间点相比均差异无统计学意义(P>0.05)。见表1。
2.3 小肠黏液SIgA的改变 模型组及预处理组造模后,6 h小肠黏液SIgA浓度降低,并持续至24 h,各时间点与假手术组相比,均差异有统计学意义(F= 314.90,P<0.01);预处理组造模后12及24 h小肠黏液SIgA浓度均高于同时间点模型组,差异有统计学意义(F=131.62,P<0.01);假手术组关腹后,小肠黏液SIgA浓度无明显变化,各时点相比均无统计学意义(P>0.05)。见表1。
2.4 小肠组织病理学的改变
2.4.1 小肠病理学改变 假手术组:各小组小肠组织结构完整,细胞形态正常,间质无明显水肿。模型组:随造模时间延长,逐渐出现小肠黏膜内绒毛顶端上皮下间隙增大,炎症细胞浸润,直至出现绒毛破损、脱落、坏死、弥漫性炎症细胞浸润。预处理组:各时间点仍可见绒毛顶端上皮下间隙增大,间质水肿,炎症细胞浸润,甚至可见少许绒毛破损、脱落,且随模型时间延长而有不同程度加重,但与同时间点模型组比较,损伤程度有所减轻。见图1。
2.4.2 小肠病理学评分改变 模型组及预处理组造模后,6 h小肠病理学评分升高,并持续至24 h,与同时间点假手术组比较,均差异有统计学意义(F= 1 831.62,P<0.01);预处理组造模后12与24 h小肠病理学评分低于同时间点模型组,差异有统计学意义(F=1 347.62,P<0.05);假手术组各时点小肠病理学评分相比,均差异无统计学意义(P>0.05)。见表2。
2.5 小肠组织匀浆TNF-α、IL-6与小肠黏液SIgA、小肠组织学评分之间的相关性 模型组小肠组织匀浆TNF-α、IL-6浓度与小肠黏液SIgA之间具有明显的负相关(TNF-α:r=-0.953,P<0.01;IL-6:r=-0.945,P<0.01);与小肠组织学评分之间具有明显的正相关(TNF-α:r=0.984,P<0.01;IL-6:r=0.975,P<0.01)。预处理组小肠组织匀浆TNF-α、IL-6浓度与小肠黏液SIgA之间具有明显的负相关(TNF-α:r=-0.922,P<0.01;IL-6:r=-0.907,P<0.01);与小肠组织学评分之间具有明显的正相关(TNF-α:r=0.986,P<0.01;IL-6:r=0.960,P<0.01)。
表1 9组大鼠小肠组织匀浆TNF-α,IL-6和黏液SIgA浓度测定值Tab.1 TNF-αand IL-6 level of in testinal tissue homogenate and SIgA content of intestinalmucus on 9 groups of rats±s
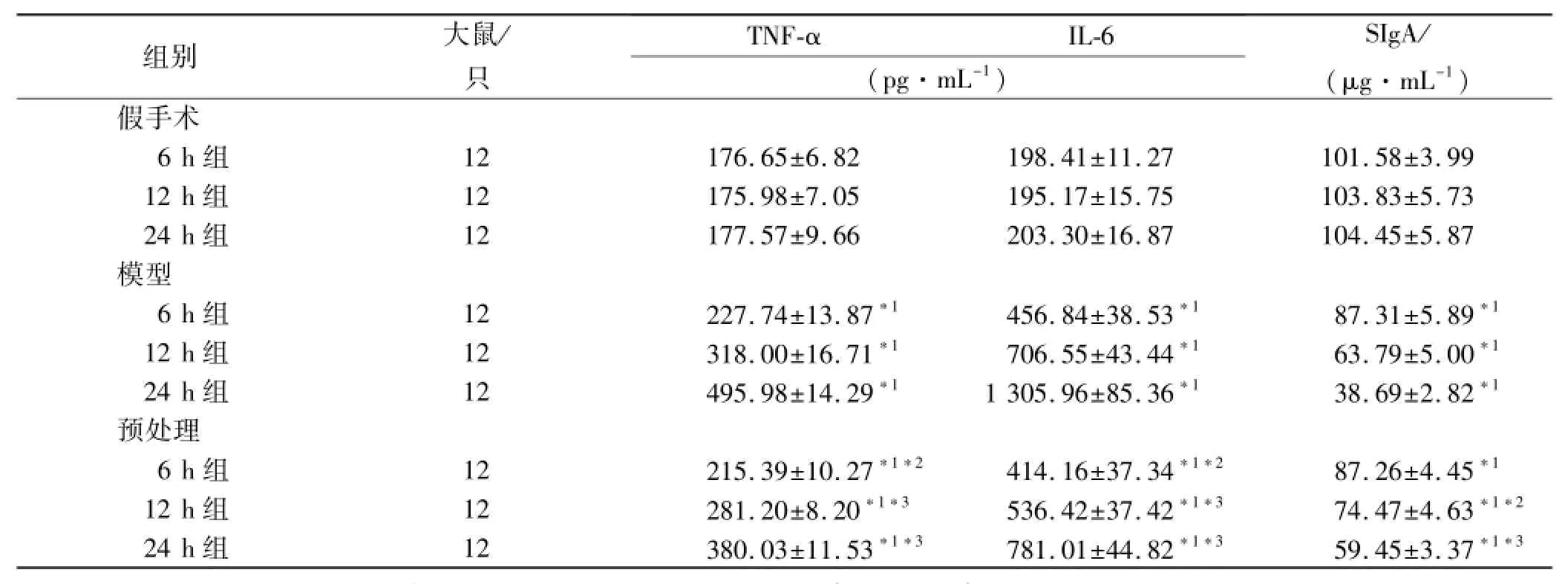
表1 9组大鼠小肠组织匀浆TNF-α,IL-6和黏液SIgA浓度测定值Tab.1 TNF-αand IL-6 level of in testinal tissue homogenate and SIgA content of intestinalmucus on 9 groups of rats±s
与假手术同时间点组比较,*1P<0.01;与模型同时间点组比较,*2P<0.05,*3P<0.01Compared with sham-operated same time point group,*1P<0.01;Compared withmodel same time point group,*2P<0.05,*3P<0.01
组别大鼠/只TNF-αIL-6 (pg·mL-1) SIgA/ (μg·mL-1)假手术6 h组12 176.65±6.82 198.41±11.27 101.58±3.99 12 h组12 175.98±7.05 195.17±15.75 103.83±5.73 24 h组12 177.57±9.66 203.30±16.87 104.45±5.87模型6 h组12 227.74±13.87*1456.84±38.53*187.31±5.89*112 h组12 318.00±16.71*1706.55±43.44*163.79±5.00*124 h组12 495.98±14.29*11 305.96±85.36*138.69±2.82*1预处理6 h组12 215.39±10.27*1*2414.16±37.34*1*287.26±4.45*112 h组12 281.20±8.20*1*3536.42±37.42*1*374.47±4.63*1*224 h组12 380.03±11.53*1*3781.01±44.82*1*359.45±3.37*1*3
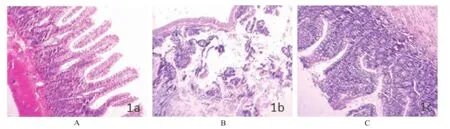
A.假手术24 h组;B.模型24 h组;C.预处理24 h组图1 假手术24 h组、模型24 h组、预处理24 h组小肠组织病理学切片图(HE,×100)A.sham-operated 24 h group;B.model24 h group;C.pretreatment 24 h groupFig.1 Histopathology of intestinalmucosa in three groups of rats after 24 h(HE,×100)
表2 9组大鼠小肠病理学评分比较Tab.2 Com pares of histopathologic score on intestinal mucosa in 9 groups of rats 分,n=12,±s
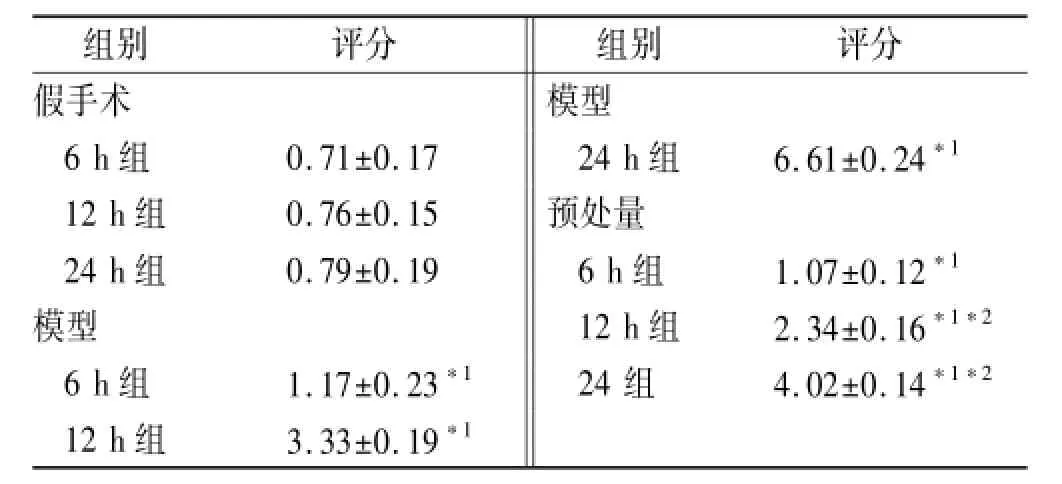
表2 9组大鼠小肠病理学评分比较Tab.2 Com pares of histopathologic score on intestinal mucosa in 9 groups of rats 分,n=12,±s
与假手术组同时间点比较,*1P<0.01;与模型组同时间点比较,*2P<0.01Compared with sham-operated same time point group,*1P<0.01;Compared with model same time point group,*2P<0.01
组别评分组别评分假手术模型6 h组0.71±0.17 24 h组6.61±0.24*112 h组0.76±0.15预处量24 h组0.79±0.19 6 h组1.07±0.12*1模型 12 h组2.34±0.16*1*26 h组1.17±0.23*124组4.02±0.14*1*212 h组3.33±0.19*1
3 讨论
免疫屏障是肠道黏膜屏障的重要组成部分。肠道免疫屏障主要依靠肠黏膜表面黏液及肠腔中的免疫球蛋白(以SIgA为主)和肠黏膜内以淋巴细胞为主的免疫活性细胞,来共同完成肠道的局部免疫防御功能[4-6],肠道SIgA在其中起核心作用。在本实验中,模型组随着造模时间的延长,肠黏液中SIgA分泌较假手术组明显减少,说明肠黏膜免疫功能下降,免疫屏障受损。
SAP实质上是一种严重的全身炎症反应综合征(SIRS),大量的细胞因子释放并相互激活,形成恶性循环,最终导致多脏器功能障碍综合征(multiple organ dysfunction syndrome,MODS)的发生[7-10],成为SAP的主要死因。在众多细胞因子中,TNF-α、IL-6与SAP全身并发症的关系较为直接和肯定[11]。目前国内外文献大多都是通过检测血液中的细胞因子,来反映机体的炎症反应情况。本研究通过检测小肠组织匀浆中的细胞因子来反映局部组织的炎症反应,实验发现模型组大鼠小肠组织匀浆中TNF-α和IL-6水平较假手术组明显升高,且随病情进展有持续增高趋势。在TNF-α、IL-6持续增高的同时,模型组小肠黏液中SIgA浓度随着造模时间的延长呈持续下降趋势,而小肠组织病理损伤评分持续升高。本研究对其进行线性相关分析。结果显示:无论模型组还是预处理组,小肠组织匀浆TNF-α和IL-6水平与小肠黏液中SIgA浓度均呈明显的负相关,而与小肠组织病理损伤评分呈正相关。提示SAP大鼠肠黏膜免疫屏障功能损伤与其产生的肠黏膜局部炎症反应密切相关,SAP时肠黏膜免疫屏障损伤与局部TNF-α和IL-6水平的升高有关。
PAR-2是一种细胞膜表面受体,其具有蛋白酶受体家族特异的分子结构与激活方式,其分布于多种组织细胞中,参与多种病理生理过程,在炎症反应过程中扮演重要角色[12-13]。FIORUCCI等[14]在三硝基苯磺酸诱导的小鼠结肠炎模型中,静脉注射SLIGRL-NH2(一种PAR-2的特异性激活剂)后,发现小鼠结肠炎症减轻,结肠黏膜组织损伤程度减轻,炎症因子如IL-2、TNF-α明显减少,提示PAR-2活化可能引发肠道保护机制。本研究在实验时发现,预处理组在造模后各时点组,小肠组织匀浆TNF-α、IL-6浓度均比模型组显著降低。证明SLIGKV-NH2可有效抑制机体局部组织促炎因子(TNF-α、IL-6)的过度释放。MICHAEL等[15]研究表明在平滑肌、各种组织的内皮细胞、间质细胞和上皮细胞中均有明显的PAR-2免疫反应性;全胃肠道均可见到PAR-2免疫标记,表明PAR-2广泛分布于胃肠道。本研究前期实验表明,在SAP大鼠中,PAR-2随着模型时间延长,其表达逐渐上调,提示PAR-2可能作为小肠黏膜上皮细胞的保护性受体,在小肠黏膜受损后参与黏膜的修复机制。本研究在实验时发现,预处理组在造模后各时组点,与模型组相比,小肠黏液SIgA水平明显升高,小肠黏膜屏障各项指标均有不同程度好转,且呈时间依赖性。证明SLIGKV-NH2对SAP肠黏膜免疫屏障有一定的保护作用。结合笔者之前发现的小肠组织匀浆TNF-α、IL-6水平升高与肠黏膜屏障各项指标的密切关系,因此SLIGKV-NH2可能是通过降低SAP大鼠血清TNF-α、IL-6水平,抑制炎症因子的过度释放而起到对肠黏膜屏障的保护作用。
此外,SLIGKV-NH2预处理后大鼠肠黏膜屏障各项指标虽有所改善,但与假手术组比较,肠黏膜屏障损伤仍有明显加重,提示SLIGKV-NH2只在一定程度改善SAP大鼠肠黏膜屏障损伤程度,但不能完全阻断SAP对肠黏膜屏障的损伤,原因可能是因为肠黏膜屏障损伤机制极为复杂,肠黏膜屏障的损伤和修复还存在其他机制的作用,这些需要进一步的研究。
[1] 周瑞祥.谷氨酰胺强化早期肠内营养治疗重症急性胰腺炎的临床观察[J].医药导报,2013,32(7):885-889.
[2] 夏亮,陈江,刘丕,等.蛋白酶激活受体-2在急性坏死性胰腺炎大鼠肠黏膜组织中的表达[J].中华消化杂志, 2012,32(9):598-601.
[3] LAUKKARINEN JM,VAN ACKERG J,WEISSE R,et al. A mouse model of acute biliary pancreatitis induced by retrograde pancreatic duct infusion of Na-taurocholate[J]. Gut,2007,56:1590-1598.
[4] BROWN E M,SADARANGANIM,FINLAY B B.The role of the immune system in governing host-microbe interactions in the intestine[J].Nat Immunol,2013,14(7):660-667.
[5] ZAMOLODCHIKOVA T S.Serine proteases in immune protection of the small intestine[J].Biochem istry(Mosc), 2013,78(3):213-220.
[6] RAKHSHANDEH A,DEKKERS J C,KERR B J,et al. Effect of immune system stimulation and divergentselection for residual feed intake on digestive capacity of the small intestine in growing pigs[J].J Anim Sci,2012,90(Suppl 4):233-235.
[7] 符敏.大剂量山莨菪碱治疗急性胰腺炎54例[J].医药导报,2012,31(11):1432-1433.
[8] 林方德.奥曲肽联合谷氨酰胺治疗重症急性胰腺炎90例[J].医药导报,2013,32(7):892-893.
[9] LIMA P R,DE MELO T S,CARVALHO K M,et al.1,8-cineole(eucalyptol)ameliorates cerulein-induced acute pancreatitis viamodulation of cytokines,oxidative stress and NF-κB activity in mice[J].Life Sci,2013,92(24-26): 1195-1201.
[10] PUPELISG,PLAUDISH,ZEIZA K,et al.Early continuous veno-venous haem of iltration in the management of severe acute pancreatitis complicated with intra-abdominal hypertension:retrospective review of 10 years'experience [J].Ann Intensive Care,2012,2(Suppl 1):S1.
[11] ZHANG H,NEUHOFER P,SONG L,et al.IL-6 transsignaling promotes pancreatitis-associated lung injury and lethality[J].J Clin Invest,2013,123(3):1019-1031.
[12] RAMACHANDRAN R,MORICE A H,COMPTON S J. Proteinase-activated receptor-2 agonists upregulate granulocyte colony-stimulating factor,IL-8,and VCAM-1 expression in human bronchial fibroblasts[J].Am J Respir Cell Mol Biol,2006,35(1):133-141.
[13] YOSHIDA N,TAKAGI T,ISOZAKI Y,et al.Proinflammatory role of protease-activated receptor-2 in intestinal ischemia/reperfusion injury in rats[J].Mol Med Rep, 2011,4(1):81-86.
[14] FIORUCCI S,MENCARELLI A,PALAZZETTI B,et al. Proteinase-activated receptor 2 is an anti-inflammatory signal for colonic lamina propria lymphocytes in a mouse model of colitis[J].Proc Natl A Sci,2001,98(4):13936-13941.
[15] MICHAEL R,ANDREA D,CLAUDIA K,et al.Characterization of protease-activated receptor-2 immunoreactivity in normal human tissue[J].J Histochemcytochem,1998,46 (2):157-164.
DOI 10.3870/yydb.2014.06.004
Effect of Protease Activated Receptor-2 Agonist on Intestinal SIgA in Rats with Acute Necrotizing Pancreatitis
XIA Liang1,ZENG Zhen-guo1,LIU Pi2,ZENG Hao2,ZHU Yong2,LV Nong-hua2
(1.Department of Critical Care Medicine;2.Department of Gastroenterology,the First Affiliated Hospital of Nanchang University,Nanchang 330006,China)
ObjectiveTo discuss the effects of proteinase-activated receptor-2(PAR-2)agonists on intestinal SIgA levels in rats with severe acute necrotizing pancreatitis(SAP).MethodsThis study established SAP ratmodel and observed the levels of TNF-αand IL-6 in intestinal mucosa,SIgA content in intestinalmucus and histopathological changes of intestinal mucosa 6,12,and 24 h after establishment of model.The univariate analysis was used to compare the difference among groups. Linear correlation analysis was used to compare correlation between inflammatory mediators(TNF-α,IL-6)and SIgA content in intestinalmucus,as well as the histopathological scores of intestinal mucosa.ResultsThe level of TNF-αand IL-6 in intestinalmucosa and histopathological scores of intestinalmucosawere all significantly increased but SIgA contentwas decreased inmodel group at each time point after establishment of model,as compared with the sham-operated group(P<0.05).The level of TNF-αand IL-6 in intestinalmucosa and histopathological scores of intestinalmucosa were all significantly decreased while SIgA content in intestinalmucus increased in pretreatmentgroup ateach time pointafter establishment of model,as compared with themodel group(P<0.05).There was a positive relationship between inflammatory mediators(TNF-α,IL-6)in intestinal mucosa and histopathological scores of intestinal mucosa(P<0.01).There was a negative relationship between inflammatory mediators(TNF-α,IL-6)and SIgA content in intestinal mucus(P<0.05).ConclusionIntestinal mucosa immune barrier was impaired in the early stage of SAP in rats.PAR-2 agonist has therapeutic effects on intestinalmucosa immune barrier,which is related to the inhibition of excessive release of inflammatory mediators(TNF-αand IL-6)in rats with SAP.
Proteinase-activated receptor-2 agonists;Pancreatitis,acute,severe;Intestinal mucosa barrier;Secretory immunglobulin A(SIgA);Tumor necrosis factor alpha;Interleukin-6
R576;R965
A
1004-0781(2014)06-0707-06
2013-08-19
2013-10-20
*江西省青年科学基金项目(20114BAB215050);黎介寿院士肠道屏障研究专项基金(2012年度)
夏亮(1979-),男,江西南昌人,主治医师,博士,研究方向:急性胰腺炎的基础与临床。电话:0791-88692541,E-mail:liangx96180@126.com。
吕农华(1954-),女,江西南昌人,教授,博士生导师,主要从事消化疾病研究。电话:0791-88692541,E-mail:lunonghua@163.com。
