慢病毒靶向干扰Cx26抑制人高转移性肝癌HCCLM 3细胞增殖及迁移
2014-05-15覃贵慧陈军泽
阳 洁,覃贵慧,陈军泽
(广西医科大学1.药学院药理学教研室、2.第一临床医学院,广西 南宁 530021)
缝隙连接蛋白(connexin,Cx)组成的缝隙连接(gap junction,GJ)是一种直接沟通相邻细胞胞质的蛋白质通道,介导细胞间电、化学信号及代谢物质的传递,称为细胞间通讯(gap junctional intercellular communication,GJIC)。目前已知,Cx表达及GJ功能异常与许多疾病,尤其肿瘤的发生、发展密切相关。正常肝脏组织主要表达Cx26、Cx32且能形成有效的GJIC[1]。但近年来国内外研究发现,在肝细胞癌(简称肝癌),Cx32主要异位表达在肝癌细胞胞质、不形成有效的 GJIC,但能促进肝癌进展[2],而Cx26表达减少或缺失并伴GJIC消失。此外,Yano等[3]还发现,肝癌 HepG2细胞恶性表型的减少与Cx26有关,而非Cx32。因此,为证实Cx26与肝癌恶性表型的相关性,本研究拟用慢病毒靶向干扰Cx26表达后,观察人高转移性肝癌HCCLM3细胞体外生物学特性的改变,以进一步阐明Cx26在肝癌发生、发展中的作用。
1 材料与方法
1.1 材料人高转移性肝癌HCCLM3细胞购自美国ATCC,本实验室保存;DMEM高糖培养基、胎牛血清、胰酶购自美国Gibco公司;青霉素、链霉素、MTT购自美国Sigma公司;hU6-MCS-Ubiquitin-EGFP-IRES-puromycin Cx26干扰慢病毒载体购自上海Genechem公司;TRIzol购自美国 Invitrogen公司;PrimeScript RT reagent Kit、SYBR Premix Ex Taq购自中国大连TaKaRa公司;兔抗人Cx26多克隆抗体、兔抗人β-actin、HRP标记的羊抗兔二抗均购自英国Abcam公司;transwell小室购自美国Corning公司;Matrigel购自美国BD公司。
1.2 方法
1.2.1 人高转移性肝癌HCCLM3细胞培养、慢病毒感染及稳定克隆筛选 人高转移性肝癌HCCLM3细胞用含10%(V/V)胎牛血清、100 kU·L-1青霉素及100 mg·L-1链霉素的 DMEM高糖培养基于37℃、5%CO2培养箱中常规培养、传代。含人Cx26(GJB2,GENE_ID 2706,GenBank NM_004004)的干扰慢病毒载体hU6-MCS-Ubiquitin-EGFP-IRES-puromycin(LV-Cx26)由上海Genechem公司构建、包装并进行测序证实。用1×107慢病毒转导单位的LV-Cx26和空载体LV-NC的病毒上清液分别感染3×103个HCCLM3细胞。感染96 h后,用嘌呤霉素(1 mg·L-1)筛选稳定干扰Cx26表达的靶细胞,Real-time PCR和 Western blot鉴定 Cx26的 mRNA和蛋白表达情况。实验分为野生组(未感染的HCCLM3细胞)、阴性对照LV-NC组(感染GFP空载体的HCCLM3细胞)和LV-Cx26组(感染Cx26干扰慢病毒载体的HCCLM3细胞)。
1.2.2 Real-time PCR检测慢病毒感染后HCCLM3细胞的Cx26 mRNA表达情况 用TRIzol和Prime-Script RT reagent Kit从HCCLM3细胞提取总RNA并反转录成cDNA,用SYBR PrimeScript RT-PCR Kit检测Cx26的mRNA表达水平,具体步骤按照相应试剂说明书进行。扩增Cx26的上游引物:5′-CTGTGTTGTGTGCATTCGTCTTT-3′,下游引物:5′-CAGCG TGCCCCAATCC-3′。内参 GAPDH的上游引物:5′-GTCGGAGTCAACGGATTTGG-3′,下 游 引 物: 5′-AAAAGCAGCCCTGGTGACC-3′。反应条件为:94℃2 min;94℃ 30s,55℃ 30 s,72℃ 60 s,30个循环;72℃10 min。用 ΔσCt法计算各组 Cx26的 mRNA相对表达量。
1.2.3 Western blot检测慢病毒感染后HCCLM3细胞的Cx26蛋白表达情况 收集各组细胞,加入1 ml预冷的RIPA裂解液(含 PMSF)冰上裂解5 min,4℃、12 000×g离心5 min,取蛋白上清用BCA试剂盒测定浓度。将蛋白样品30μg经12%SDSPAGE分离后转移到NC膜上,经5%脱脂牛奶封闭1 h后,分别加入一抗(兔抗人Cx26多克隆抗体1∶500稀释,4℃过夜;兔抗人β-actin 1∶10 000稀释,室温孵育1 h),TBST洗涤后,分别加入HRP标记的羊抗兔二抗(1∶500稀释,1∶10 000稀释),TBST洗涤后,用ECL试剂盒暗室发光、显影、定影,Bio Rad凝胶成像系统采集图像,并以β-actin为内参对Cx26条带进行灰度分析。
1.2.4 “parachute”荧光示踪法检测干扰Cx26对肝癌HCCLM3细胞GJ功能的影响 根据我们实验室之前报道的方法[4],将各组细胞分别与荧光指示剂calcine-AM共同孵育,使calcine-AM进入细胞,该细胞称为“供体细胞”(donor cells)。再将donor cells接种到已生长融合的相应组HCCLM3细胞(接受细胞,receiver cells)上,培养4 h。待形成稳定的GJ后,小分子的calcine(发绿色荧光)就能通过GJ进入相邻的receiver cells。用荧光显微镜观察、计数一个donor cell周围含有calcine的receiver cell数目,作为GJ功能的指标。
1.2.5 MTT法检测干扰Cx26对肝癌HCCLM3细胞增殖的影响 将各组细胞以3×107·L-1接种于96孔板,每孔100μl,每组设3个复孔,细胞培养0、24、48、72、96 h后,每孔加入5×103mg·L-1的噻唑蓝10μl,4 h后吸弃培养液,每孔加入150μl DMSO,置摇床振荡10 min后,用酶标仪在波长570 nm处检测各孔吸光值(OD),以培养时间为横坐标,OD570nm为纵坐标绘制细胞生长曲线。
1.2.6 流式细胞术检测干扰Cx26对肝癌HCCLM3细胞凋亡的影响 消化离心收集各组细胞,PBS清洗后,以1×109·L-1密度重悬于195μl结合缓冲液中,并加入5μl Annexin V-FITC,室温避光反应10 min,离心,弃上清,190μl结合缓冲液重悬细胞,加入10μl碘化丙啶(PI)染色液,轻轻混匀,4℃避光染色15 min,1 h内上流式细胞仪检测细胞凋亡情况。
1.2.7 Transwell迁移实验检测干扰Cx26对肝癌HCCLM3细胞迁移的影响 根据我们以前报道的方法[5],不在transwell小室的聚碳酸酯滤膜(孔径8 μm)上铺 Matrigel基质胶,直接将100μl无血清DMEM重悬的各组细胞以5×108·L-1分别接种到transwell上室,并在下室加入600μl含10%胎牛血清的DMEM,37℃培养24 h后,取出小室,用棉签擦净滤膜上未转移的细胞,用4%多聚甲醛固定30 min、0.2%的结晶紫染色30 min,洗净风干,在倒置显微镜下观察(200×),取8个视野拍照、计数,取均数。每组设3个复孔。相对迁移率/%=处理组迁移细胞数/对照组迁移细胞数×100%。
1.2.8 统计学方法 所有数据以±s表示,采用SPSS 20.0统计软件进行统计学处理,多组间比较采用单因素方差分析,多组间两两比较采用LSD检验。
2 结果
2.1 慢病毒介导的Cx26稳定干扰表达Real-time PCR和Western blot结果显示,LV-Cx26组的Cx26 mRNA和蛋白表达均明显低于LV-NC组和野生组(P<0.01),而LV-NC组和野生组两者间差异无显著性(P>0.05)(Fig 1A,1B)。这些结果表明,本研究采用的慢病毒载体能高效、稳定地干扰HCCLM3细胞的Cx26表达。
2.2 干扰Cx26表达对肝癌HCCLM 3细胞GJ功能的影响Parachute结果显示,与LV-NC组和野生组比较,LV-Cx26组的GJ荧光传递功能明显减弱(P<0.01),这表明,干扰 Cx26能明显抑制肝癌HCCLM3细胞的GJ功能,减少有效的GJIC(Fig 2)。
2.3 干扰Cx26表达对肝癌HCCLM 3细胞增殖的影响MTT结果显示,从48 h起,LV-Cx26组的HCCLM3细胞增殖明显慢于LV-NC组和野生组(P<0.01),而 LV-NC组和野生组在培养0、24、48、72、96 h细胞增殖差异无显著性(P>0.05)(Fig 3)。表明干扰Cx26能明显抑制HCCLM3细胞增殖。

Fig 1 Detection of Cx26 interference efficiency(±s,n=5)
2.4 干扰Cx26表达对肝癌HCCLM 3细胞凋亡的影响流式细胞术结果显示,LV-Cx26组的细胞凋亡率比LV-NC组和野生组明显增加(P<0.01),LV-NC组和野生组两者间差异无显著性(P>0.05)(Fig 4)。这表明,干扰Cx26可促进HCCLM3细胞凋亡。
2.5 干扰Cx26表达对肝癌HCCLM 3细胞迁移的影响Transwell迁移实验结果显示,与LV-NC组和野生组比较,LV-Cx26组迁移到下室的细胞数明显下降(P<0.01)(Fig 5)。这表明,干扰Cx26可减少HCCLM3细胞的迁移。
3 讨论
肝癌是临床恶性程度很高、预后极差的常见肿瘤之一。尽管近年来,随着手术切除、肝移植、经皮治疗等治疗手段的提高,肝癌总体存活率有所上升,但预后仍不乐观。因此,探索肝癌发生发展的机制、寻找有效的药物治疗靶点成为肝癌基础与临床研究的热点之一。

Fig 2 Effect of Cx26 interference on dye spread through GJ com posed of Cx26 in HCCLM 3 cells(±s,n=5)(400×)
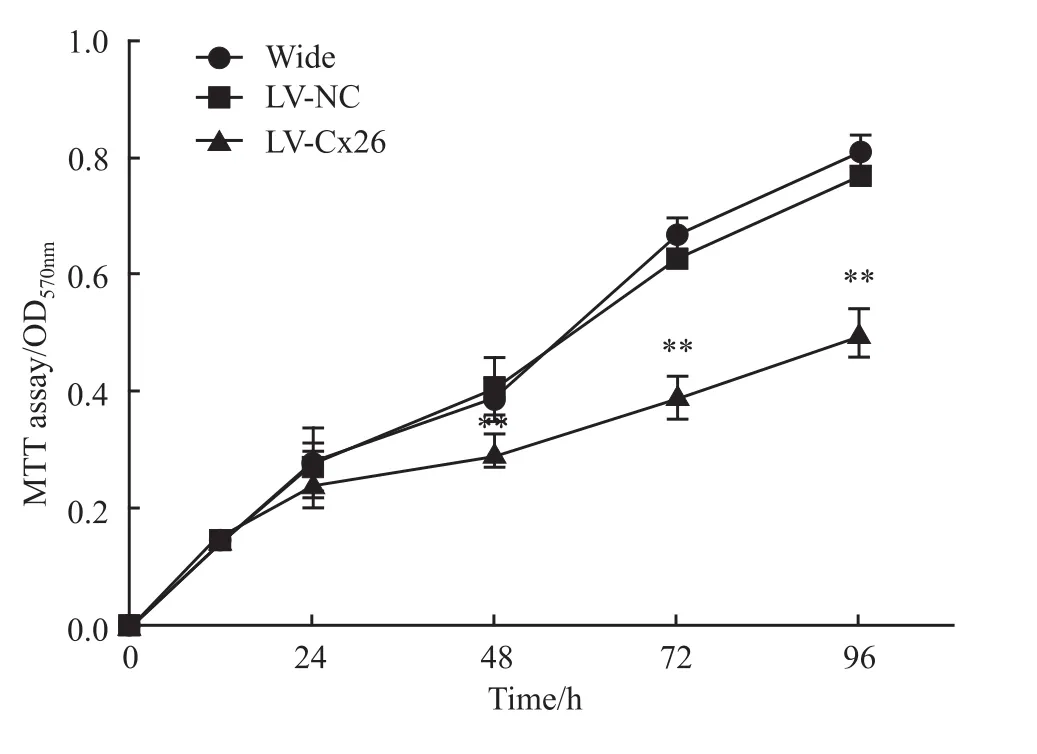
Fig 3 Effect of Cx26 interference on proliferation of HCCLM 3 cells(±s,n=5)
目前已知,Cx及其组成的GJ在维持细胞内环境稳定、同步细胞活动、调控细胞增殖与凋亡、控制细胞生长发育等过程中发挥十分重要的作用[6]。以往国内外的大量研究发现,大多数肿瘤发生发展过程中,常伴随着Cx表达及GJ功能的降低或缺失,恢复肿瘤细胞的Cx表达及GJ功能可抑制肿瘤细胞的生长、促进肿瘤细胞凋亡[7]。马向东等[8]报道,Cx32、Cx43在肝癌细胞 HHCC、SMMC-7721中表达降低并伴随GJ功能的减弱。朱倩等[9]也报道,在人肝癌细胞株MHCC-97H中,过表达Cx32能恢复GJ功能并减弱其侵袭能力。Yano等[10]还发现,Cx26表达可抑制肝癌HepG2细胞的恶性进展,并与其抑制基质金属蛋白酶9的活性有关。因此,长期以来,Cx及其组成的GJ被公认为抑瘤因素[11]。
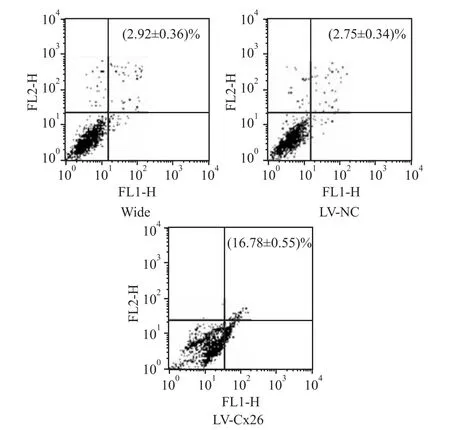
Fig 4 Effect of Cx26 interference on apoptosis of HCCLM 3 cells(±s,n=5)

Fig 5 Effect of Cx26 interference on m igration of HCCLM 3 cells(±s,n=5)(400×)
但近年来的研究发现,Cx及其组成的GJ在各种肿瘤中的作用远比之前的认识更为复杂。例如Cx26,与以往报道的作为肿瘤抑制因子不同,最近的一些研究证实,CX26可作为肿瘤促进因子,参与恶性肿瘤的进展并与患者的不良预后有关。如Kanczuga等[12]报道,Cx26高表达在人乳腺癌细胞胞质及其转移细胞胞膜上,促进乳腺癌的淋巴结转移;Kyo等[13]发现,胃癌、食管癌、胰腺癌、结肠癌等多种胃肠肿瘤显示丰富的Cx26表达,提示Cx26与胃肠道恶性肿瘤的恶性进展密切相关;Ito和Inose等[14-15]分别证实,Cx26表达在肺鳞癌、食管鳞癌的侵袭和转移灶比原发灶明显增高,有助于肿瘤获得恶性表型,是明显的不良预后预测因子。与这些报道相似,在本研究中,我们发现,Cx26在恶性程度很高的人高转移性肝癌HCCLM3细胞中明显高表达,用慢病毒载体靶向干扰Cx26后,HCCLM3细胞的Cx26 mRNA和蛋白表达水平被明显下调并伴有GJ功能的明显减弱。我们进一步观察了这种慢病毒介导的靶向干扰Cx26对HCCLM3细胞恶性生物学行为的影响。结果显示,下调Cx26表达能明显抑制HCCLM3细胞的增殖、促进凋亡,并且还能降低其体外迁移能力。这些结果提示,在高转移性的肝癌细胞,Cx26表达及GJ功能可能与其恶性程度呈正相关,下调Cx26表达及GJ功能有助于减少高转移性肝癌的恶性生物学行为。
目前已知,肿瘤是一种复杂且不断发展的疾病,因此Cx及其组成的GJ在肿瘤不同发展阶段的作用可能有所不同。在肿瘤早期阶段,减少或缺失的Cx及GJ可能是重要的抑瘤因子、抑制肿瘤发生及增殖;而在肿瘤晚期阶段,出现或恢复的Cx及GJ则可能作为促瘤因子、促进肿瘤侵袭及转移[16]。本研究是在高转移性的人肝癌HCCLM3细胞上观察Cx26与肝癌恶性生物学行为的相关性,而转移是肝癌晚期阶段的主要特性,因此我们认为,Cx26及其组成的GJ可能是促进肝癌晚期恶性进展的一个重要因素。
综上所述,我们初步证实了一种与以往报道不同的Cx26在肝癌中的作用,即Cx26表达及GJ功能与高转移性肝癌细胞的恶性表型呈正相关,用慢病毒靶向干扰Cx26能减弱其表达和GJ功能,并逆转肝癌的部分恶性生物学特性。但Cx26能否真正成为晚期肝癌的药物干预靶点及独立的预后指标还需要进一步的研究证实。
参考文献:
[1]Vinken M,Henkens T,De Rop E,et al.Biology and pathobiology of gap junctional channels in hepatocytes[J].Hepatology,2008,47(3):1077-88.
[2]Li Q,Omori Y,Nishikawa Y,et al.Cytoplasmic accumulation of connexin 32 protein enhancesmotility and metastatic ability of human hepatoma cellsin vitroandin vivo[J].Int JCancer,2007,121(3):536-46.
[3]Yano T,Hernandez-Blazquez F J,OmoriY,YamasakiH.Reduc-tion ofmalignant phenotype of HEPG2 cell is associated with the expression of connexin 26 butnot connexin 32[J].Carcinogenesis,2001,22(10):1593-600.
[4]郑素平,洪晓婷,王 琴,等.以siRNA表达载体稳定抑制缝隙连接蛋白43表达的睾丸间质细胞和睾丸支持细胞系的建立[J].中国药理学通报,2010,26(10):1285-9.
[4]Zheng S P,Hong X T,Wang Q,et al.Establishment of Cx43-stably-downregulated leyding cell line and sertoli cell line by siRNA expression vector[J].Clin Pharmacol Bull,2010,26(10):1285-9.
[5]Yang J,Liu B,Wang Q,et al.Connexin 32 and its derived homotypic gap junctional intercellular communication inhibit themigration and invasion of transfected HeLa cells via enhancement of intercellular adhesion[J].Mol Med Rep,2011,4(5):971-9.
[6]Elias L A,Wang D D,Kriegstein A R.Gap junction adhesion is necessary for radialmigration in the neocortex[J].Nature,2007,448(7156):901-7.
[7]Mesnil M,Crespin S,Avanzo J L,Zaidan-Dagli M L.Defective gap junctional intercellular communication in the carcinogenic process[J].Biochim Biophys Acta,2005,1719(1-2):125-45.
[8]马向东,马 兴,隋延仿,王文亮.肝癌细胞中connexin 32、connexin 43的表达及其与间隙连接通讯功能的相关性[J].临床与实验病理学杂志,2002,18(2):189-92.
[8]Ma X D,Ma X,Sui Y F,WangW L.Expressions of connexin 32 and connexin 43 in human hepatocellular carcinoma cell lines and their effects on gap junctional intercellular communication[J].J Clin Exp Pathol,2002,18(2):189-92.
[9]朱 倩,夏雨佳,涂 炜,等.过表达连接蛋白32对人肝癌细胞株MHCC-97H体外侵袭能力的影响[J].华中科技大学学报(医学版),2010,39(4):439-41
[9]Zhu Q,Xia Y J,Tu W,et al.Effect of connexin 32 overexpression on invasion of human hepatocellular carcinoma cell line MHCC-97Hin vitro[J].Acta Med Univ Sci Technol Huazhong,2010,39(4):439-41
[10]Yano T,Yamasaki H.Regulation of cellular invasion and matrix metalloproteinase activity in HepG2 cell by connexin 26 transfection[J].Mol Carcinog,2001,31(2):101-9.
[11]Naus C C,Laird D W.Implications and challenges of connexin connections to cancer[J].Nat Rev Cancer,2010,10(6):435-41.
[12]Kanczuga-Koda L,Sulkowski S,Lenczewski A,et al.Increased expression of connexins 26 and 43 in lymph node metastases of breast cancer[J].JClin Pathol,2006,59(4):429-33.
[13]Kyo N,Yamamoto H,Takeda Y,etal.Overexpression of connexin 26 in carcinoma of the pancreas[J].Oncol Rep,2008,19(3):627-31.
[14]Ito A,Koma Y,Uchino K,et al.Increased expression of connexin 26 in the invasive component of lung squamous cell carcinoma:significant correlation with poor prognosis[J].Cancer Lett,2006,234(2):239-48.
[15]Inose T,Kato H,Kimura H,et al.Correlation between connexin 26 expression and poor prognosis of esophageal squamous cell carcinoma[J].Ann Surg Oncol,2009,16(6):1704-10.
[16]Cronier L,Crespin S,Strale PO,et al.Gap junctions and cancer:new functions for an old story[J].Antioxid Redox Signal,2009,11(2):323-38.
