淫羊藿、黄芪、葛根有效组分复方对阿尔采末病转基因动物模型的学习记忆能力及病理学影响
2014-05-15董贤慧高维娟孔卫娜邵铁梅于文国柴锡庆
董贤慧,高维娟,孔卫娜,张 瑜,邵铁梅,于文国,柴锡庆,
(1.河北医科大学第一附属医院神经内科,河北 石家庄 050000;2.河北化工医药职业技术学院,河北石家庄 050000;3.河北中医学院,河北 石家庄 050200;4.承德医学院,河北 承德 067000)
阿尔采末病(Alzheimer’s disease,AD)是一种与年龄相关的以进行性记忆和认知功能障碍为特征的神经变性疾病。特征性病理变化表现为胆碱能神经元功能障碍、神经元和突触丢失、细胞外β-淀粉样肽(amyloid beta,Aβ)聚集形成老年斑(sennepfaques,SPs)[1]和细胞内高度磷酸化的 tau蛋白形成神经原纤维缠结(neurofibrillary tangles,NFTs)。
中药淫羊藿、黄芪、葛根提取的有效组分具有调节脏腑功能,对AD有一定的治疗作用。本实验以APPswe/PS1ΔE9双转基小鼠为动物模型,采用 Morris水迷宫、改良Bielschowsky银染法以及尼氏染色法探讨淫羊藿、黄芪、葛根有效组分复方对 APPswe/PS1ΔE9双转基因小鼠的学习记忆能力及病理学影响。
1 材料与方法
1.1 实验动物与分组处理 ♂的APPswe/PS1ΔE9双转基因小鼠6月龄20只,随机分为模型组(Tg组)和复方组(Tg effective fraction组),每组10只小鼠。复方组小鼠给予中药淫羊藿、黄芪、葛根提取的有效组分复方灌胃,1次/天,连续灌胃3个月。中药淫羊藿、黄芪、葛根提取的有效组分分别为淫羊藿苷、黄芪甲苷、葛根素,3种有效成分按照比例3∶2∶2,即淫羊藿苷120 mg·kg-1、黄芪甲苷 80 mg·kg-1、葛根素80 mg·kg-1体重给予小鼠灌胃。模型组采用等量生理盐水灌胃。6月龄C57BL/6J小鼠10只作为阴性对照(Non-Tg)。全部动物分别单笼喂养于光照/黑暗为12 h/12 h的恒温环境,自由摄食和饮水。
1.2 采用M orris水迷宫检测各组小鼠的学习记忆能力 采用Morris水迷宫对各组小鼠进行行为认知能力测试。Morris水迷宫主要由圆形水池和自动录像及分析系统组成。圆形水池直径120 cm、高50 cm,平台直径为10 cm,在整个实验中保持操作者位置及周围环境的相对稳定。
1.2.1 定位航行试验 历时5 d,每日分上、下午两个时段,固定时间为每日上午 9:00-11:00,下午14:00-16:00进行。每个时段分别从4个不同的入水点入水,将大鼠面向池壁放人水中,记录2 min内寻找到平台所用的时间,即逃避潜伏期。若小鼠入水后2 min内未能找到平台,则将其置于平台上并停留10 s,记录逃避潜伏期为120 s。每次训练时间间隔为60 s。同时记录各组小鼠的游泳速度,计算其平均游泳速度。
1.2.2 空间探索实验 用于测量动物对平台空间位置准确记忆,即记忆保持能力。d 6撤除平台,任选一个入水点将动物放入水中,动物在水中游泳120 s,测量120 s内小鼠跨过原平台的次数,即为跨台次数。
1.3 改良Bielschowsky银染法观察小鼠脑内老年斑 小鼠水迷宫后,甲醛灌注处死后取脑,石蜡包埋,常规石蜡切片脱腊至水,20%AgNO3水溶液37℃孵育30 min,4%甲醛还原,滴加氨银染液200 μl室温孵育10 min,3%甲醛溶液浸泡,逐级酒精脱水、二甲苯透明、中性树脂封片,光镜下观察。
1.4 尼氏染色观察 取石蜡切片,二甲苯脱蜡,梯度酒精脱水后入蒸馏水,置于预热至60℃的2%硫瑾染色30 min后,以蒸馏水速洗,用95%酒精分色,镜检至神经元尼氏体清晰呈紫色,无水酒精脱水,二甲苯透明,中性树胶封片,光镜下观察。
1.5 统计学方法 所有数据以¯x±s表示,采用SPSS 17.0软件进行统计学处理。Morris水迷宫逃避潜伏期采用重复测量资料的方差分析(RM ANOVA)。
2 结果
2.1 M orris水迷宫检测各组小鼠的学习记忆能力情况 水迷宫定位航行实验结果显示,模型组小鼠的逃避潜伏期与C57对照组小鼠相比明显延长(P<0.05),复方组小鼠的逃避潜伏期与模型组小鼠相比明显缩短(P<0.05),如 Fig 1。

Fig 1 Effects of effective fraction of Astragalus,Radix Puerariae,Epimedium on the escape latency of them ice in each group**P<0.01 vs C57 group;##P<0.01 vs AD model group.
APPswe/PS1ΔE9双转基因小鼠的游泳速度与 C57对照组小鼠相比增大(P<0.05),复方组小鼠的游泳速度与模型组小鼠相比无差异(P>0.05),如Fig 2。
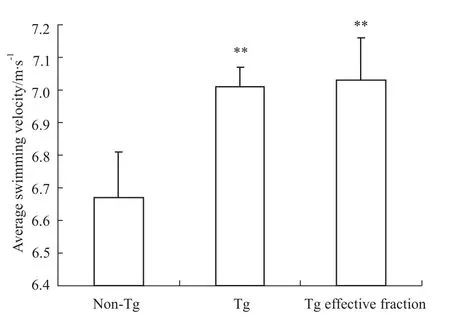
Fig 2 Effects of effective fraction of Astragalus,Radix Puerariae,Epimedium on the average swimming velocity of themice in each group**P<0.01 vs C57 group.
空间探索实验结果显示,模型组小鼠与C57对照组小鼠相比跨台次数减少(P<0.05),复方组小鼠跨台次数与模型组小鼠相比明显增多(P<0.05),如 Fig 3。
2.2 改良Bielschowsky银染法观察小鼠脑内老年斑 改良Bielschowsky银染法结果显示,C57对照组小鼠大脑皮质未见明显改变,神经原纤维排列有序、稀疏,如Fig 4A。模型组小鼠大脑皮质神经原纤维增粗、肿胀密集成宽带状,深染,神经纤维缠结明显,分布有大量老年斑,如Fig 4B;复方组小鼠大脑皮质神经纤维缠结情况减轻,可见少量老年斑,如Fig 4C。
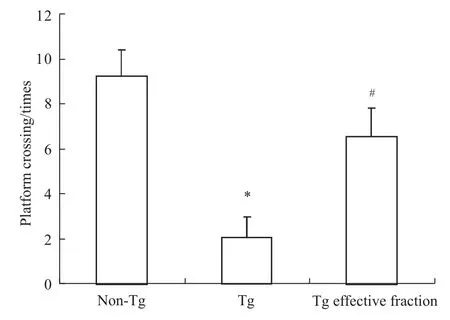
Fig 3 Effects of effective fraction of Astragalus,Radix Puerariae,Epimedium on the p latform crossing of them ice in each group*P<0.05 vs C57 group;#P<0.05 vs AD model group.
2.3 尼氏染色观察小鼠脑内病理改变 尼氏染色结果显示,C57对照组小鼠海马各区神经细胞排列整齐且密集,胞质中尼氏体丰富,大脑皮层尼氏小体呈深蓝色,细胞核淡蓝色,背景略呈浅蓝色,如图5A;模型组小鼠神经元水肿,细胞数量减少,排列稀疏,细胞间隙增大,胞质内尼氏体减少,分界不清,染成淡蓝色,如Fig 5B;复方组小鼠较模型组小鼠神经元水肿减轻,细胞数量增多,排量相对整齐,分界清晰,如Fig 5C。
3 讨论
AD是常见的老年人慢性退行性神经系统疾病,目前其病因、发病机制还不是十分清楚,很大程度上制约了AD治疗药物的筛选。
建立动物模型的目的是在实验动物身上复制人类疾病的模型,用于研究人类疾病的病因、发病、病理变化以及疾病的预防和治疗。人们已经设计了各种动物模型诸如胆碱能系统损伤模型[2]、铝模型[3]、tau蛋白模型[4]、Aβ模型[5]等,这些模型尽管可以存在部分特征性病理改变,但是因不能模拟人类疾病渐进性的退行性改变,均不太理想。
AD的病因是多元性的,遗传因素是其中的一个重要因素。研究发现,1号、14号、19号及21号染色体等均与AD发病密切相关[6]。其中包括APP基因、早老蛋白(presenilin,PS)基因[7]、载脂蛋白 E(apolipoprotein E,ApoE)基因[8]、Tau蛋白基因[9]、UBQLN1(ubiquilin-1)蛋白基因[10]、α2巨球蛋白基因(α2M)[11]、脂蛋白受体相关蛋白基因(LRP基因)、组织蛋白酶D基因(CTSD基因)、血管紧张素转换酶基因(ACE基因)、丁酰胆碱酯酶基因(BCHE基因)、超氧化物岐化酶基因、α1-抗糜蛋白酶基因、突触核蛋白基因及二氢脂酰胺琥珀酰转移酶基因以及其他许多不直接生成蛋白质的调节元素,此外,目前日趋成熟的转基因动物(transgenic animal)技术可以在活体上研究某一特定致病基因的作用,这些为转基因动物模型的建立提供了可能。

Fig 4 Effects of effective fraction of Astragalus,Radix Puerariae,Epimedium on the senile plaques in cerebral cortex of them ice in each groupA:Non-Tg;B:Tg;C:Tg effective fraction

Fig 5 Effects of effective fraction of Astragalus,Radix Puerariae,Epimedium on the cellular morphology in cerebral cortex of them ice in each groupA:Non-Tg;B:Tg;C:Tg effective fraction
阿尔采末病转基因动物模型种类繁多,包括单转基因动物模型,像 PDAPP小鼠[12]、Tg2576[13]、APP23[14]、PS转基因小鼠、JNPL3[15]等;双转基因动物模型,像 APPswe/PS1M146L、APPSL/PS1M146L、APPSL/PS1kI、APPKM670/671NL/APPV717F[16]、APP/apoE等;还包括多重转基因动物模型,如 APP/PS1/tau[17-18]、CDK5/p35/tau等。而目前应用最为广泛的为APPswe/PS1dE9双转基因小鼠模型,该模型是野生型C57BL/6J小鼠PS1基因E9缺失,不是灭活作用,促使其功能加强,是国际公认的AD转基因动物模型。APPswe/PS1dE9双转基因小鼠来源于 C57BL/6J小鼠,所以本实验选择C57BL/6J小鼠为阴性对照组。
本实验研究APPswe/PS1dE9双转基因小鼠模型行为学及病理学变化,Morris水迷宫实验结果显示9月龄APPswe/PS1dE9小鼠定位航行实验与空间探索实验结果与同月龄C57小鼠相比均有差异,说明9月龄APPswe/PS1dE9小鼠出现明显的记忆能力缺陷,这与本实验中病理学方法,改良Bielschowsky银染法结果发现9月龄APPswe/PS1dE9小鼠大脑皮质散在分布有老年斑和尼氏染色结果显示的APPswe/PS1ΔE9双转基因小鼠神经元水肿,细胞数量减少,尼氏体减少的结果相一致。
根据中医“标本兼治”的治疗原则,治疗AD应补肾健脾,益气养血以培其本;化痰、祛瘀、解毒以治其标。因此,我们课题组将淫羊藿、黄芪、葛根有效组分(淫羊霍苷、黄芪总苷、葛根素)进行组方,其中淫羊藿归肝、肾经,具补肾填精、生精养髓之功效,为君药;黄芪归肺、脾经,为补气圣药,具补气健脾、行血化瘀之功效,为臣药;葛根归脾、胃经,具清热、降火、排毒之功效,亦可升举清阳,引诸药上达于头目,为佐药。三药合用,共起滋补肝肾、补脾养血,活血化瘀、清热解毒、健脑益智之功。临床研究发现,AD患者在服用黄芪、淫羊藿、葛根等中药3个月后,其智力和记忆力得到有效提升,日常生活自理能力也有所增强,且治疗中未出现明显不良事件和副反应[19]。
本课题针对AD虚、痰、瘀、毒共存互结的发病特点,制定补虚、化瘀、涤痰、解毒的治法,将淫羊藿、黄芪、葛根组方,发现淫羊藿、黄芪、葛根有效组分复方可以有效地改善APP/PS1双转基因AD模型小鼠的学习记忆能力,减轻其大脑皮质神经纤维缠结、老年斑以及神经元水肿等改变。
参考文献:
[1] 张 颖,林森相,华 茜,等.三七和栀子有效成分对AD转基因小鼠早期脑内淀粉样蛋白清除作用的研究[J].中国药理学通报,2012,28(2):173-9.
[1] Zhang Y,Lin SX,Hua Q,et al.Research on themechanism of the active ingredients of Sanchi and Gardenia removing the early amyloid in the AD transgenic mouse brain[J].Chin Pharmacol Bull,2012,28(2):173-9.
[2] Kuznetsova E,Schliebs R.β-amyloid,cholinergic transmission,and cerebrovascular system-A developmental study in a mouse model of Alzheimer′s disease[J].Curr Pharm Des,2013,19(38):6749-65.
[3] Nivsarkar M,Banerjee A.Establishing the probablemechanism of L-DOPA in Alzheimer′s disease management[J].Acta Pol Pharm,2009,66(5):483-6.
[4] Lagoja I,Pannecouque C,Griffioen G,et al.Substituted 2-aminothiazoles are exceptional inhibitors of neuronal degeneration in tau-driven models of Alzheimer′s disease[J].Eur J Pharm Sci,2011,43(5):386-92.
[5] Prakash A,Medhi B,Chopra K.Granulocyte colony stimulating factor(GCSF)improvesmemory and neurobehavior in an amyloidβinduced experimentalmodel of Alzheimer′s disease[J].Pharmacol Biochem Behav,2013,110C:46-57.
[6] Masoodi T A,Al ShammariSA,Al-Muammar M N,etal.Exploration of deleterious single nucleotide polymorphisms in late-onset Alzheimer disease susceptibility genes[J].Gene,2013,512(2):429-37.
[7] Nizzari M,Thellung S,Corsaro A,et al.Neurodegeneration in Alzheimer disease:role of amyloid precursor protein and presenilin 1 intracellular signaling[J].JToxicol,2012,187297.
[8] Reiman EM,Chen K,Liu X,et al.Fibrillar amyloid-beta burden in cognitively normal people at 3 levels of genetic risk for Alzheimer′s disease[J].Proc Natl Acad Sci USA,2009,106(16):6820-5.
[9] Revett T J,Baker G B,Jhamandas J,et al.Glutamate system,amyloidβpeptides and tau protein:functional interrelationships and relevance to Alzheimer disease pathology[J].J Psychiatry Neurosci,2013,38(1):6-23.
[10]Viswanathan J,Haapasalo A,Böttcher C,et al.Alzheimer′s disease-associated ubiquilin-1 regulates presenilin-1 accumulation and aggresome formation[J].Traffic,2011,12(3):330-48.
[11]Depboylu C,Lohmüller F,Du Y,et al.Alpha2-macroglobulin,lipoprotein receptor-related protein and lipoprotein receptor-associated protein and the genetic risk for developing Alzheimer′s disease[J].Neurosci Lett,2006,400(3):187-90.
[12]Lee JE,Han P L.An update of animalmodels of Alzheimer disease with a reevaluation of plaque depositions[J].Exp Neurobiol,2013,22(2):84-95.
[13]Eketjäll S,Janson J,Jeppsson F,etal.AZ-4217:A high potency BACE inhibitor displaying acute central efficacy in different in vivo models and reduced amyloid deposition in Tg2576mice[J].J Neurosci,2013,33(24):10075-84.
[14]Nilsen L H,MeløT M,Saether O,et al.Altered neurochemical profile in the McGill-R-Thy1-APP ratmodel of Alzheimer′s disease:a longitudinal in vivo 1 H MRS study[J].J Neurochem,2012,123(4):532-41.
[15]Lewis J,McGowan E,Rockwood J,et al.Neurofibrillary tangles,amyotrophy and progressive motor disturbance in mice expressing mutant(P301L)tau protein[J].Nat Genet,2000,25:402-5.
[16]McLean D,Cooke M J,Albay R,et al.Positron emission tomography imaging of fibrillar parenchymal and vascular amyloid-βin TgCRND8 mice[J].ACSChem Neurosci,2013,4(4):613-23.
[17]Overk C R,Perez SE,Ma C,et al.Sex steroid levels and AD-like pathology in 3xTgAD mice[J].JNeuroendocrinol,2013,25(2):131-44.
[18]Marques SC,Lemos R,Ferreiro E,etal.Epigenetic regulation of BACE1 in Alzheimer′s disease patients and in transgenic mice[J].Neuroscience,2012,220:256-66.
[19]李立新,孙丽萍,尉继伟,等.益气养阴合剂加减辨证治疗老年性痴呆[J].中国临床康复,2005,16(9):93-4.
[19]Li L X,Sun L P,Wei JW,et al.Modified yiqi yangyinmixture in treating Alzheimer’s disease[J].Chin J Clin Rehabilitat,2005,16(9):93-4.
