UGT1A1基因启动子多态性与依立替康疗效及不良反应的相关性*
2014-05-13周政涛魏清张峰彭绪申文彩虹
周政涛,魏清,张峰,彭绪申,文彩虹
(三峡大学第一临床医学院、湖北省宜昌市中心医院1.肿瘤科;2.药剂科,宜昌 443003)
·用药指南·
UGT1A1基因启动子多态性与依立替康疗效及不良反应的相关性*
周政涛1,魏清2,张峰2,彭绪申1,文彩虹1
(三峡大学第一临床医学院、湖北省宜昌市中心医院1.肿瘤科;2.药剂科,宜昌 443003)
目的 探讨UGT1A1基因启动子多态性与依立替康毒性以及治疗效果之间的相关性。方法选择经病理证实、有可测量病灶、既往未接受过依立替康治疗的晚期大肠癌患者进入研究,采用FOLFIRI方案化学治疗(化疗),观察毒副反应发生情况和疗效;化疗前提取基因组DNA,分析UGT1A1基因启动子多态性。结果研究共入组患者102例,其中出现Ⅲ或Ⅳ度中性粒细胞减少15例,分别为75例6/6纯合野生型中8例(10.7%),21例6/7杂合突变型中4例(19.0%),6例7/7纯合突变型中3例(50.0%),3组间差异有统计学意义(P=0.027)。另外,102例患者中8例出现Ⅲ或Ⅳ度迟发性腹泻,7/7纯合突变型患者出现Ⅲ或Ⅳ度腹泻的概率明显高于另两组,6例患者中有2例出现Ⅲ或Ⅳ度腹泻(33.3%),6/6纯合野生型中Ⅲ或Ⅳ度腹泻的发生率为5.3%,6/7杂合突变型为9.5%,3组间差异有统计学意义(P=0.047)。进展时间(TTP)及总生存期(OS)方面,3组间差异无统计学意义(P=0.640)。结论UGT1A1基因启动子多态性与依立替康化疗导致的迟发性腹泻具有相关性,其突变型患者发生延迟性腹泻的风险增加。UGT1A1基因启动子多态性与依立替康化疗导致的中性粒细胞减少具有相关性,其突变型患者发生中性粒细胞减少的风险增加。UGT1A1基因启动子多态性与依立替康化疗疗效无相关性。
依立替康;不良反应;UGT1A1;癌,大肠;多态性,基因
IYER等[1-2]研究首先发现UGT1A1基因启动子的多态性变异可引起所对应酶的功能和分布异常,使酶活性下降,导致外源药物和内生底物醛酸化异常,而引起一系列连锁反应。ANDO等[3-4]在对日本大肠癌患者的研究中也观察到UGT1A1基因启动子的多态性与依立替康的化疗毒性反应相关。INNOCENTI等[5]在西方大肠癌患者中也观察到具有7/7的患者出现Ⅳ度中性粒细胞降低的频率是6/7,6/6患者的9.3倍(95%CI 2.4~36.4)。目前关于中国大肠癌患者UGT1A1基因启动子多态性的研究数量较少。王岩等[6]研究显示,中国大肠癌患者UGT1A1启动子纯合突变基因型TA 7/7很少见(约4.3%),而UGT1A1启动子野生基因型TA 6/6约72.9%,显著高于白种人的45.2%(P=0.005),这种差异与中国大肠癌患者应用依立替康导致的迟发性腹泻发生率较低有显著的相关性。但此研究病例数较少,属探索性研究。本研究的目的是了解晚期大肠癌患者UGT1A1基因启动子的多态性情况;并探讨UGT1A1基因启动子多态性与患者用依立替康化疗毒性(延迟性腹泻、中性粒细胞减少等)以及治疗效果之间的相关性,旨在通过UGT1A1启动子基因多态性来优化以依立替康为基础的化疗,避免其化疗的严重不良反应。
1 资料与方法
1.1 临床资料 病例选择入选标准:经组织学和/或细胞学证实的转移性或复发的Ⅳ期大肠癌;既往未接受过依立替康治疗;至少有一个可测量的客观肿瘤指标,如放射治疗(放疗)野内为唯一可测量的病灶,需停放疗>6个月;年龄≤75岁;一般行为状态评分,体力状况评分0~2分;预计生存时间≥6个月;血常规、肝肾功能正常,心电图基本正常;患者知情同意,并签署知情同意书。排除标准:目前正在接受其他有效治疗方案治疗者;妊娠或哺乳期患者;严重并发症者,肝、肾及心脏功能不全者;患有不易控制的精神病史者;研究者认为不宜参加本试验者。
1.2 给药方法 注射用盐酸依立替康(江苏恒瑞医药股份有限公司生产,批准文号:国药准字H20020687,规格:40 mg)180 mg·(m2)-1加入5%葡萄糖注射液500 mL,静脉滴注,滴注时间30~90 min,第1天;亚叶酸钙400 mg·(m2)-1加入5%葡萄糖注射液500 mL,静脉滴注,滴注时间30~90 min,第1天;氟尿嘧啶400 mg·(m2)-1,静脉推注,第1天。然后氟尿嘧啶1 200 mg·(m2)-1·d-1×2持续静脉滴注[总量2 400 mg·(m2)-1,输注46~48 h]。每2周为一周期,直至疾病进展(progression disease,PD)或无法耐受不良反应或达到完全缓解(complete response, CR),最多治疗12个周期。
1.3 疗效评价 化疗前抽取患者的外周血,提取基因组DNA,PCR法扩增目的基因片段,直接测序法分析UGT1A1基因启动子多态性。在患者每次接受4周期化疗后,进行影像学检查以评价疗效。疗效评价分为CR、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和PD、治疗有效(CR+PR)、疾病控制(CR +PR+SD),同时观察中位疾病进展时间(time to progression,TTP)和总生存期(overall survival,OS)。参照《美国国立癌症研究院不良事件通用毒性标准》第3版对不良反应进行评价,分为Ⅰ~Ⅳ度。
1.4 统计学方法 检测、记录结果用SPSS 17.0版软件分析,所有计数资料采用卡方检验Fisher’s确切概率法进行统计,用Kaplan-Meier法计算生存期,logrank检验比较不同组别之间的生存差异,P<0.05为差异有统计学意义。
2 结果
2.1 患者特征及UGT1A1基因启动子多态性频率分布 研究共入组102例患者,其中男63例(61.8%),女39例(38.2%);结肠癌61例,直肠癌41例;组织学分级高/中分化80例,低分化22例;癌胚抗原(CEA)升高者74例,正常者28例;伴肝转移者72例、肺转移者25例、其他部位转移者5例。UGT1A1基因启动子多态性与患者临床病理因素的相关性见表1。
2.2 UGT1A1基因启动子多态性与不良反应的相关性 血液学不良反应方面,大多数患者的不良反应为Ⅰ或Ⅱ度。102例患者中,15例出现Ⅲ或Ⅳ度中性粒细胞减少,其中6/6纯合野生型中8例(10.7%),6/7杂合突变型中4例(19.0%),7/7纯合突变型中3例(50.0%)。7/7纯合突变型可明显增加患者发生Ⅲ或Ⅳ度中性粒细胞减少的风险,3组间差异有统计学意义(P=0.027)。4例患者出现Ⅲ或Ⅳ度中性粒细胞减少性发热,其中6/6纯合野生型中2例(2.7%),6/7杂合突变型中1例(4.8%),7/7纯合突变型中1例(16.7%),3组间差异无统计学意义(P=0.23)。5例患者出现Ⅲ或Ⅳ度血小板减少,其中6/6纯合野生型中2例(2.7%),6/7杂合突变型中2例(9.5%),7/7纯合突变型中1例(16.7%),3组间差异无统计学意义(P=0.17)。4例患者出现Ⅲ或Ⅳ度贫血,其中6/6纯合野生型中2例(2.7%),6/7杂合突变型中1例(4.8%),7/7纯合突变型中1例(16.7%),3组间差异无统计学意义(P=0.23)。UGT1A1基因启动子非野生型多态性未增加Ⅲ或Ⅳ度中性粒细胞减少性发热、贫血及血小板下降的风险。
非血液学不良反应方面,102例患者中,8例出现Ⅲ或Ⅳ度迟发性腹泻。7/7纯合突变型患者出现Ⅲ或Ⅳ度迟发性腹泻的概率明显高于另外两组患者,其6例中有2例出现Ⅲ或Ⅳ度迟发性腹泻(33.3%),6/6纯合野生型中Ⅲ或Ⅳ度迟发性腹泻的发生率为5.3%, 6/7杂合突变型为9.5%,3组间差异有统计学意义(P=0.047)。Ⅲ或Ⅳ度恶心反应的发生率分别为8.0%,9.5%,33.3%,Ⅲ或Ⅳ度呕吐反应的发生率分别为8.0%,14.3%,16.7%,虽然7/7纯合突变型组中发生率稍高,但差异无统计学意义。3组中绝大部分患者都有黏膜反应,但都较轻微,Ⅲ或Ⅳ度黏膜炎的发生率分别为9.3%,9.5%,16.7%,差异无统计学意义(P=0.844)。3组患者中均无严重脱发反应,绝大部分患者化疗中都有疲乏反应,但都较轻微,Ⅲ或Ⅳ度疲乏的发生率分别为4.0%,4.8%,0.0%,差异无统计学意义(P=0.867)。Ⅲ或Ⅳ度神经毒性较少见,其6/6纯合野生型组中为2.7%,6/7杂合突变型中为4.8%,7/7纯合突变型患者中无Ⅲ或Ⅳ度神经毒性出现,差异无统计学意义(P=0.800)。UGT1A1基因启动子纯合突变型未增加腹泻以外的其他非血液学毒性如恶心、呕吐、黏膜炎、脱发、疲乏及外周神经毒性的发生风险。
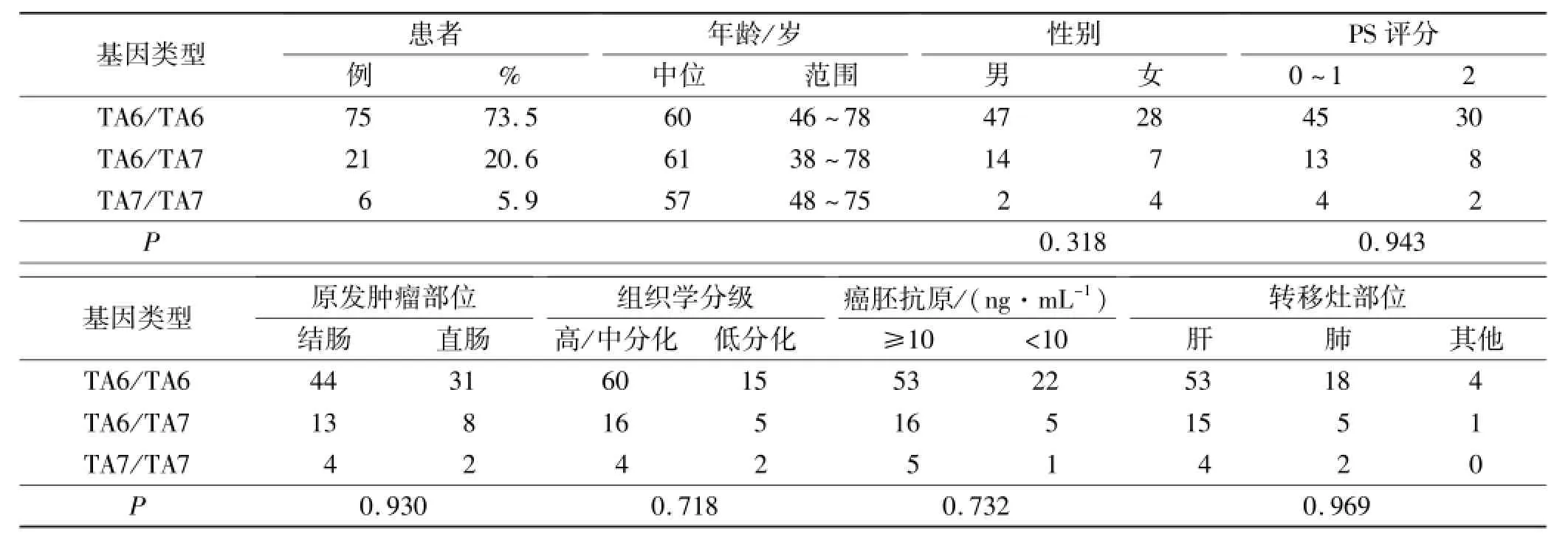
表1 UGT1A1基因启动子多态性与患者临床病理因素的相关性 例
2.3 UGT1A1基因启动子多态性与疗效的关系UGT1A1基因启动子多态性与依立替康化疗疗效无相关性。UGT1A1基因启动子多态性与疗效的关系见表2。
2.4 UGT1A1基因启动子多态性与生存期的关系在TTP方面,6/6纯合野生型为10个月,6/7杂合突变型及7/7纯合突变型均为9个月,3组间差异无统计学意义(P=0.798)。在OS方面,6/6纯合野生型的中位生存期为20个月,6/7杂合突变型为22个月,7/7纯合突变型为21个月,3组间差异无统计学意义(P= 0.640)。
3 讨论
3.1 UGT1A1基因启动子的多态性分布情况UGT1A1基因启动子的多态性分布具有明显的种族差异,7/7纯合突变型在白种人中分布较高。美国基因组在实践和预防中应用的评估(Evaluation of Genomic Applications in Practice and Prevention,EGAPP)工作组的报道显示[7]:在美国白人中,6/6纯合野生型、6/7杂合突变型、7/7纯合突变型的比例分别为44.0%, 45.0%,11.0%;在非洲和高加索人群中,7/7纯合突变型频率分别为12%~27%和5%~15%;在东南亚和太平洋人群中较低,为1.2%~5.0%[8-9]。在亚洲的一些相关研究中,日本人和韩国人的UGT1A1基因启动子分布频率也存在一定差异,在韩国人中启动子TA 7/7很罕见,而日本人中此类型的频率(5.9%)明显高于韩国人(0%)[10]。ZHANG等[11]对539例汉族人UGT1A1基因多态性分布频率进行了研究,发现UGT1A1基因启动子区野生型(TA)6/(TA)6占79.7%,杂合型(TA)6/(TA)7,占15.6%,纯合型(TA) 7/(TA)7占4.7%。LIU等[12]对128例中国台湾大肠癌患者的回顾性分析也显示7/7纯合突变型比例为4.7%。
本研究中102例患者中野生型TA6/TA6、杂合突变型TA6/TA7、纯合突变型TA7/TA7分别73.5%, 20.6%,5.9%,与以往汉族人群报告的结果基本相符。
3.2 UGT1A1基因启动子的多态性与依立替康致中性粒细胞减少的关系 在UGT1A1基因启动子的多态性与粒细胞减少的关系方面,多项研究的结果并不相同。中国台湾的LIU等[12]研究中,UGT1A1基因启动子突变型患者与Ⅲ度以上白细胞和(或)中性粒细胞减少明显相关。INNOCENTI等[5]的研究中观察到6/6纯合野生型患者中无Ⅳ度中性粒细胞降低,而在7/7纯合突变型中50%患者出现Ⅳ度中性粒细胞降低,6/7杂合突变型中Ⅳ度中性粒细胞降低的发生率为12.5%。ROUITS等[13]研究显示6/7杂合突变型、7/7纯合突变型与Ⅲ~Ⅳ度中性粒细胞降低具有显著相关性。ROTH等[14]的研究结果亦显示7/7纯合突变型患者中出现Ⅳ度中性粒细胞降低的风险明显增高。与上面报道不同的是, MARCUELLO等[15]研究中依立替康剂量350 mg·(m2)-1,每3周重复或180 mg·(m2)-1,每2周重复,他们观察到突变型患者血液学毒性增加,但与野生型相比差异无统计学意义。
本研究发现6/6纯合野生型、6/7杂合突变型、7/7纯合突变型患者Ⅲ或Ⅳ度中性粒细胞降低的发生率分别为10.7%,19.0%,50.0%(P=0.027),3组间差异有统计学意义。7/7纯合突变型可明显增加患者发生Ⅲ或Ⅳ度中性粒细胞减少的风险。但在血小板减少、贫血方面3组差异无统计学意义。
3.3 UGT1A1基因启动子的多态性与依立替康致腹泻的关系 在UGT1A1基因启动子的多态性与腹泻的关系方面,多项研究显示突变型患者Ⅲ或Ⅳ度腹泻的发生率明显高于野生型患者,在其他非血液学不良反应如恶心、呕吐、黏膜炎、脱发、疲乏、外周神经毒性等方面野生型与突变型患者之间差异无统计学意义。MARCUELLO等[15]研究发现迟发性腹泻的发生率与基因多态性具有明显相关性,6/6纯合野生型、6/7杂合突变型、7/7纯合突变型迟发性腹泻的发生率分别为17%,33%,70%(P=0.005)。季楚舒等[16]回顾性分析了64例接受依立替康/氟尿嘧啶一线化疗的晚期结直肠癌患者,发现突变型患者Ⅲ或Ⅳ度腹泻的发生率明显增高,其突变型、野生型腹泻的发生率分别为38.5%,9.8%,差异有统计学意义(P=0.035)。LIU等[12]回顾性分析了128例中国台湾晚期大肠癌患者接受依立替康双周治疗的结果,显示突变型(包括6/ 7,7/7)与野生型患者其严重腹泻的发生率分别为26.9%,5.9%(P<0.01),非野生型基因患者接受依立替康化疗需要下调剂量的比率明显高于野生型(42.3%比12.7%,P<0.01)。ANDO等[3-4]研究亦认为与野生型患者相比,突变型患者其严重腹泻的发生率增加3.5倍,

表2 UGT1A1基因启动子多态性与治疗效果的相关性
在本研究中,6/6野生型、6/7杂合突变型、7/7纯合突变型患者迟发性腹泻的发生率分别为5.3%, 9.5%,33.3%(P=0.047),UGT1A1非野生基因型可增加患者发生Ⅲ度以上腹泻的风险,7/7纯合突变型患者出现Ⅲ或Ⅳ度腹泻的概率明显高于另两组患者。
3.4 UGT1A1基因启动子的多态性与依立替康化疗疗效的关系 国内外的多项研究均显示UGT1A1基因启动子的多态性与依立替康化疗的疗效无相关性。在MARCUELLO等[15]的研究中,野生型和突变型患者在治疗有效率方面差异无统计学意义,但是他们观察到野生型患者的生存期有延长的趋势(P=0.09)。出现这种现象的原因部分可能是在突变型患者中由于严重腹泻导致依立替康剂量降低的缘故。KWEEKEL等[17]的研究中选用了不同的含依立替康方案,其结果显示TA6/TA6与TA6/TA7、TA7/TA7在依立替康化疗疗效方面差异无统计学意义。
本研究中,无论是治疗有效率、疾病控制率还是TTP、OS,3组之间均差异无统计学意义,与国内外的多项研究结果相符。
基于以上多项研究的结果,TOFFOLI等[18]进行了一项在基因检测指导下的Ⅰ期临床研究:在剔除7/7纯合突变型的晚期大肠癌患者中进行依立替康的Ⅰ期临床剂量递增研究,结果显示:在6/6纯合野生型患者中依立替康剂量递增至420 mg·(m2)-1、6/7杂合突变型患者中依立替康剂量递增至370 mg·(m2)-1出现剂量限制性毒性(dose-limiting toxicity,DLT),确定6/6纯合野生型患者的最大耐受剂量(maximum-tolerated dose,MTD)为370 mg·(m2)-1,6/7杂合突变型患者的MTD为310 mg·(m2)-1。提示对于这两类患者目前FOLFIRI方案中依立替康180 mg·(m2)-1剂量可能偏低。
综合以上多项研究结果,目前认为UGT1A1基因启动子多态性与依立替康化疗导致的迟发性腹泻、中性粒细胞减少具有相关性,其突变型较野生型的患者发生延迟性腹泻、中性粒细胞减少的风险增加;尤其是7/7纯合突变型患者其迟发性腹泻、中性粒细胞减少发生的风险增加更为显著。
[1] IYER L,KING C D,WHITINGTON P F,et al.Genetic predisposition to the metabolism of irinotecan(CPT-11).Role of uridine diphosphate glucuronosyltransferase isoform 1A1 in the glucuronidation of its active metabolite(SN-38)in human liver microsomes[J].J Clin Invest,1998,101(4): 847-854.
[2] IYER L,DAS S,JANISCH L,et al.UGT1A1*28 polymorphism as a determinant of irinotecan disposition and toxicity [J].Pharmacogenomics J,2002,2(1):43-47.
[3] ANDO Y,SAKA H,ANDO M,et al.Polymorphisms of UDP-glucuronosyltranserasegeneandirinotecantoxicity:a pharmacogenetic analysis[J].Cancer Res,2000,60(24): 6921-6926.
[4] ANDO Y,UEOKA H,SUGIYAMA T,et al.Polymorphisms of UDP-glucuronosyl transferase and pharmacokinetics of irinotecan[J].Ther Drug Monit,2002,24(1):111-116.
[5] INNOCENTI F,UNDEVIA S D,IYER L,et al.Genetic variants in the UDP-glucuronosyltransferase 1A1 gene predict the risk of severe neutropenia of irinotecan[J].J Clin Oncol,2004,22(8):1382-1388.
[6] 王岩,徐建明,沈琳,等.中国人尿苷二磷酸葡糖苷酸转移酶lA基因多态性与伊立替康毒性的相关性[J].中华肿瘤杂志,2007,29(12):913-916.
[7] Evaluation of Genomic Applications in Practice and Prevention(EGAPP)Working Group.Recommendations from the EGAPP Working Group:can UGT1A1 genotyping reduce morbidity and mortality in patients with metastatic colorectal cancer treated with irinotecan?[J].Genet Med,2009,11 (1):15-20.
[8] YONG W P,INNOCENTI F,RATAIN M J.The role of pharmacogenetics incancertherapeutics[J].BrJClin Pharmacol,2006,62(1):35-46.
[9] PREMAWARDHENA A,FISHER C A,LIU Y T,et al.The global distribution of length polymorphisms of the promoters oftheglucuronosyltransferase1gene(UGT1A1): hematologic and evolutionary implications[J].Blood Cells Mol Dis,2003,31(1):98-101.
[10] HAN J Y,LIM H S,SHIN E S,et al.Comprehensive analysisofUGT1Apolymorphismspredictiveforpharmacokinetics and treatment outcome in patients with non-small-ell lungcancertreatedwithirinotecanand cisplatin[J].J Clin Oncol,2006,24(15):2237-2244.
[11] ZHANG A,XING Q,QIN S,et al.Intra-ethnic differences in genetic variants of the UGT-glucuronosyltransferase 1A1 gene in Chinese populations[J].Pharmacogenomics J, 2006,7(5):333-338.
[12] LIU C Y,CHEN P M,CHIOU T J,et al.UGT1A1*28 polymorphism predicts irinotecan-induced severe toxicities without affecting treatment outcome and survival in patients with metastatic colorectal carcinoma[J].Cancer,2008,112 (9):1932-1940.
[13] ROUITS E,BOISDRON-CELLE M,DUMONT A,et al.Relevance of different UGT1A1 polymorphisms in irinotecaninduced toxicity:a molecular and clinical study of 75 patients[J].Clin Cancer Res,2004,10(15):5151-5159.
[14] ROTH A D,YAN P,DIETRICH D,et al.Is the UGT1A*28 homozygosity the strongest predictor for severe hematoxicity in patients with 5-fluorouracil(5-FU)-irinotecan(IRI)? Results of the PETACC 3-EORTC 40993-SAKK 60/00 trial comparing IRI/5-FU/folinic acid(FA)to 5-FU/FA in stage II-III colon cancer(COC)patients(Abstract No. 4036)[J].J Clin Oncol,2008,26.
[15] MARCUELLO E,ALTES A,MENOYO A,et al.UGT1A1 gene variations and irinotecan treatment in patients with metastatic colorectal cancer[J].Br J Cancer,2004,91(4): 678-682.
[16] 季楚舒,何义富,胡冰,等.UGT1A1*28基因多态性与晚期结直肠癌伊立替康化疗疗效及不良反应的关系[J].肿瘤,2010,30(10):870-874.
[17] KWEEKEL D M,GELDERBLOM H,VAN DER STRAATEN T,et al.UGT1A1*28 genotype and irinotecan dosage in patients with metastatic colorectal cancer:a dutch colorectal cancer group study[J].Br J Cancer,2008,9(2): 275-282.
[18] TOFFOLI G,CECCHIN E,GASPARINI G,et al.GenotypedrivenphaseIstudyofirinotecanadministeredin combination with fluorouracil/leucovorin in patients with metastatic colorectal cancer[J].J Clin Oncol,2010,28(5): 866-871.
DOI 10.3870/yydb.2014.08.029
R979.1;R969.3
B
1004-0781(2014)08-1083-05
2013-10-17
2014-01-11
*宜昌市医疗卫生科技计划项目(A0930102)
周政涛(1968-),男,湖北郧西人,副主任医师,博士,研究方向:肿瘤内科学。电话:(0)15972698932,E-mail: zhouzhengtao@126.com。
