节瓜Ty1-copia类逆转座子逆转录酶序列的克隆及比对
2014-05-11谢大森罗少波彭庆务李明珠
赵 芹,谢大森,江 彪,罗少波,彭庆务,李明珠
(广东省农业科学院蔬菜研究所,广东广州510640)
节瓜Ty1-copia类逆转座子逆转录酶序列的克隆及比对
赵 芹①,②,谢大森①,江 彪,罗少波,彭庆务,李明珠
(广东省农业科学院蔬菜研究所,广东广州510640)
对8个节瓜(Benincasa hispida var.chieh-qua How)品系基因组DNA中的Ty1-copia类逆转座子逆转录酶核苷酸序列进行扩增,并对品系A39FA的29个克隆产物的核苷酸序列及翻译的氨基酸序列的系统进化和同源性进行了分析,还对29条氨基酸序列进行了比对。扩增结果表明:8个节瓜品系的基因组DNA中均包含长度约260 bp的逆转录酶核苷酸片段;从品系A39FA中获得的29条Ty1-copia类逆转座子逆转录酶核苷酸序列(CqRt1至CqRt29)的长度为247~267 bp,同源率为46.2%~98.1%,而它们的氨基酸序列同源率为26.7%~98.8%。序列分析结果表明:节瓜Ty1-copia类逆转座子逆转录酶核苷酸序列中碱基A、T、G和C的数量分别为65~96、47~92、45~74和32~49,所有序列均富含碱基A和T,AT/GC比为1.35~2.33;缺失突变是造成节瓜Ty1-copia类逆转座子逆转录酶核苷酸序列长度差异的主要因素,在序列长度和碱基组成方面的明显差异表明节瓜Ty1-copia类逆转座子逆转录酶核苷酸序列具有高度异质性。翻译后的氨基酸序列中有21条序列存在终止密码子突变、12条序列存在移框突变,表明Ty1-copia类逆转座子是节瓜基因组内序列重组的热点。通过聚类分析可将29个逆转录酶核苷酸序列分为5个家族(Family),分别包括16、4、4、4和1条序列,其中Family 1可能是具有转座活性的逆转座子家族,但存在转录活性的逆转录酶序列仅占全部序列数量的20.69%。将每一家族中的1~2条序列与其他15种植物的Ty1-copia类逆转座子逆转录酶的氨基酸序列进行比对,显示出较高的同源性。研究结果表明:节瓜与其他植物的Ty1-copia类逆转座子可能有相同起源,而且Ty1-copia类逆转座子可在不同类群间横向传递。
节瓜;Ty1-copia类逆转座子;逆转录酶;序列分析;同源性;系统发育
逆转座子是以RNA为中间产物,在寄主基因组内不断转座增殖并影响寄主基因组大小、结构、功能及进化等的转座元件,是真核生物中种类最多、分布最广的转座因子,还是植物核基因组的重要组成部分,通常约占核基因组大小的一半以上[1]。根据DNA结构特征,逆转座子可分为长末端重复序列(long terminal repeat,LTR)和非长末端重复序列(non-long terminal repeat,non-LTR)两类,前者又可分为Ty1-copia类和Ty3-gypsy类,其中Ty1-copia类在植物界中广泛分布,且相关研究最多[2]。
在受到各种生物和非生物因子的胁迫后,植物体内的逆转座子活性被激活,引起基因突变、基因组扩增及重排等,导致植物发生遗传变异,因此,开展逆转座子的相关研究对研究植物基因组的组成、进化及基因的表达调控有重要意义。依据进化关系可将逆转座子划分为不同家族,各家族内成员越复杂,存在具转座活性的逆转座子的可能性越大、亲缘关系越近,转座发生的时间也可能越近;反之,则转座历时久远,继续转座的可能性也越小[3]。目前,对许多作物的逆转座子组成与分析已有研究报道[4-6],且逆转座子已广泛应用于植物种质资源及遗传育种研究,如应用于钝稃野大麦(Hordeum spontaneum C.Koch.)[7]、豌豆属(Pisum Linn.)种类[8]、野豌豆属(Vicia Linn.)种类[9]、烟草(NicotianatabacumLinn.)[10]、茄子(Solanum melongena Linn.)[11]、柑橘属(Citrus Linn.)和枳属(Poncirus Raf.)种类[12-14]、苹果(Malus pumila Mill.)[15-17]和柿(Diospyros kaki Thunb.)[18-19]等类群的种质鉴定、遗传图谱构建和系统进化等方面的研究。
节瓜(Benincasa hispida var.chieh-qua How)是华南地区特色蔬菜,品种十分丰富。作者所在研究室曾通过镰刀菌酸离体筛选获得节瓜抗枯萎病突变体,并通过航天诱变育种获得一系列有价值的育种材料,但目前对节瓜不同品种的形成与进化关系不甚明了,对节瓜各种生物学性状的遗传多样性研究报道也甚少。因此,明确节瓜遗传进化及生物学性状与逆转座子之间的关系,对追溯现有节瓜品种来源和培育优良节瓜品种具有重要意义。在前期采用抑制消减技术研究感病节瓜及其抗病突变体与枯萎病菌互作机制时,作者所在研究室分离获得了与Ty1-copia多聚蛋白相似性很高的基因片段,推测在接种枯萎病菌后节瓜逆转座子可能被激活[20]。为此,作者对节瓜Ty1-copia类逆转座子逆转录酶序列进行克隆和分析,并研究其转录活性,探讨节瓜Ty1-copia类逆转座子逆转录酶片段的变化特点及其与其他植物的相似性,以期为节瓜基因组起源与进化及遗传多样性评价提供依据。
1 材料和方法
1.1 材料
供试节瓜品系612FA、H2251、SY3、LT550、A06、A39FA、P3-1-2和LT8的种子由研究室多代自交保存;将其播种于灭菌基质上,在温度25℃、光照度2 000 lx、光照时间12 h·d-1的人工气候箱中培养至幼苗长出2片真叶。
大肠杆菌菌株DH5α由本课题组保存;琼脂糖购自广州威佳生物技术有限公司;Ex Taq DNA聚合酶、dNTPs和pMD18-T载体试剂盒购自广州瑞真生物技术有限公司;DNA回收试剂盒、CTAB、Amp抗生素和DNA marker购自广州鼎国生物技术有限公司。
1.2 方法
1.2.1 DNA提取及逆转录酶片段的PCR扩增 采集新鲜叶片,利用CTAB法提取基因组总DNA,将其溶解于少量灭菌双蒸水中。采用质量体积分数1.0%琼脂糖凝胶电泳和GENEQUANT纳米紫外分光光度计(德国Eppendorf公司)检测总DNA的浓度和纯度,于-20℃保存、备用。
参照文献[21]设计扩增逆转座子逆转录酶序列的上、下游引物,上游引物Ty1-F的序列为5′-ACNG CNTTRRTNCARGG-3′,下游引物Ty1-R的序列为5′-AYCATYTCYTCNACYTA-3′(N=A/T/C/G、R=A/ G、Y=T/C)。PCR反应体系总体积25 μL,包括50 ng DNA,0.16 mmol·L-1dNTPs,2.5 μL 10×Ex buffer(含MgCl2),1.0 μmol·L-1上、下游引物和1 U Ex Taq DNA聚合酶,用灭菌双蒸水补足体积。PCR反应在GeneAmp PCR System 9700 PCR仪(美国ABI公司)上完成,PCR扩增程序为:95℃预变性3 min;95℃变性30 s、45℃退火30 s、72℃延伸30 s,共35个循环;最后于72℃延伸10 min。扩增产物用质量体积分数1.2%琼脂糖凝胶电泳,并用GeneGeniusBio Imaging System(美国Bio-Rad公司)进行观察和拍照。
商业人像摄影自从90年代初盛行全国以来,在摄影风格上大致经历了三个阶段。最初是国营照相馆的中规中矩的固定模式,人物造型比较古朴,不注重化妆造型,虽然讲究用光技法,但照片没有时代感,缺乏新意。而后,随着台湾影楼的大举进入,其平光重妆,讲究人物包装与造型多变的摄影风格成为全国影楼效仿的样板。90年代末,“前卫”、“时尚”摄影又成为潮流。迎合时尚是名利双收的一条捷径。创意摄影运用特殊手段以夸张的色彩、反常规构图、两底叠放等表现形式和手法,构筑作品的情调,刻画被摄者的性格和心态。
1.2.2 PCR产物的回收纯化与克隆分析 纯化的PCR产物与pMD18-T载体在16℃条件下过夜连接,转化大肠杆菌JM109感受态细胞,并用Amp抗生素和半乳糖苷酶的底物X-gal进行蓝白斑筛选;挑取白斑菌落,采用M13通用引物进行PCR扩增;取1 mL阳性克隆菌液交由广州英骏生物技术有限公司测序。
1.2.3 逆转录酶序列的测定及序列分析 利用NCBI VecScreen程序去除载体部分,用DNAStar软件对获得的逆转录酶序列长度、碱基组成和AT/GC比等进行分析与序列同源比对,结合GenBank中其他植物的相应序列构建系统进化树。
2 结果和分析
2.1 节瓜Ty1-copia类逆转座子逆转录酶基因序列的PCR扩增结果
利用设计的简并引物扩增Ty1-copia类逆转座子逆转录酶基因序列,结果显示:从8个节瓜品系中均扩增得到长度约260 bp的逆转录酶基因序列片段(图1),与Tao等[22]对枳〔Poncirus trifoliata(Linn.) Raf.〕Ty1-copia类逆转座子逆转录酶基因的研究结果一致,说明Ty1-copia类逆转座子在节瓜中普遍存在。

图1 8个节瓜品系Ty1-copia类逆转座子逆转录酶基因序列的PCR扩增图谱Fig.1 PCR amplification pattern of sequence of reverse transcriptase gene of Ty1-copia-like retrotransposon from 8 lines of Benincasa hispida var.chieh-qua How
将品系A39FA的PCR扩增产物回收、克隆,随机挑取30个菌落,对PCR鉴定阳性的克隆测序,获得29条核苷酸序列片段。利用NCBI BLAST程序进行同源搜索,结果显示:获得的所有片段均含有逆转录酶保守域,与其他植物的Ty1-copia类逆转座子逆转录酶基因序列具有较高同源性,说明从节瓜中获得的这些核苷酸序列片段均为Ty1-copia类逆转座子逆转录酶基因序列,依次命名为CqRt1至CqRt29。
2.2 节瓜Ty1-copia类逆转座子逆转录酶核苷酸序列组成分析
节瓜品系A39FA的Ty1-copia类逆转座子逆转录酶核苷酸序列的组成见表1。29个Ty1-copia类逆转座子逆转录酶核苷酸序列长度并不完全一致,变化范围为247~267 bp,其中CqRt24序列最长,CqRt7序列最短,多数序列长度为266 bp。Stergiou等[23]报道油橄榄(Olea europaea Linn.)的Ty1-copia类逆转座子逆转录酶核苷酸序列长度为273 bp,对应编码91个氨基酸;而本研究获得的29个逆转录酶核苷酸序列长度均小于273 bp,均有不同程度的缺失,说明缺失突变是造成节瓜逆转录酶核苷酸序列长度变化的主要原因。对碱基组成的分析结果显示:节瓜Ty1-copia类逆转座子逆转录酶核苷酸序列中碱基A、T、G和C的数量分别为65~96、47~92、45~74和32~49,所有序列均富含碱基A和T,AT/GC比为1.35~2.33,与油橄榄的Ty1-copia类逆转座子逆转录酶核苷酸序列的碱基组成一致[23]。
由此可见,由同一简并引物PCR扩增所得的节瓜Ty1-copia类逆转座子逆转录酶核苷酸序列并不一致,它们的碱基组成及序列长度均存在较大差异,表明节瓜品系内同一类群逆转座子间存在高度的异质性,苹果、黄瓜(Cucumis sativus Linn.)、辣椒(Capsicum annuum Linn.)和梨(Pyrus spp.)等植物也有类似特点[24-27]。
2.3 节瓜Ty1-copia类逆转座子逆转录酶核苷酸序列的系统进化分析
为阐明节瓜中Ty1-copia类逆转座子间的相互关系,利用DNAStar中的MegAlign软件对29条逆转录酶核苷酸序列进行聚类分析,并构建系统进化树,结果见图2。根据核苷酸替代值可将29条序列分成5个家族(Family),同一家族内的序列代表来源于同一祖先的遗传家系,而不同家族包含的序列数差异则反映了各家族逆转座子转座过程的差异,包含克隆数越多的家族历史越久远。Family 5仅有1条序列,与其他家族的遗传距离较远;Family 1至Family 4分别包括16、4、4和4条序列,其中Family 1包含的序列数占总序列数的55.17%,说明该家族是构成节瓜Ty1-copia类逆转座子的主要成分。
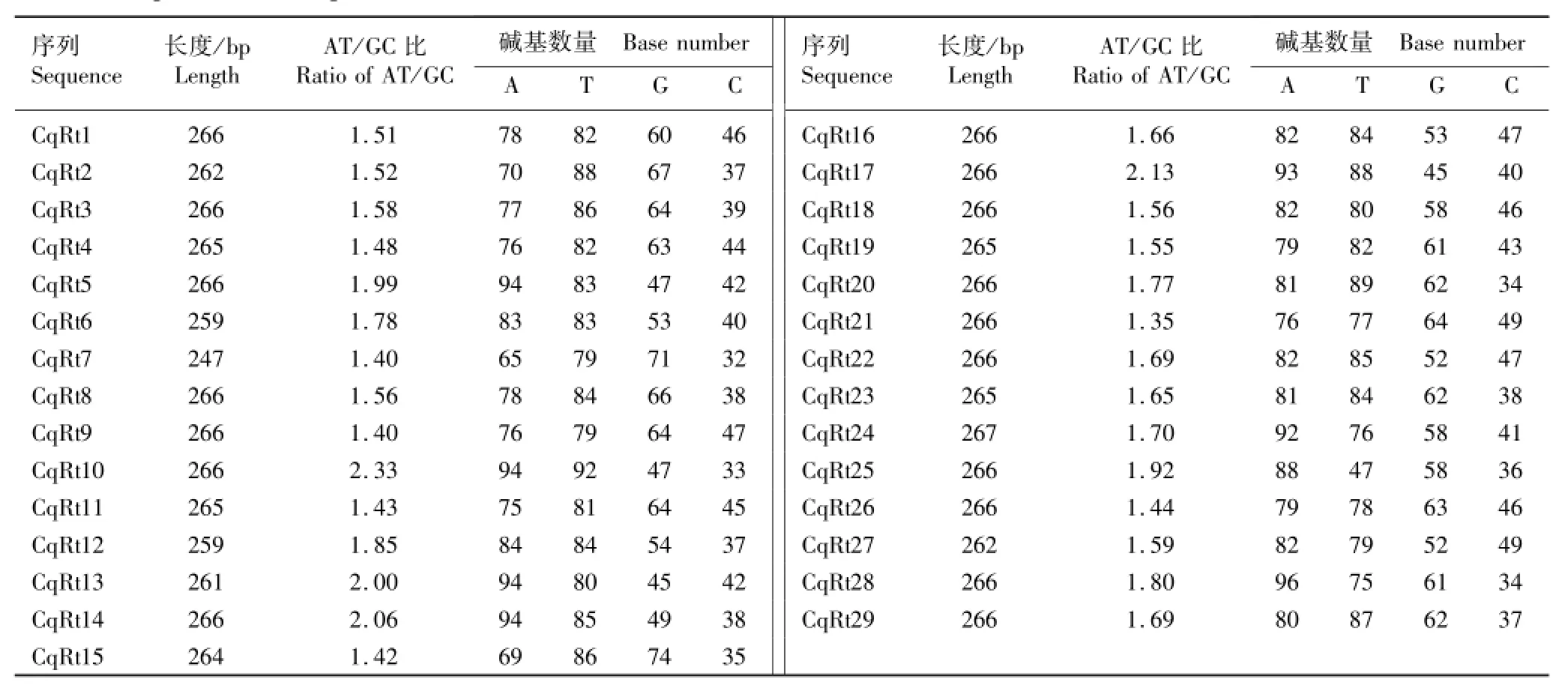
表1 节瓜品系A39FA的Ty1-copia类逆转座子逆转录酶核苷酸序列的长度和碱基组成Table1 Length and base composition of nucleotide sequence of reverse transcriptase of Ty1-copia-like retrotransposon from line A39FA of Benincasa hispida var.chieh-qua How
2.4 节瓜Ty1-copia类逆转座子逆转录酶核苷酸序列及氨基酸序列的同源性分析
节瓜Ty1-copia类逆转座子逆转录酶核苷酸序列及氨基酸序列的同源性分析结果见表2。
结合图2和表2、根据核苷酸替代值综合分析可见:在29条节瓜Ty1-copia类逆转座子逆转录酶核苷酸序列中CqRt6和CqRt12的遗传距离最近,其核苷酸序列和氨基酸序列的同源率均最高,分别达98.1%和98.8%;CqRt15与CqRt27的核苷酸序列同源率最低(46.2%),CqRt16与CqRt28的氨基酸序列同源率最低(26.7%),说明同一来源的逆转座子异质性较高。Family 1中CqRt9与CqRt11核苷酸序列遗传距离最近,其同源率为92.8%,氨基酸序列同源率为84.2%;Family 2中CqRt7与CqRt15核苷酸序列遗传距离最近,其同源率为91.5%,氨基酸序列同源率为84.1%;Family 3中CqRt20与CqRt29核苷酸序列遗传距离最近,其同源率为93.6%,氨基酸序列同源率为87.5%;Family 4中CqRt6与CqRt12核苷酸序列遗传距离最近。各家族所包含的克隆数越多、序列同源率越高,发生转座的时间越近,具有转座活性的可能性也越大。Family 1包含4个具有转录活性的逆转座子(CqRt14、CqRt18、CqRt21和CqRt24),可能是具有转座活性的逆转座子家族。
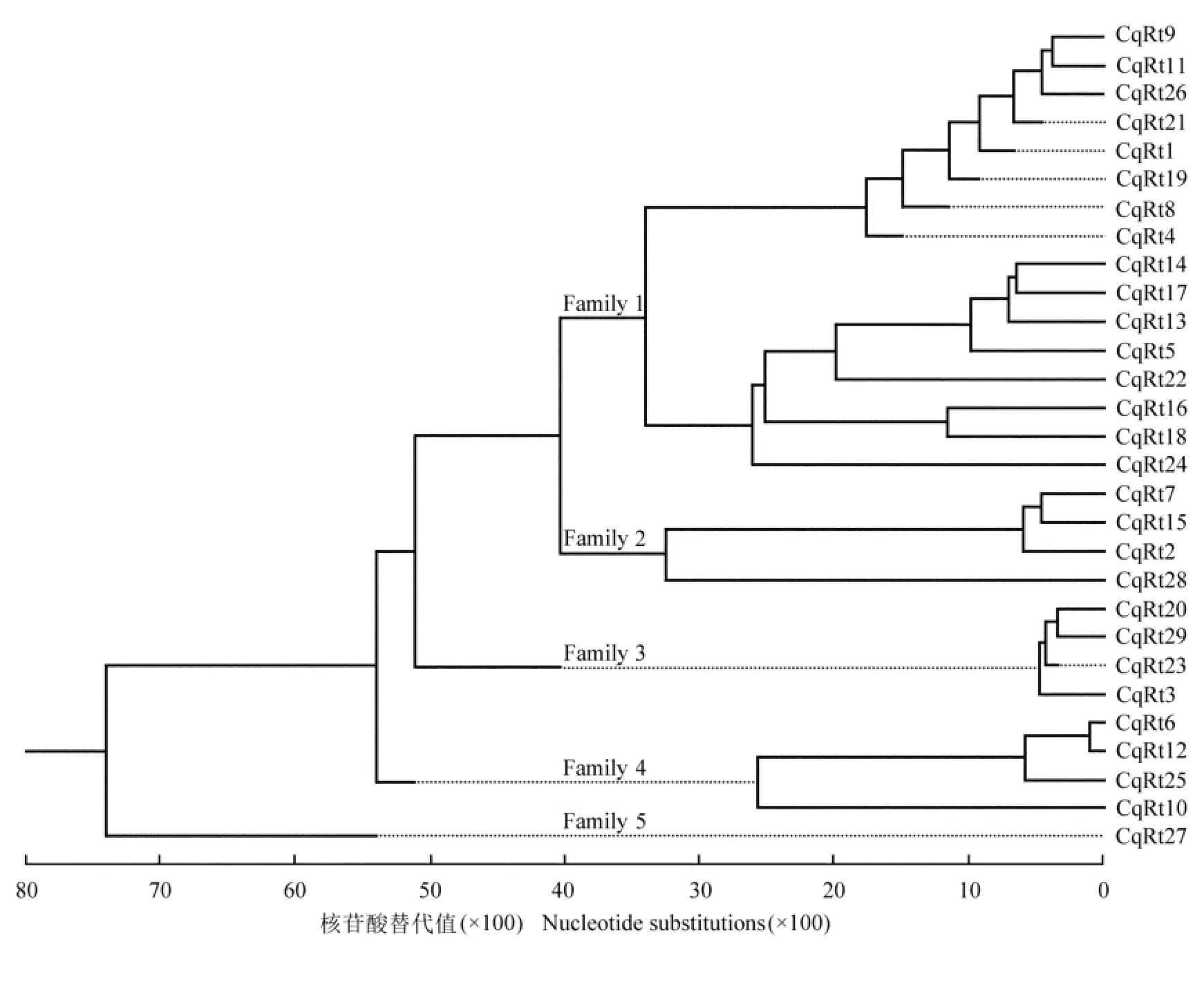
图2 节瓜Ty1-copia类逆转座子逆转录酶核苷酸序列的系统进化树Fig.2 Phylogenetic tree of nucleotide sequence of reverse transcriptase of Ty1-copia-like retrotransposon from Benincasa hispida var.chieh-qua How
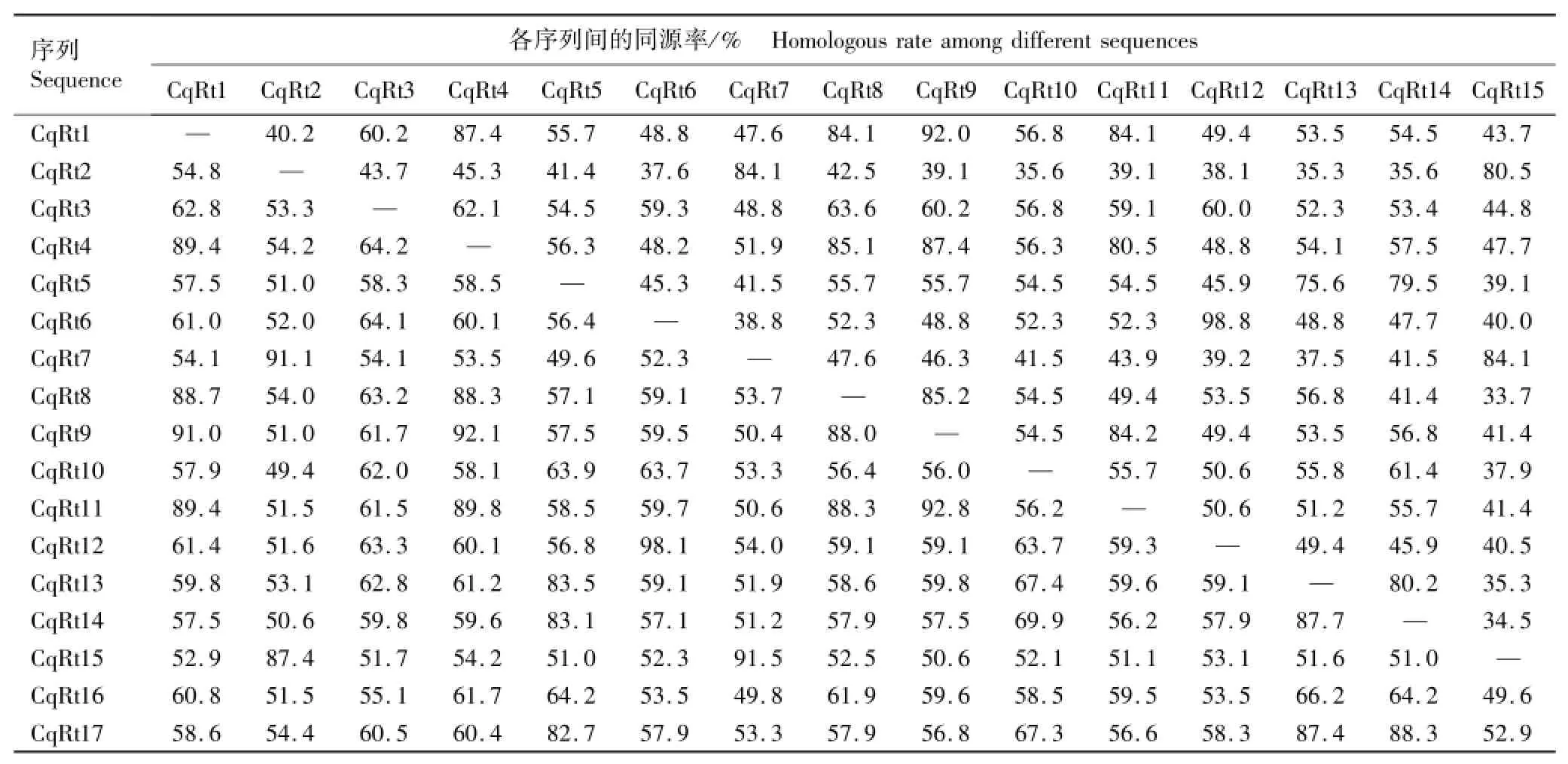
表2 节瓜Ty1-copia类逆转座子逆转录酶核苷酸序列与氨基酸序列的同源率1)Table2 Homologous rate among nucleotide sequences and among amino acid sequences of reverse trancriptase of Ty1-copia-like retrotransposon from Benincasa hispida var.chieh-qua How1)
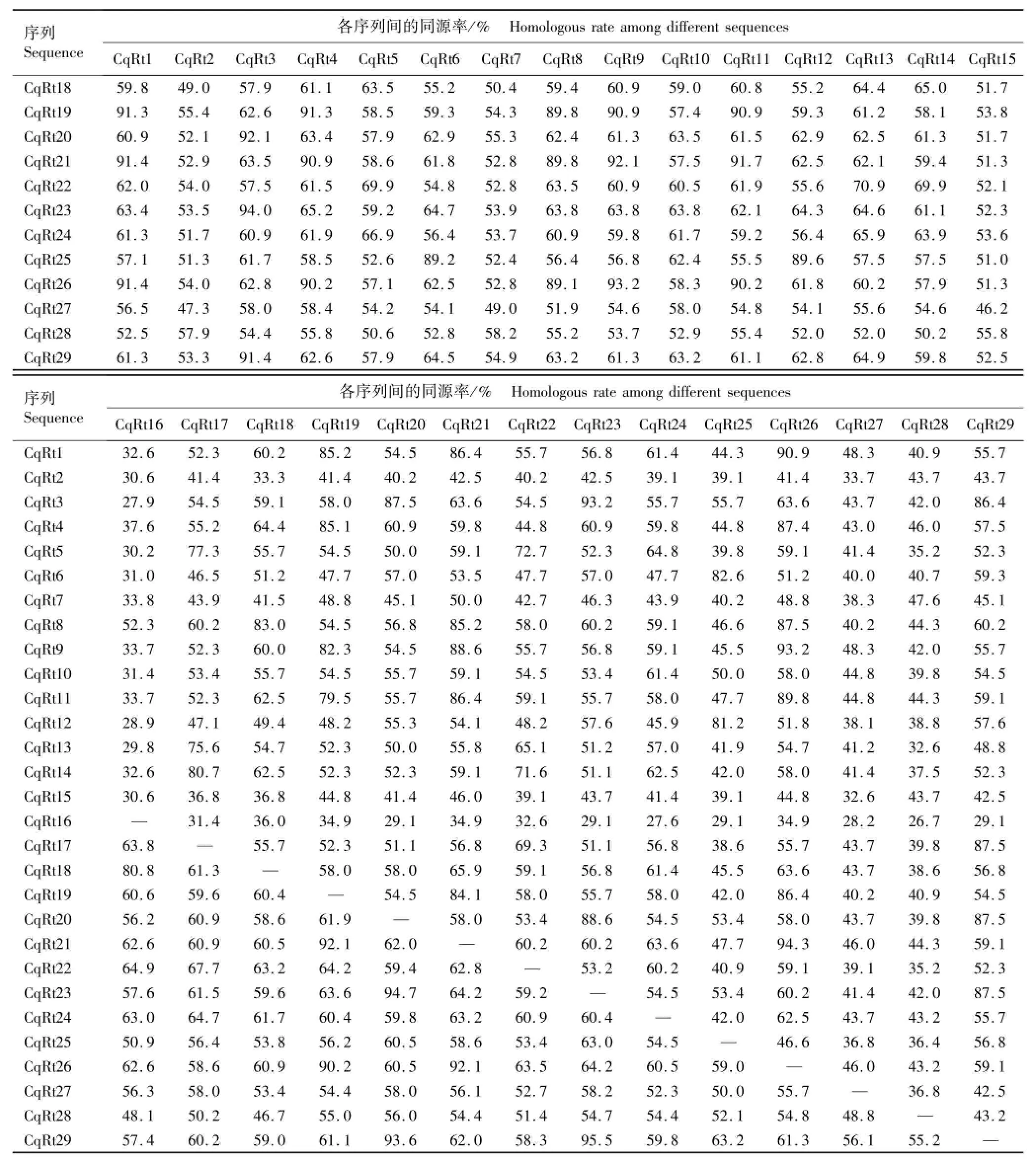
续表2 Table 2(Continued)
2.5 节瓜中Ty1-copia类逆转座子逆转录酶氨基酸序列的突变分析

图3 节瓜29条Ty1-copia类逆转座子逆转录酶氨基酸序列的比对Fig.3 Alignment of 29 amino acid sequences of reverse transcriptase of Ty1-copia-like retrotransposon from Benincasa hispida var.chieh-qua How
参照已报道的Ty1-copia类逆转座子逆转录酶的氨基酸保守序列,将29条节瓜Ty1-copia类逆转座子逆转录酶的核苷酸序列翻译成氨基酸序列,结果见图3。在29条序列中,有12条氨基酸序列发生移框突变,分别是CqRt2(第17位氨基酸)、CqRt4(第36位氨基酸)、CqRt6(第14位氨基酸)、CqRt7(第17位氨基酸)、CqRt11(第17位氨基酸)、CqRt12(第14位氨基酸)、CqRt13(第23和第74位氨基酸)、CqRt15(第 44位氨基酸)、CqRt16(第18位氨基酸)、CqRt23(第66位氨基酸)、CqRt24(第39位氨基酸)和CqRt27 (第39位氨基酸)。21个逆转录酶序列存在终止密码子突变,其中CqRt15分别在第16、第23、第38和第41位氨基酸处存在4个终止密码子突变,CqRt4(第45、第56和第69位氨基酸)和CqRt19(第6、第56和第73位氨基酸)存在3个终止密码子突变,CqRt1(第57和第70位氨基酸)、CqRt2(第9和第41位氨基酸)、CqRt8(第41和第63位氨基酸)、CqRt16(第41和第55位氨基酸)、CqRt22(第22和第37位氨基酸)、CqRt28(第19和第41位氨基酸)和CqRt25(第41和第46氨基酸)存在2个密码子突变,CqRt3(第49位氨基酸)、CqRt5(第25位氨基酸)、CqRt6(第39位氨基酸)、CqRt9(第70位氨基酸)、CqRt11(第41位氨基酸)、CqRt12(第39位氨基酸)、CqRt13(第45位氨基酸)、CqRt17(第40位氨基酸)、CqRt20(第45位氨基酸)、CqRt23(第49位氨基酸)和CqRt29(第41位氨基酸)存在1个终止密码子突变。存在转录活性的逆转录酶序列为CqRt7、CqRt10、CqRt14、CqRt18、CqRt21和CqRt24,只占全部序列数量的20.69%,所以导致逆转座子突变、无法表达及逆转座子异质性的重要原因可能为移框突变与终止密码子突变。
2.6 节瓜Ty1-copia类逆转座子逆转录酶氨基酸序列的系统进化分析
将29条节瓜Ty1-copia类逆转座子逆转录酶氨基酸序列进行NCBI BLASTx同源搜索,结果显示:来源于节瓜的29条逆转录酶氨基酸序列比较复杂,与黄瓜、水稻(Oryza sativa Linn.)、草莓(Fragaria× ananassa Duch.)、番茄(Lycopersicon esculentum Mill.)、葡萄(Vitis vinifera Linn.)、芸薹(Brassica campestris Linn.)、甜菜(Beta vulgaris Linn.)及藜属(Chenopodium Linn.)种类的Ty1-copia类逆转座子逆转录酶基因的氨基酸序列有较高同源性。
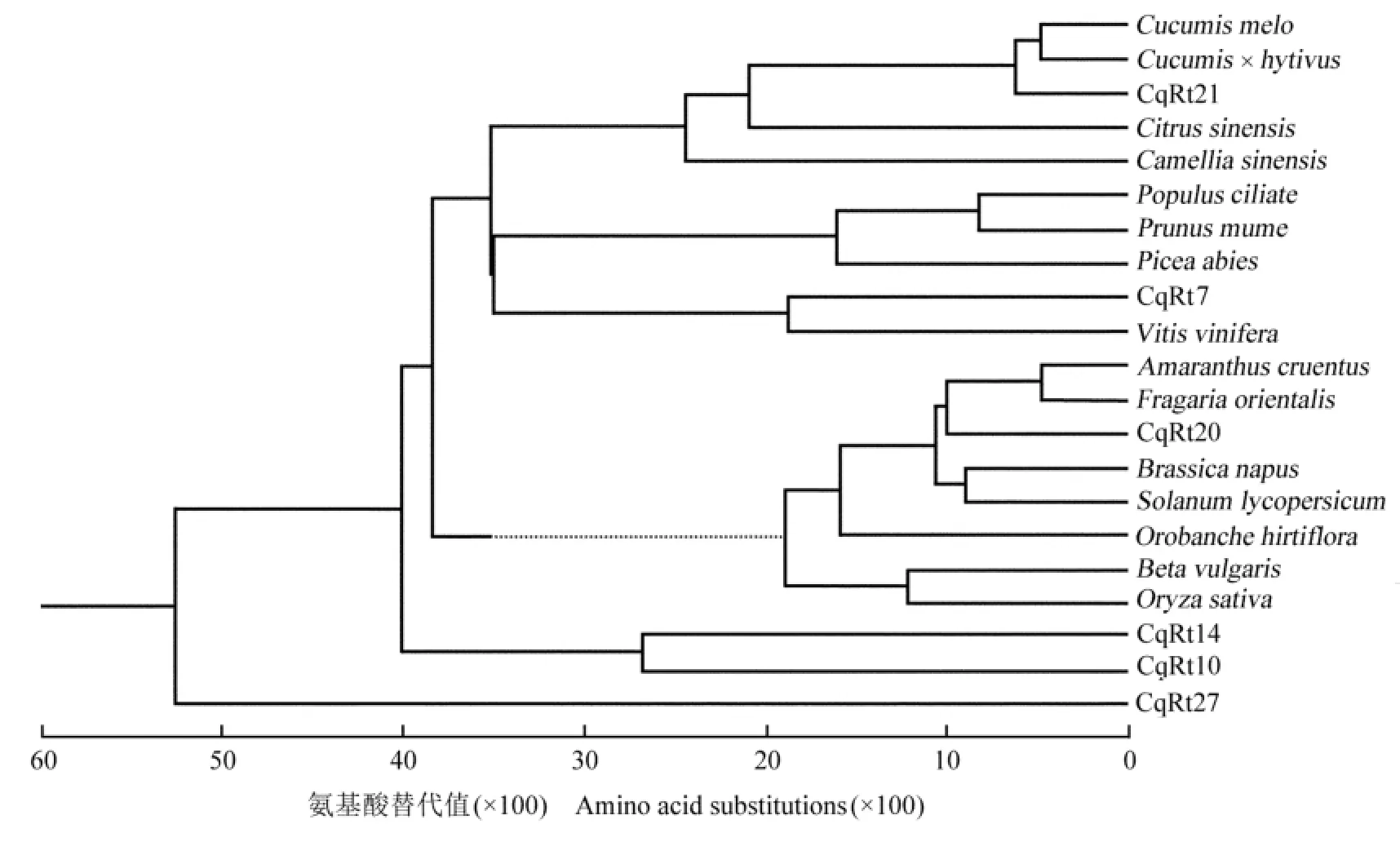
图4 节瓜与其他植物Ty1-copia类逆转座子逆转录酶氨基酸序列的系统进化树Fig.4 Phylogenetic tree of amino acid sequence of reverse transcriptase of Ty1-copia-like retrotransposon from Benincasa hispida var.chieh-qua How and other species
从29条节瓜Ty1-copia类逆转座子逆转录酶的每一个家族选取1~2个序列,结合GenBank上登录的部分植物的Ty1-copia类逆转座子逆转录酶基因的氨基酸序列,利用DNAStar软件构建进化树,结果见图4。结果表明:供试逆转录酶氨基酸序列在聚类图中分为6组,第1组包括CqRt21氨基酸序列以及甜瓜(Cucumis melo Linn.,CAJ65841)、Cucumis×hytivus J.F.Chen et J.H.Kirkbr.(ADQ85918)、甜橙〔Citrus sinensis(Linn.)Osbeck,CAJ41396〕和茶树〔Camellia sinensis(Linn.)O.Ktze.,CAJ09747〕的Ty1-copia类逆转座子逆转录酶基因的氨基酸序列;第2组包括Populus ciliate Wall.ex Royle(AAT73703)、梅(Prunus mume Sieb.et Zucc.,ACZ36925)和欧洲云杉〔Picea abies(Linn.)H.Karst.,CAA11919〕的Ty1-copia类逆转座子逆转录酶基因的氨基酸序列;第3组包括CqRt7氨基酸序列和葡萄(XP_002272586)的Ty1-copia类逆转座子逆转录酶基因的氨基酸序列;第4组包括CqRt20氨基酸序列以及Amaranthus cruentus Linn.(AAG44312)、东方草莓(Fragaria orientalis Lozinsk.,ADP88729)、欧洲油菜(Brassica napus Linn., AAA32987)、Solanum lycopersicum Linn.(AAC34606)、Orobanche hirtiflora(Reut.)Tzvelev(ABD19053)、甜菜(T14589)和水稻(T03662)的Ty1-copia类逆转座子逆转录酶基因的氨基酸序列;第5组包括CqRt14和CqRt10氨基酸序列,且与其他家族遗传距离较远; CqRt27氨基酸序列与其他植物的Ty1-copia类逆转座子逆转录酶氨基酸序列的亲缘关系最远,单独聚为1个分支,为第6组。
上述分析结果表明:不同植物种类的Ty1-copia类逆转座子逆转录酶基因的亲缘关系相近或起源于相同祖先,但有些逆转座子在不同种或属间的同源性高于种内或属内,因此植物基因组中的逆转座子不仅可以在物种世代间纵向传递,还可以在不同属的类群间或同属的不同种间横向传递。
3 讨论和结论
本研究首次对节瓜中的Ty1-copia类逆转座子逆转录酶基因序列进行PCR扩增,从8条节瓜品系中均扩增得到260 bp左右的目的片段,说明Ty1-copia类逆转座子在节瓜中广泛存在。获得的节瓜29条逆转录酶核苷酸序列长度变化范围是247~267 bp,小于枳的逆转录酶核苷酸序列长度(273 bp)[22];且29条Ty1-copia类逆转座子逆转录酶核苷酸序列长度相差20 bp,小于辣椒[25]和苹果[24]Ty1-copia类逆转座子逆转录酶核苷酸序列的长度变异,但大于黄瓜Ty1-copia类逆转座子逆转录酶核苷酸序列的长度变异[26];其中21条序列存在1~4个终止密码子突变, 12条序列存在移码突变。因此推测节瓜逆转座子高度异质性群体形成的主要原因是缺失突变、移码突变及终止密码子突变。逆转座子以自身携带的无校对功能的逆转录酶产生RNA中间产物进行增殖,碱基错配率较高;另外,长期进化过程中,生物体通过各种方式抑制逆转座子转座造成致死突变,而逆转座子在胁迫条件下不断转录与转座形成基因组的多样性与遗传变异[28-29],两者的相互作用使节瓜Ty1-copia类逆转座子这类古老元件在不断转座与世代传递过程中形成了高度异质性。
逆转座子广泛分布于植物基因组中,可在世代间纵向传递,也可在物种间横向传递[30-31],部分物种的逆转座子只能在种或属间检测出来,而有些逆转座子则可在多种物种间检测出来,因此成为研究物种在种或属间进化与分化的依据以及推测其起源及与物种间相互关系的重要工具[32]。前人研究表明,同一植物类群的逆转座子保守性较强,但序列变异较大,导致种内异质性差异有时高于种或属间的异质性差异[24]。本研究中,随机克隆的29条节瓜Ty1-copia类逆转座子逆转录酶序列中,CqRT16序列与CqRT28序列的同源率只有26.7%,而NCBI BLASTx同源搜索结果表明,节瓜与黄瓜、甜瓜、草莓、甜菜、水稻、葡萄等植物的Ty1-copia类逆转座子逆转录酶序列的相似性较高,其中CqRT21序列与黄瓜(ADQ85918)氨基酸序列的同源率高达90%,这也在一定程度上说明这些物种的Ty1-copia类逆转座子可能有相同起源,在一定程度上为研究节瓜的起源提供了依据。在系统进化树上,节瓜29条逆转录酶核苷酸序列可分为包含不同序列数量的5个家族,反映了各家族逆转座子的转录过程与历史地位可能存在差异,对节瓜基因组进化的作用也可能各异。
研究结果显示:节瓜Ty1-copia类逆转座子逆转录酶序列在节瓜不同品系中广泛存在,可为进一步分离Ty1-copia类逆转座子、研究其起源进化和转录活性特征及开发鉴评种质的分子标记奠定了基础。
[1] KUMAR A,BENNETZEN J L.Plant retrotransposons[J].Annual Review of Genetics,1999,33:479-532.
[2] FLAVELLA J,SMITH D B,KUMAR A.Extreme heterogeneity of Ty1-copia group retrotransposons in plants[J].Molecular and General Genetics,1992,231:233-242.
[3] TAM S M,MHIRI C,VOGELAAR A,et al.Comparative analyses of genetic diversities within tomato and pepper collections detected by retrotransposon-based SSAP,AFLP and SSR[J].Theoretical and Applied Genetics,2005,110:819-831.
[4] PEARCE S R,KUMAR A,FLAVELL A J.Activation of the Ty1-copia group retrotransposons of potato(Solatium tuberosum)during protoplast isolation[J].Plant Cell Reports,1996,15:949-953.
[5] ROGERS S A,PAULS K P.Ty1-copia-like retrotransposons of tomato(Lycopersicon esculentum Mill.)[J].Genome,2000,43: 887-894.
[6] ALIX K,RYDER C D,MOORE J,et al.The genomic organization of retrotransposons in Brassica oleracea[J].Plant Molecular Biology,
2005,59:839-851.
[7] KALENDAR R,TANSKANEN J,IMMONEN S,et al.Genome evolution of wild barley(Hordeum spontaneum)by BARE-1 retrotransposondynamicsinresponsetosharpmicroclimatic divergence[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97:6603-6607.
[8] ELLIS T H N,POYSER S J,KNOX M R,et al.Polymorphism of insertion sites of Ty1-copia class retrotransposons and its use for linkage and diversity analysis in pea[J].Molecular and General Genetics,1998,260:9-19.
[9] SANZ A M,GONZALEZ S G,SYED N H,et al.Genetic diversity analysis in Vicia species using retrotransposon-based SSAP markers [J].Molecular Genetics and Genomics,2007,278:433-441.
[10] PETIT M,LIM K Y,JULIO E,et al.Differential impact of retrotransposon populations on the genome of allotetraploid tobacco (Nicotiana tabacum)[J].Molecular Genetics and Genomics, 2007,278:1-15.
[11] 王利英,杜永臣,张 斌,等.茄子IRAP和REMAP分子标记的开发[J].园艺学报,2008,35(9):1363-1367.
[12] BERNET G P,ASINS M J.Identification and genomic distribution of gypsylikeretrotransposonsinCitrusandPoncirus[J]. Theoretical and Applied Genetics,2003,108:121-130.
[13] BRETÓM P,RUIZ C,PINA J A,et al.The diversification of Citrus clementina Hort.ex Tan.,a vegetatively propagated crop species[J].Molecular Phylogenetics and Evolution,2001,21: 285-293.
[14] RUIZ C,ASINS M J.Comparison between Poncirus and Citrus genetic linkage maps[J].Theoretical and Applied Genetics, 2003,106:826-836.
[15] ANTONIUS-KLEMOLA K,KALENDAR R,SCHULMAN A H. TRIM retrotransposons occur in apple and are polymorphic between varieties but not sports[J].Theoretical and Applied Genetics, 2006,112:999-1008.
[16] SUN H Y,DAI H Y,ZHAO G L,et al.Genome-wide characterization of long terminal repeat-retrotransposons in apple reveals the differences in heterogeneity and copy number between Ty1-copia and Ty3-gypsy retrotransposons[J].Journal of Integrative Plant Biology,2008,50:1130-1139.
[17] VENTURI S,DONDINI L,DONINI P,et al.Retrotransposon characterisation and fingerprinting of apple clones by S-SAP markers[J].Theoretical and Applied Genetics,2006,112:440-444.
[18] DU X Y,ZHANG Q L,LUO Z R.Development of retrotransposon primers and their utilization for germplasm identification in Diospyros spp.(Ebenaceae)[J].Tree Genetics and Genomes,2009,5: 235-245.
[19] GUO D L,ZHANG H Q,LUO Z R.Genetic relationships of Diospyros kaki Thunb.and related species revealed by IRAP and REMAP analysis[J].Plant Science,2006,170:528-533.
[20] 赵 芹,谢大森,罗少波,等.节瓜与枯萎病菌互作中抑制消减文库的构建及初步分析[J].园艺学报,2013,41(增刊): 2687.
[21] YAO J L,DONGY H,MORRIS B A T.Parthenocarpic apple fruit production conferred by transposon insertion mutations in a MADS-box transcription factor[J].Proceedings of the National Academy of Sciences of the United States of America,2001,98:1306-1311.
[22] TAO N G,WEI J,LIU Y Z,et al.Copia-like retrotransposons in a precocious mutant of trifoliate orange〔Poncirus trifoliata(L.) Raf.〕[J].The Journal of Horticultural Science and Biotechnology, 2006,81:1038-1042.
[23] STERGIOU G,KATSIOTIS A,HAGIDIMITRIOU M,et al.Genomic and chromosomal organization of Ty1-copia-like sequences in Olea europaea and evolutionary relationships of Olea retroelements [J].Theoretical and Applied Genetics,2002,104:926-933.
[24] 孙 俊,房经贵,高 兵,等.苹果中Ty1-copia型逆转座子逆转录酶序列的克隆及分析[J].果树学报,2005,22(3):193-197.
[25] 刁卫平,王述彬,刘金兵,等.辣椒Ty1-copia类逆转座子逆转录酶序列的克隆及分析[J].分子植物育种,2012,10(1): 55-61.
[26] 江 彪,娄群峰,刁卫平,等.黄瓜属Ty1-copia类逆转座子逆转录酶序列的克隆及分析[J].园艺学报,2008,35(8): 1147-1154.
[27] 张靖国,胡红菊,田 瑞,等.梨Ty1-copia类逆转座子逆转录酶序列的克隆及分析[J].湖北农业科学,2012,51(9): 4388-4390.
[28] STEINHAUER D A,HOLLAND J J.Direct method for quantitation of extreme polymerase error frequencies at selected single base sites in viral RNA[J].Journal of Virology,1986,57:219-228.
[29] 肖 栋,侯喜林,马景蕃,等.不结球白菜Ty1-copia类逆转座子序列的克隆及表达[J].西北植物学报,2009,29(4):643-649.
[30] DOOLITTLE R F,FENG D F,JOHNSON M S,et al.Origins and evolutionary relationship of retoviruses[J].The Quarterly Review of Biology,1989,64:1-30.
[31] KUMAR A.The evolution of plant retroviruses:moving to green pasture[J].Trends in Plant Science,1998,3:371-374.
[32] GRANDBASTIEN M A.Retroelements in higher plants[J].Trends in Genetics,1992,8:103-108.
(责任编辑:张明霞)
Cloning and alignment of sequence of reverse transcriptase of Ty1-copia-like retrotransposon from
Benincasa hispida var.chieh-qua ZHAO Qin①,②,XIE Dasen①,JIANG Biao,LUO Shaobo,PENG Qingwu,LI Mingzhu(Vegetable Research Institute,Guangdong Academy of Agricultural Sciences, Guangzhou 510640,China),J.Plant Resour.&Environ.2014,23(4):17-26
Nucleotide sequence of reverse transcriptase of Ty1-copia-like retrotransposon in genomic DNA from eight lines of Benincasa hispida var.chieh-qua How was amplified,system evolution and homology of nucleotide sequence and translated amino acid sequence of 29 cloning products obtained from line A39FA were analyzed,and 29 amino acid sequences were aligned.The amplification results show that genomic DNA from eight lines of B.hispida var.chieh-qua all includes reverse transcriptase nucleotide fragment with length about 260 bp.Length of 29 nucleotide sequences(from CqRt1 to CqRt29)of reverse transcriptase of Ty1-copia-like retrotransposon obtained from line A39FA is 247-267 bp with homologous rate of 46.2%-98.1%,while homologous rate of their amino acid sequences is 26.7%-98.8%.The sequence analysis results show that number of base A,T,G and C in nucleotide sequence of reverse transcriptase of Ty1-copia-like retrotransposon from B.hispida var.chieh-qua is 65-96,47-92,45-74 and 32-49,respectively.All sequences are rich in base A and T,and AT/GC ratio is 1.35-2.33.Deletion mutation is the main reason inducing differences in length of nucleotide sequence of reverse transcriptase of Ty1-copia-like retrotransposon from B.hispida var.chieh-qua,and obvious differences in sequence length and base composition indicate that there is high heterogeneity in nucleotide sequence of reverse transcriptase of Ty1-copia-like retrotransposon from B.hispida var.chieh-qua.There is stop codon mutation in 21 sequences and frame shift mutation in 12 sequences from translated amino acid sequence,which indicates that Ty1-copia-like retrotransposon is the hot spot in sequence recombination within B.hispida var.chieh-qua genome.29 nucleotide sequences of reverse transcriptase can be divided into 5 families,containing 16,4,4,4 and 1 sequences,respectively.Family 1 might be a retrotransposon family with transposition activity,while number of reverse transcriptase sequence with transposition activity only accounts for 20.69%of total number of sequences.The alignment result on 1-2 amino acid sequences in each family of Ty1-copia-like retrotransposons from B.hispida var.chiehqua and that of other 15 species shows higher homology.It is indicated that B.hispida var.chieh-qua and other species may possess the same origin,and Ty1-copia-like retrotransposon can be horizontally transferred among different taxa.
Benincasa hispida var.chieh-qua How;Ty1-copia-like retrotransposon;reverse transcriptase;sequence analysis;homology;system evolution
Q785;S542.9
A
1674-7895(2014)04-0017-10
10.3969/j.issn.1674-7895.2014.04.03
2013-12-19
国家自然科学基金资助项目(31311643);广州市珠江科技新星专项资助项目(2013086)
赵 芹(1982—),女,山东泰安人,博士,副研究员,主要从事蔬菜病理学与抗病育种方面的研究。谢大森(1970—),男,江西遂川人,博士,研究员,主要从事瓜类抗病育种及生物技术方面的研究。
①并列第一作者
②通信作者E-mail:zhaoqin0802@126.com
