茶树CsDREB-A1转录因子基因的克隆及其特性分析
2014-05-11刘志薇吴致君黎星辉
刘志薇,吴致君,黎星辉,李 彤,庄 静
(南京农业大学园艺学院茶叶科学研究所,江苏南京210095)
茶树CsDREB-A1转录因子基因的克隆及其特性分析
刘志薇,吴致君,黎星辉,李 彤,庄 静①
(南京农业大学园艺学院茶叶科学研究所,江苏南京210095)
基于茶树品种‘迎霜’(Camellia sinensis‘Yingshuang’)的转录组数据,采用PCR方法从其基因组DNA中克隆获得编码DREB转录因子的CsDREB-A1基因。结果显示:该基因的开放阅读框(ORF)长度为585 bp,编码194个氨基酸,该氨基酸序列即为CsDREB-A1转录因子。CsDREB-A1转录因子的N端含有AP2/ERF家族转录因子典型的AP2 DNA保守结合结构域,其中包含保守的YRG元件和WLG基序,且其第14位和第19位分别为缬氨酸和谷氨酸,该结构域的上、下游分别有PKK/RPAGRxKFxETRHP和DSAW特征序列。通过进化分析可知CsDREBA1转录因子属于AP2/ERF家族中DREB亚族的A1组,其与茶树CBF转录因子的相似性较高,与拟南芥〔Arabidopsis thaliana(Linn.)Heynh.〕等植物的DREB类转录因子也有较高的相似性。CsDREB-A1转录因子为亲水性蛋白,理论相对分子质量为21 165.4,理论等电点为pI 9.56,碱性、酸性、芳香族和脂肪族氨基酸比例分别为18%、10%、6%和18%;该转录因子只有1个包含53个氨基酸的无序化区域,且大部分无序化氨基酸位于AP2 DNA保守结合结构域内,无序化氨基酸的比例为27.32%;在CsDREB-A1转录因子的三级结构中,N端有1个α螺旋、C端有3个β折叠。研究结果显示:CsDREB-A1转录因子可能与茶树的抗寒性相关。
茶树;CsDREB-A1基因;转录因子;抗寒性
茶树〔Camellia sinensis(Linn.)O.Ktze.〕为山茶科(Theaceae)山茶属(Camellia Linn.)多年生常绿木本植物,起源于中国西南部,栽培历史悠久[1]。作为著名的保健饮品,茶与咖啡、可可并称为当今世界三大无酒精饮料,因而茶树具有重要的应用和研究价值。然而,目前关于茶树抗逆机制的研究仍处于初级阶段,尤其是利用分子生物学技术克隆和研究相关抗逆基因的研究报道相对较少,并且主要集中于功能酶和抗病虫害相关基因的研究[2-4]。目前,低温胁迫仍是茶叶质量和产量的主要限制因素之一,因而,研究者们对一些与茶树抗寒性相关的ICE1[5]、RAV[6-7]、ERF[8-9]等转录因子的基因进行了克隆及初步的功能分析。通过研究茶树逆境调控转录因子的结构与功能,可以明确转录因子之间及其与DNA之间相互作用的机制,为调控转录因子基因的表达以及控制受转录因子调节的一系列功能基因提供研究基础,并对深入了解茶树的逆境调控机制以及实现茶树抗寒性改良有重要意义。
DREB(dehydration-responsiveelementbinding factors)类转录因子是AP2/ERF转录因子家族的1个亚族,分成A1、A2、A3、A4、A5和A6共6个组[10-11],其DNA结合域包含能够特异结合DRE/CRT顺式作用元件的核心序列。在植物低温应答反应的非依赖ABA途径中,DRE/CRT和CBF1(CRT/DRE-binding factor 1)是重要的作用元件,具有感受上游信号并将外界低温信号向下游传递、激活冷驯化反应各组成因子的作用[12]。编码DREB蛋白的CBF1[13]、DREB1A和DREB2A[14]基因首先分离自拟南芥〔Arabidopsis thaliana(Linn.)Heynh.〕cDNA文库,迄今为止,已从诸多植物中克隆得到大量DREB类转录因子[15-19],并且已经证实其主要受低温、干旱和高盐等逆境的诱导表达,少数受ABA的诱导表达。目前,DREB类转录因子基因的克隆及应用已成为植物抗逆分子生物学研究的热点之一。在茶树的抗逆性研究中有关DREB类转录因子的研究尚不多见,仅推测DREB类转录因子可能参与茶树的抗寒过程[20-21],但具体作用机制仍不清楚。
鉴于此,作者采用PCR方法从茶树品种‘迎霜’(‘Yingshuang’)基因组DNA中克隆得到编码茶树DREB转录因子的基因,并对该基因编码的氨基酸序列及其保守域、进化关系和分子结构模型等方面进行详细分析,以期为深入研究DREB类转录因子在茶树逆境调控机制中的作用及茶树抗寒品种的选育奠定研究基础。
1 材料和方法
1.1 材料
供试对象为南京农业大学园艺学院茶叶科学研究所种植的茶树品种‘迎霜’,取2年生无病虫害扦插苗的幼嫩叶片提取基因组DNA。
大肠杆菌菌株DH5α为本实验室保存;pMD18-T载体、Ex Taq DNA聚合酶、Prime Script RT reagent Kit反转录试剂盒、10×Ex Taq buffer(Mg2+free)、dNTPs mixture、MgCl2、DL2000 DNA marker和DNA回收试剂盒等均购自宝生物工程(大连)有限公司;Quick RNA Isolation Kit总RNA提取试剂盒购自华越洋生物科技有限公司。引物合成和DNA测序均由南京金斯瑞生物科技有限公司完成。
1.2 方法
1.2.1 DNA提取方法 参照文献[22]采用CTAB法提取基因组DNA。
1.2.2 扩增引物的序列设计及合成 以拟南芥AtDREB1A基因(GenBank登录号AT4G25480.1)为序列探针,对本实验室保存的茶树品种‘迎霜’的转录组数据库进行搜索,得到相关序列片段;通过拼接获得茶树DREB转录因子的基因序列,并据此设计1对引物ZJR76和ZJR77,用于茶树CsDREB-A1基因的克隆。引物ZJR76和ZJR77的序列分别为5′-ATGTGT TCTCACTTTTCTGAC-3′和5′-TCAATGTAAAATATTT TCTCC-3′。
1.2.3 茶树CsDREB-A1基因的克隆 以上述基因组DNA为模板、采用引物ZJR76和ZJR77进行PCR扩增反应。反应体系总体积20 μL,包括10×Ex Taq buffer(Mg2+free)2 μL、2.5 mmol·L-1dNTPs mixture 1.6 μL、基因组DNA 1 μL、25 mmol·L-1MgCl21.2 μL、5 U·μL-1Ex Taq DNA聚合酶0.3 μL、引物各1 μL和重蒸水11.9 μL。扩增程序为:94℃预变性5 min;94℃变性30 s、52℃退火30 s、72℃延伸1 min,共35个循环;最后于72℃延伸10 min。PCR产物用12 g·L-1琼脂糖凝胶电泳分离,用DNA回收试剂盒回收并纯化,然后连接到pMD18-T载体上,并转化到大肠杆菌DH5α中;以DH5α单菌落菌液为模板、按照上述反应体系和扩增程序进行PCR扩增,电泳检测PCR产物。选择产生单一明亮条带的菌液进行测序。
1.3 生物信息学分析
利用NCBI网站(http:∥www.ncbi.nlm.nih. gov/)上的相关程序对获得的核苷酸和氨基酸序列进行BLAST比较和保守域预测。利用DNAMAN 6.0软件进行氨基酸序列疏水性和亲水性分析,并将获得的氨基酸序列与拟南芥等植物的DREB-A1类转录因子的氨基酸序列进行多重比对。使用在线工具包SMS (http:∥www.bio-soft.net/sms/)和ExPASy-ProtParam (http:∥web.expasy.org/protparam/)完成氨基酸序列组成和理化性质分析;采用MEGA 5.0软件[23]构建系统进化树;利用FoldIndex程序[24]完成蛋白质无序化特性分析;利用Swiss-Model[25]软件建立蛋白质三级结构模型,并采用Swiss-Pdb Viewer软件作图。

图1 茶树CsDREB-A1基因的核苷酸序列及其编码的氨基酸序列Fig.1 Nucleotide acid sequence of CsDREB-A1 gene from Camellia sinensis(Linn.)O.Ktze.and its encoded amino acid sequence
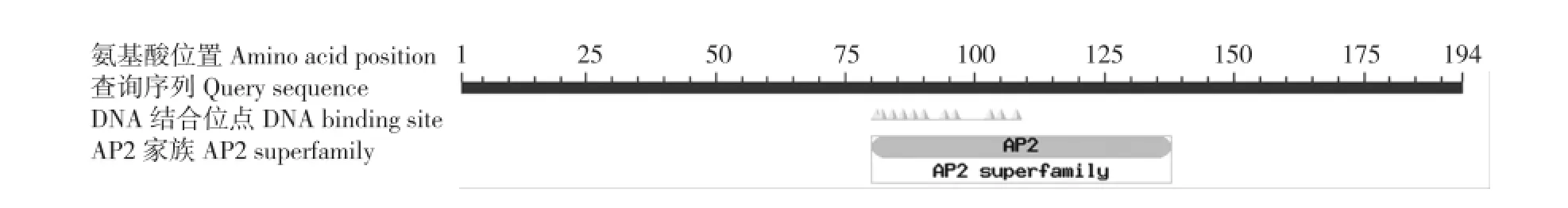
图2 茶树CsDREB-A1转录因子的保守域预测Fig.2 Prediction of conserved domain of CsDREB-A1 transcription factor from Camellia sinensis(Linn.)O.Ktze.
2 结果和分析
2.1 茶树CsDREB-A1基因的序列分析
以茶树品种‘迎霜’叶片的基因组DNA为模板、采用引物ZJR76和ZJR77扩增获得1条长约600 bp的CsDREB-A1基因片段。序列分析结果(图1)表明:该基因片段含有1个长度为585 bp的开放阅读框(ORF,open reading frame),共编码194个氨基酸,此氨基酸序列即为茶树CsDREB-A1类转录因子。
2.2 茶树CsDREB-A1转录因子与其他植物相关氨基酸序列的进化和序列比对分析
对茶树CsDREB-A1转录因子的保守域预测结果(图2)显示:第80位至第110位的氨基酸序列含有1个AP2 DNA保守结合结构域,表明该转录因子属于AP2/ERF家族。
为了进一步分析该转录因子与AP2/ERF家族相关转录因子之间的进化关系,选取拟南芥AP2/ERF家族转录因子与茶树CsDREB-A1转录因子构建同源进化树(图3),结果表明:茶树CsDREB-A1转录因子属于AP2/ERF家族转录因子中DREB亚族的A1组。
对茶树CsDREB-A1转录因子的氨基酸序列进行BLAST同源检索与比对,得到与其相似度较高的多种植物DREB类转录因子的氨基酸序列。多重比对结果(图4)显示:茶树CsDREB-A1转录因子与拟南芥、毛果杨(Populus trichocarpa Torr.et Gray)、粗柠檬(Citrus jambhiri Lush.)、Malus domestica Borkh.、沙梨〔Pyrus pyrifolia(Burm.f.)Nakai〕、烟草(Nicotiana tabacum Linn.)、马铃薯(Solanum tuberosum Linn.)、蒺藜苜蓿(Medicago truncatula Garetn.)、大豆〔Glycine max(Linn.)Merr.〕、蓖麻(Ricinus communis Linn.)、棉花(Gossypium hirsutum Linn.)和辣椒(Capsicum annuum Linn.)等种类的DREB类转录因子间具有较高的相似性。茶树CsDREB-A1转录因子的N端具有AP2/ERF家族转录因子典型的AP2 DNA保守结合结构域,并含有保守的YRG元件和WLG基序;该保守结合结构域的第14位和第19位氨基酸分别为缬氨酸(V)和谷氨酸(E)。此外,在该保守结合结构域的上游有PKK/RPAGRxKFxETRHP特征序列,其下游有DSAW特征序列。

图3 茶树CsDREB-A1转录因子与拟南芥AP2/ERF家族转录因子的进化分析Fig.3 Phylogenetic analysis on transcription factors of CsDREB-A1 from Camellia sinensis(Linn.)O.Ktze.and AP2/ERF family from Arabidopsis thaliana(Linn.)Heynh.
2.3 茶树CsDREB-A1转录因子与其他植物相关氨基酸序列的组成及理化性质分析
借助在线工具包SMS和ExPASy-ProtParam分析出的茶树CsDREB-A1转录因子与其他植物DREB类转录因子的氨基酸序列组成及理化性质,结果见表1。结果表明:这些植物的DREB类转录因子氨基酸数量为190~270,理论相对分子质量为20 000~29 000;理论等电点差异较大,茶树CsDREB-A1转录因子的理论等电点最大,达到pI 9.56,其他种类的DREB类转录因子的理论等电点为pI 5~pI 8。各转录因子的碱性和酸性氨基酸比例分别为12%~18%和10%~17%,芳香族和脂肪族氨基酸比例分别为6%~10%和13%~18%,脂肪族氨基酸比例明显高于芳香族氨基酸。总体来说,在亲缘关系相近的种类间,DREB类转录因子的碱性氨基酸、酸性氨基酸、芳香族氨基酸和脂肪族氨基酸的比例差异均较小。
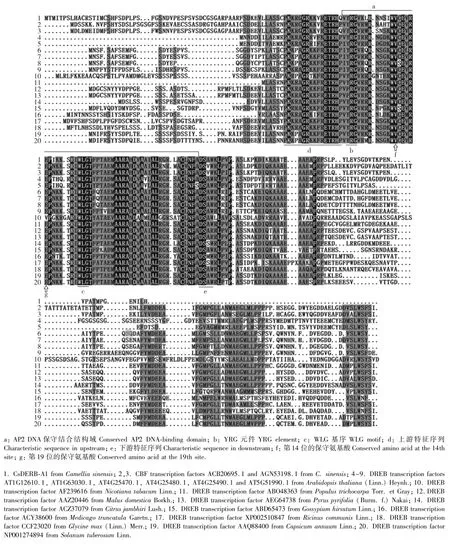
图4 茶树CsDERB-A1转录因子与其CBF转录因子和其他植物DERB类转录因子的氨基酸序列多重比对结果Fig.4 Multiple alignment result of amino acid sequences of CsDERB-A1 transcription factor from Camellia sinensis(Linn.)O.Ktze.with its CBF transcription factor and DERB transcription factors from other species
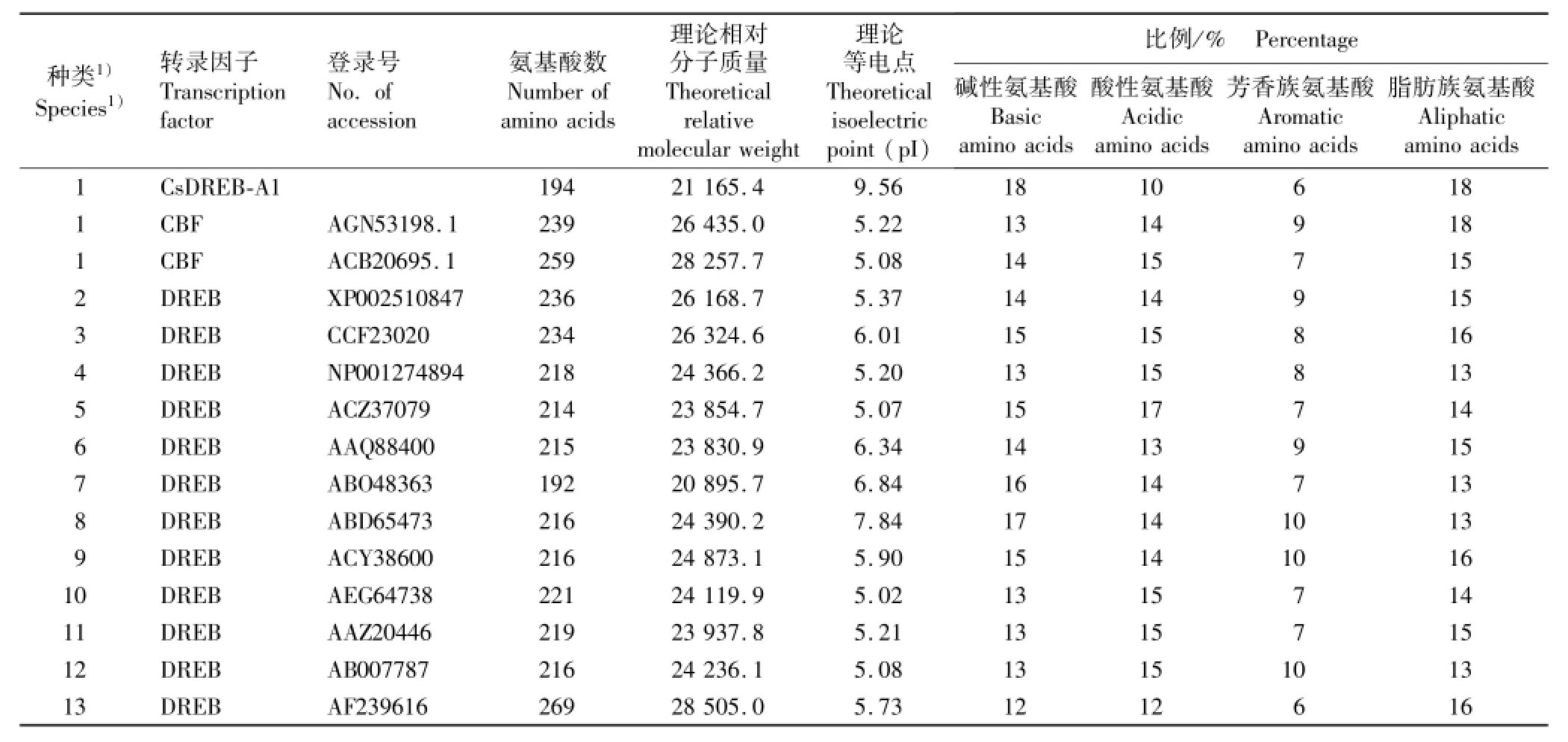
表1 茶树CsDERB-A1转录因子与其他植物DREB类转录因子的氨基酸序列组成及理化性质Table1 Composition and physicochemical property of amino acid sequence of CsDERB-A1 transcription factor from Camellia sinensis(Linn.) O.Ktze.and DREB transcription factors from other species

图5 茶树CsDREB-A1转录因子氨基酸序列的疏水性及亲水性Fig.5 Hydrophobicity and hydrophilicity of amino acid sequence of CsDREB-A1 transcription factor from Camellia sinensis(Linn.)O.Ktze.
由茶树CsDREB-A1转录因子氨基酸序列的疏水性和亲水性分析结果(图5)可见:该转录因子疏水性最强的位点是第123位的丙氨酸(Ala),其次是第58位的亮氨酸(Leu);亲水性最强的位点是第71位的赖氨酸(Lys),其次是第66位的精氨酸(Arg)、第67位的甘氨酸(Gly)和第68位的甘氨酸(Gly)。总体来看,茶树CsDREB-A1转录因子的大部分氨基酸属于亲水性氨基酸,据此认为茶树CsDREB-A1转录因子属于亲水性蛋白。
2.4 茶树CsDREB-A1转录因子的无序化分析
对茶树CsDREB-A1转录因子折叠状态的无序化分析结果见图6。由图6可以看出:茶树CsDREB-A1转录因子的整个氨基酸序列中只有1个无序化区域,该无序化区域包含53个氨基酸,无序化氨基酸比例为27.32%;总体而言,茶树CsDREB-A1转录因子的无序化程度并不明显。无序化分析结果还显示:茶树CsDREB-A1转录因子的无序化氨基酸位于第45位至第97位,且大部分无序化氨基酸位于AP2 DNA保守结合结构域内。
2.5 茶树CsDREB-A1转录因子的三级结构分析
以拟南芥AtERF1(PDB ID:1gcc)为模型[26]、采用Swiss-Model软件对茶树CsDREB-A1转录因子进行蛋白质三级结构建模分析,具体结构见图7。茶树CsDREB-A1转录因子的AP2 DNA保守结合结构域与AtERF1相似,均在N端有1个α螺旋,在C端有3个反向平行的β折叠,分别为β折叠1、β折叠2和β折叠3(图7-A);此外,在图7中还可以清楚地看到茶树CsDREB-A1转录因子AP2 DNA保守结合结构域中的WLG基序(图7-B)。
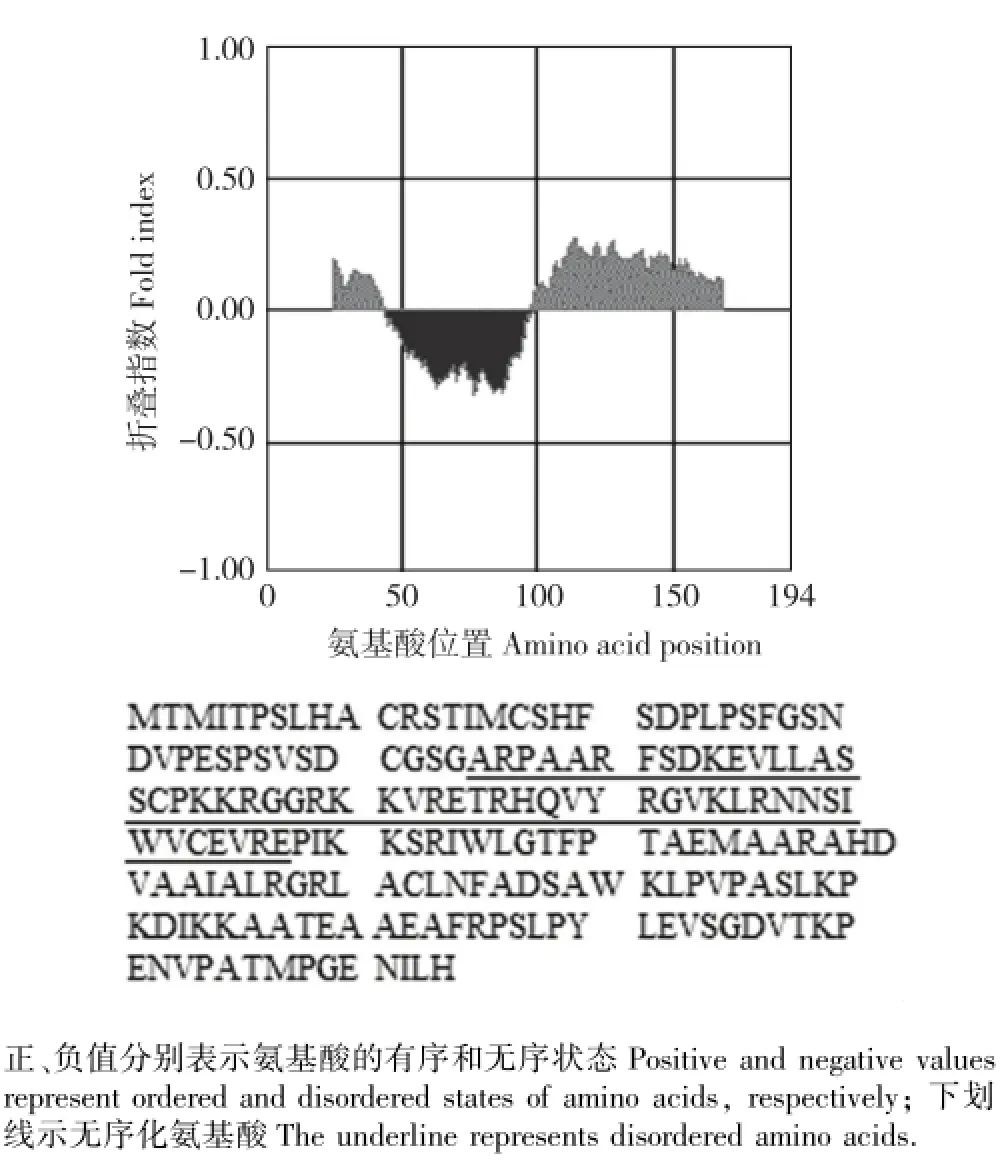
图6 茶树CsDREB-A1转录因子折叠状态的无序化分析Fig.6 Disorder analysis of folding state of CsDREB-A1 transcription factor from Camellia sinensis(Linn.)O.Ktze.
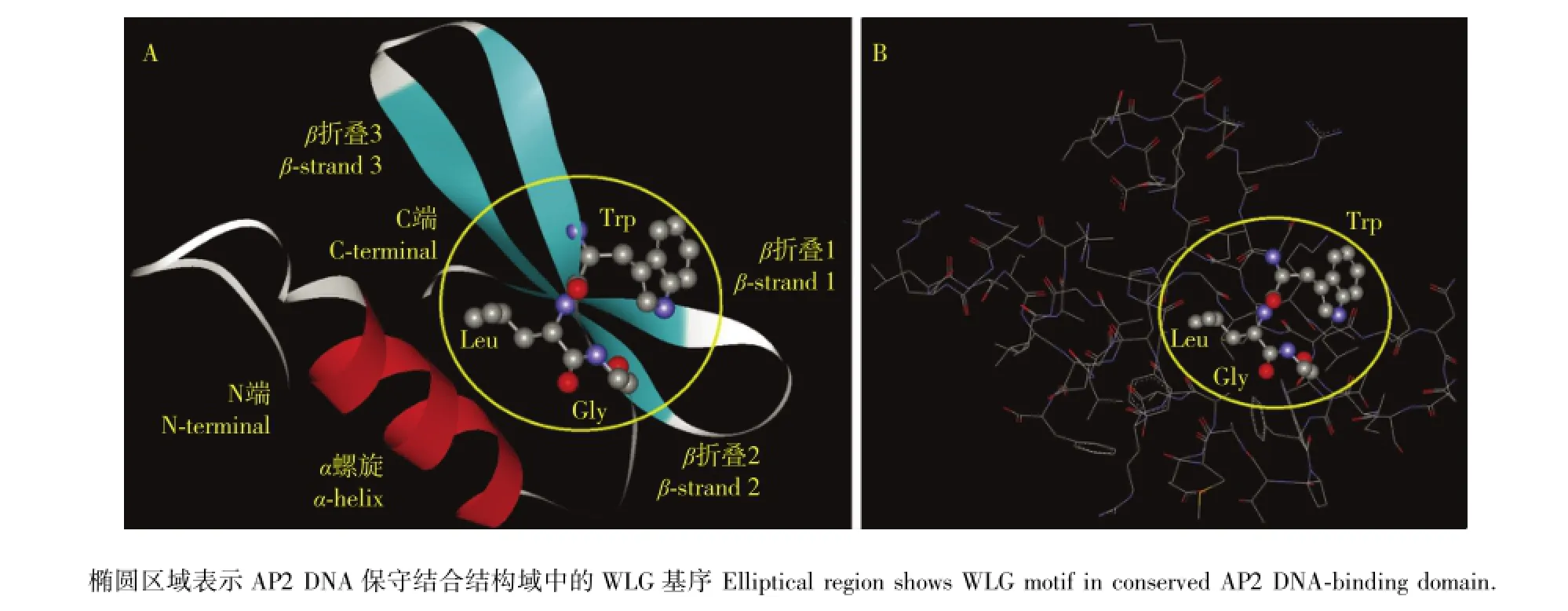
图7 茶树CsDREB-A1转录因子的三级结构Fig.7 Tertiary structure of CsDREB-A1 transcription factor from Camellia sinensis(Linn.)O.Ktze.
3 讨论和结论
上述研究结果表明:茶树CsDREB-A1转录因子属于AP2/ERF转录因子家族中DREB亚族的A1组,与茶树的另外2个CBF转录因子(GenBank登录号分别为AGN53198.1和ACB20695.1)具有较高的同源性,并且与多种亲缘关系相近的植物的DREB类转录因子的相似性较高,相似度均在70%以上。
茶树CsDREB-A1转录因子折叠状态的无序化分析结果显示:其无序化氨基酸比例仅27.32%,可能与其亲水性氨基酸比例不高有关[24]。此外,CsDREBA1转录因子氨基酸序列的无序化区域与AP2 DNA保守结合结构域有交叉。由于氨基酸序列的无序化与氨基酸种类有较大关联[27],且AP2 DNA保守结合结构域是经过与多种植物的AP2转录因子的氨基酸序列进行同源比对之后确定的保守区间,因此,推测二者之间可能存在某种关联性,具体关联有待进一步研究。
茶树CsDREB-A1转录因子的AP2 DNA保守结合结构域含有典型的保守的YRG元件和WLG基序,该保守结合结构域第14位和第19位分别为缬氨酸和谷氨酸,这2个氨基酸是与DRE作用元件相结合的关键位点[10];同时,AP2 DNA保守结合结构域的上游有PKK/RPAGRxKFxETRHP特征序列,其下游有DSAW特征序列,这2段多肽序列只存在于与低温胁迫相关的CBF1/DREB1B、CBF2/DREB1C和CBF3/ DREB1A转录因子中,被称为CBF蛋白特征序列[28]。由此推测,茶树CsDREB-A1转录因子属于上述3类CBF转录因子的成员之一。目前,通过转基因技术已经在多种植物[29-35]中证实CBF转录因子的过表达可明显提高植株的抗寒能力,并已经广泛应用于植物抗寒植株的培育。
对茶树CsDREB-A1基因的分离结果表明茶树中确实存在有DREB调控途径,序列鉴定和分析结果也在一定程度上证明茶树CsDREB-A1转录因子参与茶树应答低温的过程,这一结果对茶树抗寒性的分子调控机制研究和茶树基因工程都具有一定的意义。然而,由于茶树DREB类转录因子存在多样性,且低温胁迫应答过程中DREB类转录因子介导多个基因表达形成复杂的调控网络,因此,以上基于生物信息学进行的茶树CsDREB-A1转录因子功能的预测结果有待进一步的实验验证;关于茶树CsDREB-A1转录因子逆境调控的具体作用机制也需要经过大量的研究加以证实。
[1] 童启庆.茶树栽培学[M].3版.北京:中国农业出版社,2007: 4-33.
[2] 陆建良,林 晨,骆颖颖,等.茶树重要功能基因克隆研究进展[J].茶叶科学,2007,27(2):95-103.
[3] 韦朝领,李叶云,江昌俊.茶树逆境生理及其分子生物学研究进展[J].安徽农业大学学报,2009,36(3):335-339.
[4] 程国山,游新才,武 艳,等.低温胁迫后抗寒茶树品种‘紫阳圆叶’的基因差异表达分析[J].植物资源与环境学报,2013, 22(4):38-43.
[5] 时 慧,王 玉,杨路成,等.茶树抗寒调控转录因子ICE1密码子偏性分析[J].园艺学报,2012,39(7):1341-1352.
[6] 陈林波,李叶云,王 琴,等.茶树冷诱导基因RAV的克隆与表达特性分析[J].植物生理学通讯,2010,46(4):354-358.
[7] 吴致君,黎星辉,房婉萍,等.茶树CsRAV2转录因子基因的克隆与表达特性分析[J].茶叶科学,2014,34(3):297-306.
[8] 陈林波,房 超,王 郁,等.茶树抗逆相关基因ERF的克隆与表达特性分析[J].茶叶科学,2011,31(1):53-58.
[9] 吴致君,卢 莉,黎星辉,等.茶树AP2/ERF-B3类转录因子基因的克隆与表达特性分析[J].南京农业大学学报,2014,37 (4):67-75.
[10] SAKUMA Y,LIU Q,DUBOUZET J G,et al.DNA-binding specificity oftheERF/AP2domainofArabidopsisDREBs, transcription factorsCinvolved in dehydration-and cold-inducible gene expression[J].BiochemicalandBiophysicalResearch Communications,2002,290(3):998-1009.
[11] ZHUANG J,CAI B,PENG R H,et al.Genome-wide analysis of the AP2/ERF gene family in Populus trichocarpa[J].Biochemical and Biophysical Research Communications,2008,371(3):468-474.
[12] 王 洋,胡 喆,王崇英.拟南芥CBF/DREB途径的研究进展及其在植物基因工程中的应用[J].生物物理学报,2007,23 (2):101-108.
[13] STOCKINGER E J,GILMOUR S J,THOMASHOW M F. Arabidopsis thaliana CBF1 encodes an AP2 domain-containing transcriptional activator that binds to the C-repeat/DRE,a cisacting temperature:differences and crosstalk between two stress signaling pathways[J].Current Opinion Plant Biology,1997,3 (3):217-223.
[14] LIU Q,KASUGA M,SAKUMA Y,et al.Two transcription factors,DREB1 and DREB2,with an EREBP/AP2 DNA binding domain separate two cellular signal transduction pathways in drought-and low-temperature-responsive gene expression,respectively,in Arabidopsis[J].Plant Cell,1998,10(8):1391-1406.
[15] QIN Q L,LIU J G,ZHANG Z,et al.Isolation,optimization,and functional analysis of the cDNA encoding transcription factor RdreB1 in Oryza sativa L.[J].Molecular Breeding,2007,19(4): 329-340.
[16] SHEN Y G,ZHANG W K,HE S J,et al.An EREBP/AP2-type protein in Triticum aestivum was a DRE-binding transcription factor induced by cold,dehydration and ABA stress[J].Theoretical and Applied Genetics,2003,106(5):923-930.
[17] QIN F,LI J,ZHANG G Y,et al.Isolation and structural analysisof DRE-binding transcription factor from maize(Zea mays L.)[J]. Acta Botanica Sinica,2003,45(3):331-339.
[18] ZHOU J M,TANG X Y,MARTIN G B.The Pto kinase conferring resistance to tomato bacterial speck disease interacts with proteins that bind a cis-element of pathogenesis-related genes[J].The EMBO Journal,1997,16(11):3207-3218.
[19] LEUBNER-METZGER G,PETRUZZELLI L,WALDVOGEL R,et al.Ethylene-responsive element binding protein EREBP expression and the transcriptional regulation of class β-1,3-glucanase during tobacco seed germination[J].Plant Molecular Biology,1998,38 (5):785-795.
[20] 陈 暄,房婉萍,邹中伟,等.茶树冷胁迫诱导抗寒基因CBF的克隆与表达分析[J].茶叶科学,2009,29(1):53-59.
[21] 郭秀丽,王 玉,杨路成,等.茶树CBF1基因密码子使用特性分析[J].遗传,2012,34(12):1614-1623.
[22] RICHARDS E,REICHARDT M,ROGERS S.Preparation of plant DNA using CTAB[M]∥AUSUBEL J A,BRENT R,KINGSTON R E,et al.Current Protocols in Molecular Biology.Boston:Wiley, 1998:233-237.
[23] TAMURA K,PETERSON D,PETERSON N,et al.MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance,and maximum parsimony methods[J]. Molecular Biology and Evolution,2011,28(10):2731-2739.
[24] PRILUSKY J,FELDER C E,ZEEV-BEN-MORDEHAI T,et al. Foldlndex:a simple tool to predict whether a given protein sequence is intrinsically unfolded[J].Bioinformatics,2005,21(16): 3435-3438.
[25] SCHWEDE T,KOPP J,GUEX N,et al.SWISS-MODEL:an automated protein homology-modeling server[J].Nucleic Acids Research,2003,31(13):3381-3385.
[26] ALLEN M D,YAMASAKI K,OHME-TAKAGI M,et al.A novel mode of DNA recognition by a beta-sheet revealed by the solution structure of the GCC-box binding domain in complex with DNA[J]. The EMBO Journal,1998,17(18):5484-5496.
[27] 田 攀,连继勤.无序蛋白[J].生命的化学,2009,29(2): 279-281.
[28] RIECHMANN J L,MEYEROWITZ E M.The AP2/EREBP family of plant transcription factors[J].Biological Chemistry,1998,379 (6):633-646.
[29] JAGLO-OTTOSEN K R,GILMOUR S J,ZARKA D G,et al. Arabidopsis CBF1 overexpression induces COR genes and enhances freezing tolerance[J].Science,1998,280:104-106.
[30] XIONG Y W,FEI S Z.Functional and phylogenetic analysis of a DREB/CBF-like gene in perennial ryegrass(Lolium perenne L.) [J].Planta,2006,224(4):878-888.
[31] LI D F,ZHANG Y Q,HU X N,et al.Transcriptional profiling of Medicago truncatula under salt stress identified a novel CBF transcription factor MtCBF4 that plays an important role in abiotic stress responses[J].BMC Plant Biology,2011,11:109.
[32] TONG Z,HONG B,YANG Y,et al.Overexpression of two chrysanthemum DgDREB1 group genes causing delayed flowering or dwarfism in Arabidopsis[J].Plant Molecular Biology,2009,71 (1/2):115-129.
[33] GILMOUR S J,ZARKA D G,STOCKINGER E J,et al.Low temperature regulation of the Arabidopsis CBF family of AP2 transcriptional activators as an early step in cold-induced COR gene expression[J].The Plant Journal:for Cell and Molecular Biology, 1998,16(4):433-442.
[34] GUTHA L R,REDDY A R.Rice DREB1B promoter shows distinct stress-specific responses,and the overexpression of cDNA in tobacco confers improved abiotic and biotic stress tolerance[J]. Plant Molecular Biology,2008,68(6):533-555.
[35] QIN F,SAKUMA Y,LI J,et al.Cloning and functional analysis of a novel DREB1/CBF transcription factor involved in cold-responsive gene expression in Zea mays L.[J].Plant Cell Physiology,2004, 45(8):1042-1052.
(责任编辑:佟金凤)
Gene cloning of CsDREB-A1 transcription factor from Camellia sinensis and its characteristic
analysis LIU Zhiwei,WU Zhijun,LI Xinghui,LI Tong,ZHUANG Jing①(Tea Research Institute, College of Horticulture,Nanjing Agricultural University,Nanjing 210095,China),J.Plant Resour.& Environ.2014,23(4):8-16
On the basis of transcriptome data of Camellia sinensis‘Yingshuang’,CsDREB-A1 gene encoding DREB transcription factor was cloned from its genomic DNA by PCR method.The results show that length of open reading frame(ORF)of this gene is 585 bp,which encodes 194 amino acids,this amino acid sequence is CsDREB-A1 transcription factor.The N-terminal of CsDREB-A1 transcription factor contains the typical conserved AP2 DNA-binding domain of AP2/ERF family transcription factors, in which contains conserved YRG element and WLG motif,and there are valine and glutamic acid at its 14th and 19th sites,respectively.And there are PKK/RPAGRxKFxETRHP and DSAW characteristic sequences in upstream and downstream of the binding domain,respectively.According to phylogenetic analysis,it is known that CsDREB-A1 transcription factor belongs to A1 group of DREB subfamily in AP2/ERF family.And CsDREB-A1 transcription factor has high similarity to CBF transcription factor from C.sinensis,and also has high similarity to DREB transcription factor from Arabidopsis thaliana (Linn.)Heynh.,etc.CsDREB-A1 transcription factor is hydrophilic protein,its theoretical relative molecular weight is 21 165.4,theoretical isoelectric point is pI 9.56,percentage of basic,acidic, aromatic and aliphatic amino acids is 18%,10%,6%and 18%,respectively.This transcription factor only has one disordered region containing 53 amino acids,and most of disordered amino acids are locatedin conserved AP2 DNA-binding domain and percentage of disordered amino acids is 27.32%.In tertiary structure of CsDREB-A1 transcription factor,its N-terminal contains one α-helix and its C-terminal contains three β-strands.It is suggested that CsDREB-A1 transcription factor is probably related to cold resistance of C.sinensis.
Camellia sinensis(Linn.)O.Ktze.;CsDREB-A1 gene;transcription factor;cold resistance
Q751;S571.1
A
1674-7895(2014)04-0008-09
10.3969/j.issn.1674-7895.2014.04.02
2014-04-21
国家自然科学基金资助项目(31200520);江苏省自然科学基金资助项目(BK2012774);教育部博士点基金项目(20120097120031);中国博士后科学基金项目(2013M541686);国家大学生创新创业训练计划项目(201410307030)
刘志薇(1990—),女,河北邯郸人,硕士研究生,主要研究方向为茶树分子生物学。
①通信作者E-mail:zhuangjing@njau.edu.cn
