罗汉果和熟地增加小鼠造血干细胞的数量和功能
2014-05-10石桂英杨亚军张连峰
白 琳,石桂英,杨亚军,张连峰
(中国医学科学院北京协和医学院实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
罗汉果和熟地增加小鼠造血干细胞的数量和功能
白 琳,石桂英,杨亚军,张连峰
(中国医学科学院北京协和医学院实验动物研究所,卫生部人类疾病比较医学重点实验室,北京 100021)
目的 罗汉果和熟地具有增强机体免疫力,延年益寿的作用。本文研究罗汉果和熟地对造血干细胞的影响。方法 各组小鼠连续喂养罗汉果或熟地3个月,流式细胞仪测量小鼠的外周血、脾脏和骨髓中免疫细胞和造血干细胞的变化;小鼠用半致死剂量的放射线照射后,连续喂养罗汉果或熟地1个月后,流式细胞仪测量罗汉果或熟地对于免疫细胞和造血干细胞损伤修复的作用。结果 分析检测结果发现,与对照组相比,长期喂养罗汉果或熟地的小鼠骨髓和外周血中B细胞的比例降低,粒细胞的比例增加,T细胞没有明显变化;骨髓中造血干细胞的数量增加,尤其是长期造血干细胞数量增加显著。半致死剂量的放射线照射后,罗汉果或熟地喂养1个月,小鼠的粒细胞和T细胞都有明显的改善,造血干细胞的数量明显增加。结论 罗汉果或熟地长期服用会增加小鼠造血干细胞的数量和功能,促进了辐射所致的骨髓抑制小鼠的造血干细胞的恢复。
罗汉果;熟地;流式细胞术;造血干细胞
罗汉果为葫芦科植物,具有清热润肺的功效,常年服用,能延年益寿,被人们誉为“神仙果”。研究表明,罗汉果皂苷提取物对I性糖尿病小鼠的免疫功能有重要调节作用,能显著提高免疫抑制小鼠巨噬细胞的吞噬功能,增加免疫器官的重量,增强机体免疫功能[1]。熟地为玄参科植物地黄的块根经加工炮制而成。熟地具有补血滋阴的功效,研究表明,熟地具有补血和免疫调节作用。连续注射地黄6 d可促进小鼠造血干细胞的增殖[2-3]。罗汉果和熟地是中药中延年益寿相关的中药,但是其作用的细胞学依据还没有明确的解释。干细胞衰老是机体衰老的基础,延年益寿相关的中药对于干细胞的作用还没有系统的研究。因此我们对小鼠长期喂养中药研究其对造血干细胞的作用。
造血干细胞是一群处于静息状态的细胞,有迅速增殖、自我更新和分化的能力,确保了数十亿寿命较短的外周血中的血细胞和免疫细胞不断的更新。造血干细胞可以在不同的状态下不断切换休眠和激活的状态[4]。放射线是诱导DNA损伤的重要手段,已被普遍应用于研究骨髓造血干细胞损伤修复[5]。
长期服用罗汉果和熟地对于免疫细胞和骨髓造血干细胞的影响,以及损伤后对促进造血功能的恢复作用,目前尚未见文献报道。因此,本文使用中药罗汉果和熟地长期喂养小鼠,研究其对免疫系统和造血干细胞的影响。同时半致死剂量的放射线照射诱导造血干细胞损伤模型,研究罗汉果和熟地对造血干细胞损伤修复的作用。
1 材料和方法
1.1 动物
C57BL/6J雌性小鼠由本所繁育【SCXK(京)2009-007】。动物饲养在SPF动物房内,实验室中涉及动物的操作程序已经得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准(批准号ILAS-SCAL-2012-003)。
1.2 中药喂养
将小鼠随机分为正常对照组、罗汉果喂养组和熟地喂养组。对照组小鼠给予常规的标准数量,罗汉果喂养组(200 mg/kg·d)和熟地喂养组(100 mg/kg·d))在常规的标准鼠粮中加入相应剂量的药物。药物的剂量按照成人与小鼠之间药物剂量换算系数换算。小鼠每天的摄入量为3 g/只/d。鼠粮和饮水保持新鲜,每3 d更换一次。
1.3 流式分析
外周血细胞取自小鼠眼眶,裂解红细胞后,获得外周血细胞悬液。小鼠脱颈椎处死后,取脾脏、后肢骨,置于冰上预冷的PBS中。脾脏用磨砂玻片研磨成细胞悬液;后肢骨用5mL注射器将骨髓细胞冲出,并吹打成细胞悬液。将细胞悬液用50μm尼龙滤膜过滤后收集到15 mL离心管中,用PBS定容至10 mL,混匀后计数,取106细胞标记荧光抗体。
骨髓造血干细胞的分析中用如下抗体进行标记:CD34-FITC、Flt3-PE、Sca1-PE-Cy7、cKit-APC、Gr-1-Biotin、Mac-1-Biotin、B220-Biotin、IL-7RBiotin、CD4-Biotin、CD8-Biotin、Biotin-APC-Cy7。骨髓造血干细胞(HSC)表面标记为:Lin-c-kit+sca1+,长期造血干细胞(LT-HSC)表面标记为:Linc-kit+Sca1+CD34-Flt3-,短期造血干细胞(STHSC)表面标记为:Lin-c-Kit+Sca1+CD34+Flt3-,多能祖细胞(MPP)表面标记为:Lin-c-Kit+Sca1+CD34-Flt3-。免疫细胞标记抗体:CD4-FITC、CD8-Pcrcp-cy5.5、B220-PE-Cy7、CD11B-APC-Cy7[6]。上述抗体加入细胞悬液,冰上避光,30 min;加1 mL染色缓冲液,离心,2600 r/min,5 min,弃上清,加200 μL染色缓冲液重悬细胞,用50μm尼龙滤膜过滤,冰上避光。使用美国 BD公司 Aria流式细胞仪检测。
1.4 放射线照射
照射小鼠分为三组,每组10只,经过60Co全身照射,剂量率0.5~1 Gy/min,总计量为4.5 Gy。照射后分别喂养正常饲料、熟地饲料和罗汉果饲料一个月,喂养剂量同上。一个月后取外周血、骨髓、脾脏进行相应的实验。
1.5 统计分析方法
数据分析采用SPSS13.0软件包进行统计分析,各组数据均采用x±s表示。组间资料分析采用t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 熟地和罗汉果对造血系统的影响
为了了解熟地和罗汉果对于造血系统的影响,我们将小鼠分为三组,分别为正常对照组,罗汉果喂养组和熟地喂养组。持续喂养3个月后,我们分别取小鼠的外周血、骨髓、脾脏组织的细胞通过流式细胞仪检测其免疫细胞的比例。结果显示与正常对照组相比,罗汉果和熟地喂养后在小鼠的外周血中B细胞(B220+)比例由(47.14±6.52)%降低到(32.86±9.02)%和(37.72±4.71)%,粒细胞(CD11b+)比例由(24.76±5.16)%上升为(30.32 ±6.88)%和(27.66±1.72)%(图1A);骨髓中B细胞比例由(10.91±2.78)%降低到(7.166± 1.08)%和(4.382±0.63)%,粒细胞比例由(20.96 ±3.86)%上升为(28.96±2.94)%和(28.96± 3.81)%(图1B);脾脏中B细胞和T细胞(CD3+)没有明显的变化(图1C)。结果表明,长期喂养罗汉果和熟地对于小鼠免疫系统有着重要影响。
2.2 熟地和罗汉果对造血干细胞的影响
免疫细胞都是由造血干细胞发育而来,为了研究罗汉果和熟地对骨髓造血干细胞的影响,我们利用流式细胞仪分析了长期喂养罗汉果或熟地后造血干细胞的变化。结果显示,与对照相比,喂养罗汉果或熟地后造血干细胞(LSK,Lin-Sca-1+c-kit+)的数量增加,喂养罗汉果后效果更加明显(图2B)。依据Flt-3和CD34可以将造血干细胞进一步划分为长期造血干细胞(LT-HSCs,long-term HSCs,Lin-Sca-1+c-Kit+CD34-Flt-3-)、短期造血干细胞(STHSCs,short-term HSCs,Lin-Sca-1+c-Kit+CD34+Flt-3-)和 多 能 干 细 胞 (MPPs, multipotent progenitors,Lin-Sca-1+c-Kit+Flt-3+)(图2A)。结果显示罗汉果和熟地对于长期造血干细胞数量的增加作用更加明显,分别增加了2倍和1.2倍,短期造血干细胞和多能造血干细胞没有明显变化。因此,长期喂养罗汉果或熟地可以增加长期造血干细胞的数量,进而影响免疫细胞。
2.3 放射线照射后,熟地和罗汉果对造血系统的影响
骨髓是放射线敏感的器官,放射线照射后会造成免疫细胞的缺失,是研究骨髓造血干细胞损伤修复的重要方法。我们采用半致死剂量的放射线照射小鼠后,连续一个月喂养罗汉果和熟地,研究其对于免疫系统的恢复作用。实验结果显示,4.5 Gy照射后小鼠的外周血中T细胞和粒细胞与正常小鼠相比明显降低,喂养罗汉果和熟地后,T细胞比例由(15.6±2.93)% 恢复为(18.8±7.25)% 和(25.99±7.65)%,粒细胞比例由(16.19±2.99)%上升为(16.19±6.18)%和(19.29±4.95)%,其中罗汉果的效果更加明显(图3A)。在骨髓中,B细胞数和粒细胞数都得到了恢复(图3B)。但是在外周血中B细胞比例出现了明显的降低,我们推测可能是由于喂养时间过长导致了B细胞发育产生障碍。结果说明,罗汉果和熟地可以调节小鼠放射线损伤后的T细胞和粒细胞的恢复。
2.4 放射线照射后,熟地和罗汉果对造血干细胞的影响
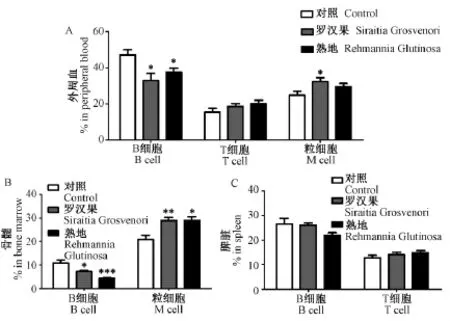
图1 长期喂养罗汉果和熟地对免疫细胞的影响Note:A:percent of different cells in peripheral blood;B:percent of different cells in the bonemarrow;C:percent of different cells in spleen.Fig.1 Siraitia Grosvenoriand Rehmannia Glutinosa influence the cells of peripheral blood,bonemarrow and spleen
照射后,罗汉果和熟地会促进免疫细胞的恢复,为了了解其对造血干细胞的作用,我们利用流式细胞仪分析了造血干细胞的数量。结果显示,照射后造血干细胞的数量明显降低,而喂养罗汉果和熟地后,造血干细胞数量明显增加(图4A)。将造血干细胞进一步研究发现,小鼠经过照射长期造血干细胞、短期造血干细胞和多能干细胞的细胞数分别降低了1.58倍、1.65倍和2.05倍,喂养罗汉果或熟地后数量都有很大程度的增加。长期造血干细胞数量增加了3.26倍和2.05倍;短期造血干细胞数量增加了2.1倍和1.82倍;多能干细胞数量增加了3.9倍和2.71倍。因此,罗汉果和熟地可以缓解射线造成的骨髓造血干细胞的抑制。
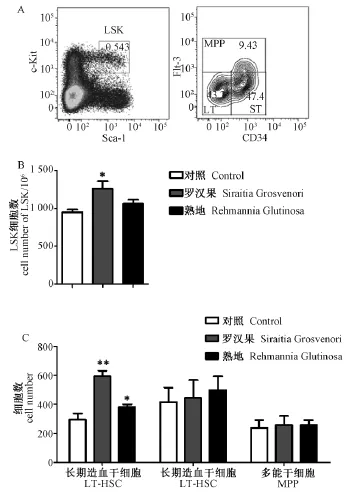
图2 罗汉果和熟地影响造血干细胞的数量Note:A:Representative staining profiles for the HSCs and progenitor populations in BM.B and C:cell number of HSC and LT-HSC,ST-HSC,MPP.Fig.2 Siraitia Grosvenoriand Rehmannia Glutinosa influence the number of HSCs
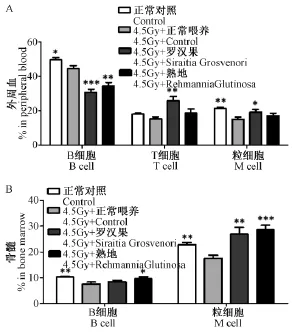
图3 4.5Gy照射后,罗汉果和熟地对小鼠免疫细胞比例的影响Note:A:percent of different cells in peripheral blood;B:percent of different cells in the bonemarrow.Fig.3 Siraitia Grosvenori and Rehmannia Glutinosa influence the cells of peripheral blood,bone marrow after 4.5Gy IR treatment
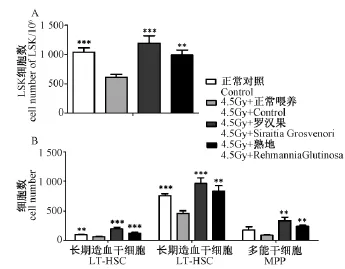
图4 罗汉果和熟地促进4.5Gy放射线照射后造血干细胞的增殖Note:A and B:cell number of HSC and LT-HSC,ST-HSC,MPP after 4.5Gy IR treatment.Fig.4 Siraitia Grosvenori and Rehmannia Glutinosa recovered the number of HSCs after 4.5Gy IR treatment
3 讨论
造血干细胞通过细胞分裂、自我更新、增殖和分化,一方面维持自身数量的稳定,另一方面可以分化为各种功能细胞(粒细胞、单核巨噬细胞、红细胞、巨核细胞/血小板、T/B细胞、NK细胞、树突状细胞等),最终维持血液系统的动态平衡[7]。在机体受到损伤后,造血干细胞会进入细胞周期,满足整个机体对血细胞的需求[8]。
在中药,熟地具有滋阴补血的作用,罗汉果能清肺润肠,净化血液中的过氧化物[9]。熟地中的地黄多糖可通过激活T淋巴细胞,促进T细胞增殖及分泌IL-2等途径增强机体的免疫功能。地行多糖可以刺激骨髓粒系祖细胞和红系祖细胞的增殖,增加外周血白细胞数[6]。罗汉果的皂苷提取物能使小鼠胸腺、脾脏等免疫器官增加,提高小鼠巨噬细胞的吞噬功能[1]。我们研究表明长期喂养小鼠熟地和罗汉果会促进造血干细胞的增殖,同时在机体受到损伤,喂养小鼠熟地和罗汉果可以促进造血系统的恢复。由于中药成分的复杂性,熟地和罗汉果中的促进造血干细胞增殖的有效成分还不清楚,影响造血干细胞增殖的信号通路还需要继续研究。
造血干细胞一方面可以维持机体内血细胞和免疫细胞的动态平衡,另一方面在特定的环境下造血干细胞可以分化为其他组织细胞[10-12]。因此,造血干细胞在机体衰老中有着重要作用。罗汉果和熟地都具有延年益寿的作用,可能是通过促进造血干细胞的增殖和功能来延缓机体的衰老进程。
[1]Xiangyang Q,Weijun C,Liegang L,et al.Effect of a Siraitia grosvenori extract containing mogrosides on the cellular immune system of type1 diabetesmellitusmice[J].Mol Nutr Food Res,2006,50(8):732-738.
[2]刘福君,程军平,赵修南,等.地黄多糖对正常小鼠造血干细胞、祖细胞及外周血象的影响[J].中药药理与临床,1996,2:12-14.
[3]李发胜,徐恒瑰,李明阳,等.熟地多糖提取物对小鼠免疫活性影响[J].中国公共卫生,2008,24(9):1109-1110
[4]Wilson A,Laurenti E,Oser G,et al.Hematopoietic stem cells reversibly switch from dormancy to self-renewal during homeostasis and repair[J].Cell,2008,135(6):1118-1129.
[5]Mandal PK,Blanpain C,Rossi DJ.DNA damage response in adult stem cells:pathways and consequences[J].Nat Rev Mol Cell Biol,2011,12(3):198-202.
[6]Bai L,Shi G,Zhang X,et al.Transgenic expression of BRCA1 disturbs hematopoietic stem and progenitor cells quiescence and function[J].Exp Cell Res,2013,319(17):2739-2746.
[7]Van Zant G,Liang Y.Concise review:hematopoietic stem cell aging,life span,and transplantation[J].Stem Cells Transl Med,2012,1(9):651-657.
[8]Pietras EM,Warr MR,Passegue E.Cell cycle regulation in hematopoietic stem cells[J].JCell Biol,2011,195(5):709-720.
[9]Qi XY,Chen WJ,Zhang LQ,et al.Mogrosides extract from Siraitia grosvenori scavenges free radicals in vitro and lowers oxidative stress,serum glucose,and lipid levels in alloxaninduced diabeticmice[J].Nutr Res,2008,28(4):278-284.
[10]Kassmer SH,Krause DS.Detection of bonemarrow-derived lung epithelial cells[J].Exp Hematol,2010,38(7):564-573.
[11]Loi R,Beckett T,Goncz KK,et al.Limited restoration of cystic fibrosis lung epithelium in vivo with adult bone marrow-derived cells[J].Am J Respir Crit Care Med,2006,173(2):171 -179.
[12]Eisenberg CA,Burch JB,Eisenberg LM.Bone marrow cells transdifferentiate to cardiomyocytes when introduced into the embryonic heart[J].Stem Cells,2006,24(5):1236-1245.
Siraitia grosvenori and rehmannia glutinosa promote the hematopoietic stem cells and progenitor cells proliferation and function
BAILin,SHIGui-ying,YANG Ya-jun,ZHANG Lian-feng
(Key Laboratory of Human Diseases Comparative Medicine,Ministry of Health;Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences(CAMS)&Comparative Medicine Centre,Peking Union Medical College(PUMC),Beijing 100021,China)
Objective To investigate the influence of Siraitia Grosvenori and Rehmannia Glutinosa on the Hematopoietic stem cells proliferation and function.M ethods Cells from the peripheral blood,spleen and bonemarrow ofmicewere stained with indicated antibodies,and analyzed by flow cytometry.Mice were divided 3 groups:control group,Siraitia Grosvenori treatment group and Rehmannia Glutinosa treatment group.After 4.5Gy IR treatment,mice divided 4 groups:control group,4.5Gy IR treatment and feed with normal food,4.5Gy IR treatment and feed with Siraitia Grosvenori and 4.5Gy IR treatment and feed with Rehmannia Glutinosa for 1 month.Results Mice fed with Siraitia Grosvenori and Rehmannia Glutinosa decreased the percentage of B cells and increased the percentage of M cell.For HSCs,the number of HSCs was increased,especially the number of LT-HSCs.After 4.5Gy IR treatment,mice fed with Siraitia Grosvenori and Rehmannia Glutinosa increase the number of HSCs,and increased the percentage of M cells.Conclusion Siraitia Grosvenori and Rehmannia Glutinosa promote the hematopoietic stem cells and progenitor cells proliferation and function and recover the damage that caused by IR treatment.
Siraitia Grosvenor;Rehmannia Glutinsa;Flow cytometry;Hematopoietic stem cell
R332
A
1671-7856(2014)03-0050-05
10.3969.j.issn.1671.7856.2014.003.011
国家自然科学基金青年科学基金项目(81200256);高等学校博士学科点专项科研基金新教师类资助课题(20121106120034)。
白琳(1984-),女,助理研究员,博士。研究方向:干细胞与衰老。E-mail:bailin49@163.com。
张连峰,E-mail:Zhanglf@cnilas.org。
2014-01-07
研究报告
