桑树(Morus alba)与丛枝菌根的共生对重金属元素吸收的影响
2014-05-08樊宇红凌宏文朴河春
樊宇红,凌宏文,朴河春
中国科学院地球化学研究所环境地球化学国家重点实验室,贵州 贵阳 550002
桑树(Morus alba)的分布非常广,生长速度快,具有极强的耐干旱耐贫瘠的能力,对恶劣自然环境有超强适应性和突出的水土保持功能。因此,桑树在特殊的地质地貌和自然干旱频繁地区植被恢复,以及在石漠化地区生态系统恢复中发挥重要作用(黄小辉等,2012;刘代军等,2012)。桑树叶不仅用于养蚕业,还为家禽和畜牧业提供富含蛋白质的高质量饲料(Liu 和 Willison, 2013)。
菌根真菌能强烈地影响植物对环境的适应性(Johnson 等,2010;Pánková等 2011)。 菌根真菌对植物适应性和生态系统的可持续性的贡献,是通过促进紧密的营养物循环(Vander Heijden等,2008),即通过增进营养物和水分的吸收能力来实现(Pánková等 2011;Van der Heijden,2010)。目前,对于植物与菌根真菌共生给植物生长带来的诸多影响是否有益研究者们仍然存有争议(Smith和Smith,2013;Johnson和Graham, 2013;Ryan和Kirkegaard,2012)。而对于AM的最重要的功能是把营养物通过根外菌丝体输入到根细胞的观点,研究者们是一致认同的。以菌根真菌为媒介的植物对营养物吸收的最大特点是双向营养物传递,即AM植物把叶片的碳水化合物输送到真菌体中,从而把大量的有机碳输入到土壤中去,同时把土壤中的矿质营养物输入到植物组织(Piao和Liu,2011;Piao等,2012)。菌种的侵染引起根系的形态学和生理学的变化(Tanaka和Yano,2005)。比如,宿主植物的根系和根外菌丝体能够形成和释放大量的有机物,它能溶解难以被利用的营养物,使它具有较强的移动能力,以便被宿主植物所吸收(Theuerl和Buscot,2010;Piao和Liu,2011);同时产生一些酶,比如磷酸酯酶,磷酸酯酶不但具有很强的移动营养物的能力,能帮助宿主植物吸收营养物(Ostertag,2010);而且能影响土壤的生物地球化学作用,包括矿化和硝化作用(Hamel,2004)。上述因素都能够促进土壤中的营养物的可利用性,从而提高植物对营养元素的吸收。桑树丛枝菌根侵染率随时间逐渐升高,其侵染率达到40%以上时就能观察到丛枝菌根(AM)真菌对桑苗生长的明显促进作用。因此,桑树是典型的丛枝菌根植物,菌根有利于桑树在极端逆境中生长(舒玉芳等,2011;刘代军等,2012;叶娇等,2012)。
重金属元素Fe、Mn、Zn和Cu是植物和人体所需的营养元素,而重金属元素Cd是一种在土壤中自然存在的,人体不需要的微量元素。Cd是土壤中相对容易移动的元素之一,毒性很大。土壤盐度和土壤酸度都可以影响土壤中Cd的生物可利用性(He 和 Singh,1994)。由于Cd和Zn的化学性质相近,互为竞争元素,Cd在缺Zn的土壤中容易被植物所吸收,因此Cd的积累容易出现在缺Zn的植物体中(Oliver等,1994)。然而在土壤Zn含量非常高的稻田中,水稻谷粒中 Cd含量也非常高(Chaney等,2004)。同一种植物在不同的土壤环境中可表现出不同的行为。
每一种植物都具有为适应土壤环境而采取应对策略的能力,比如:非禾本科种类以增加质子分泌物来响应缺铁环境(Marschner,1995),并以 Fe(Ⅱ)的形式吸收(Eide等,1996);禾本科种类是释放非-蛋白氨基酸(phytosiderophores)之类的物质(Marschner,1995),是具有高亲和力的螯合剂,与Fe (III)形成络合物从而容易被植物所吸收,但这种分泌物并不是专对铁起络合作用的单一性螯和剂,它还会与Zn、Cu、Mn、Ni和Cd等元素络合(Shenker等,2001)。桑树虽是具有对恶劣自然环境有超强适应性的菌根植物,但它仍偏好于生长在偏酸性的富含营养物的土壤环境中,因此,弄清楚桑树与菌根真菌共生对吸收重金属含量所产生的影响是非常有必要的。
1 研究地概况与研究方法
1.1 研究区概况
贵州荔波位于贵州南部,珠江流域上游,处于贵州高原向广西丘陵过渡地带,东经108°00′50″~108°10′37″,北纬 25°17′26″~25°29′51″,海拔高度在500~720 m之间。年平均气温18.3 ℃,年平均降雨量为1320.5 mm。
贵州黄平处于黔中丘原与黔东丘陵的过渡地带上,属亚热带季风性湿润气候。地处东经107°51′42″ ~108°08′ 47″ ,北纬 26°46′ 20″ ~26°55′ 56″,海拔高度在700~1030 m之间。年平均气温15.4 ℃(13~16 ℃),年平均降雨量1114.2 mm。
采样地土壤类型多为碳酸盐类,与砂岩交叉分布,所采集的土壤均为黄壤。桑树均引种自广西,平均株行距约为0.5 m×1.2 m,4年生桑树的平均根径为5 cm左右。小于1 mm的桑树细根在0~20 cm土层内分布密度最大,呈水平状分布,而深部的根系呈垂直状分布(Liu和Willison,2013;石娟华等,2008),由此说明桑树细根不但能利用表层土壤空间,更能吸收利用深层土壤水分和养分(Liu和Willison,2013;石娟华等,2008)。桑树地下部分的生物量明显高于地上部分,占总生物量的53.1%(张光灿等,1997)。以养蚕为栽培目的的桑树,从5月上旬开始摘叶,5月底伐去全部枝叶,继续萌发枝叶后,从7月初至10月底一直处于摘叶养蚕中。采样时间是2013年5月。
1.2 研究方法
1.2.1 样品采集和分析
将采集到的植物样品尽快运回实验室,用蒸馏水冲掉附着于样品上的污染物,置于 60 ℃烘箱中烘48 h。土壤样品过2 mm筛,风干,并剔除植物残留物。将土壤和植物组织样品分别研磨至粉状。土壤和植物样品中的C和N的含量的测定采用元素分析仪(PE2400-II型)。植物样品中重金属(Fe、Mn、Zn、Cu和 Cd)含量的分析采用酸溶-电感耦合等离子体发射光谱(ICP-OES-美国安捷伦公司)和电感耦合等离子体质谱(ICP-MS-美国PE公司)测定;土壤中的可利用性重金属含量用 0.005 mol·L-1DTPA溶液萃取,并用等离子发射光谱测定(Lindsay和Norvell,1978)。植物样品中的糖类含量的测定采用蒽酮比色法(Piao等,2001;Piao和Liu,2011)。在样品分析中平行样的测定达 20%,所得分析数据均符合要求。
1.2.2 侵染率的检测方法
侵染率的检测方法依据根段频率标准法进行(Liu和 Luo,1994)。孢子量检测方法:称取 20 g鲜土,经1mm、100目、200目、400目筛过滤分选后,于OLYMPUS显微镜镜下检查孢子个数。上述样品的分析均在中国科学院地球化学研究所环境地球化学国家重点实验室完成。
1.2.3 统计方法
采用SPSS 17.0对数据进行处理。文中所有数据均为平均值±标准差。所测定的数据在5%的检验水平下进行线行回归和t检验来确定显著性差异水平。
2 结果
2.1 桑树根系 AM 真菌侵染率水平和土壤菌根真菌数量
本研究在荔波和黄平各选择3个样品进行侵染率检测,检结果显示:荔波3个桑树样品的AM侵染率分别为 16%、13%和 12%,而黄平分别为16%、32%和9%。对0~20 cm土壤层的菌根真菌孢子密度进行分析,结果显示:荔波地区的20 g烘干土壤中菌根真菌的数量为:(21±9)个,略高于黄平的(15±1)个。
2.2 贵州荔波和黄平两地土壤中重金属(Fe、Mn、Zn、Cu、Cd)含量对比
贵州荔波和黄平两地以石灰岩分布为主,交叉分布着砂岩。因此,石灰岩和砂岩的分布格局决定了桑树采样地土壤的 pH。由表 1可知,荔波采样地土壤的 pH显著低于黄平土壤 pH(表 1)。表 1列举了荔波和黄平两地土壤中 DTPA-萃取的重金属含量。DTPA-萃取的 Fe含量在荔波地区(18.0~212.9 μg·g-1)远高于黄平地区(11.8~91.1 μg·g-1)。Mn在土壤中的分布与Fe相反,在荔波地区(2.78~132.09 μg·g-1)远低于黄平(17.18 ~223.5 μg·g-1)。以上数据说明土壤 pH 值较高的黄平地区土壤可利用性Fe的含量低于pH值较低的荔波地区土壤,而在土壤pH较高的黄平地区土壤可利用性Mn的含量却高于土壤pH较低的荔波土壤。该结果与前人的研究结果一致(凌宏文等,2007)。其他重金属元素含量在黄平和荔波之间不具有统计学意义上的差异(表1)。荔波和黄平两地土壤可利用性的 Fe含量随土壤 pH上升而下降,而可利用性Zn的含量随土壤pH上升而增加(图1)。其余元素与土壤pH值之间没有显著相关性。
2.3 桑树组织中的碳和糖类化合物含量的变化
桑树叶片中的C含量在荔波(40.2%±1.5%)和黄平(40.1%±1.1%)两地之间几乎没有差异,而根系中的C含量表现为荔波(44.0%±1.6%)明显高于黄平(42.1%±3.2%)(p=0.038,图2a)。桑树叶片中的糖类含量表现为荔波(67±27)mg·g-1明显低于黄平(105±57)mg·g-1(p=0.02),而根系中的糖类含量则表现为荔波(125±43)mg·g-1显著高于黄平(91±43)mg·g-1(p=0.032,图 2b)。该结果表明,生长在较高土壤pH的黄平桑树相比于生长在较低土壤pH的荔波其叶片中的光合作用产物将被更多地输送到桑树的根系。
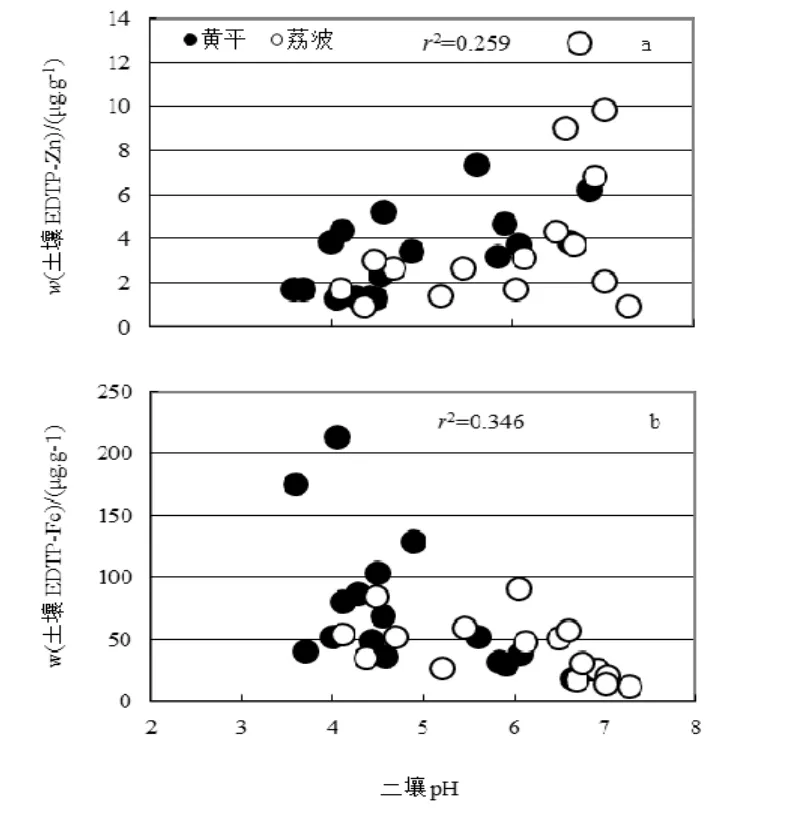
图1 土壤Zn(a)和Fe(b)随土壤pH的变化Fig. 1 Changes of Soil Zn(a) and Fe(b) with Soil pH
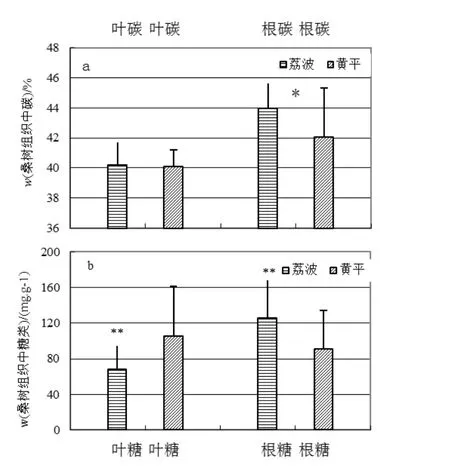
图2 贵州黄平和荔波桑树组织叶根中的碳含量(a),和糖类含量(b)的比较. *p<0.05; **p<0.01; ***p<0.001Fig. 2 Comparisons of Mulberry Tissue Carbon(a) and Sugar Concentrations(b) between Huangping and Libo. *p<0.05; **p<0.01;***p<0.001

表1 贵州黄平(n=16)和荔波(n=17)桑地土壤重金属含量及t检验结果Table 1 Soil heavy metal concentrations in Huangping (n=16) and Libo (n=17) in Guizhou, and the t-test result

表2 黄平(n=16)和荔波(n=17)桑地所生长的桑树组织中重金属含量,及t检验结果Table 2 Mulberry tissue heavy metal concentrations in Huangping (n=16) and Libo (n=17),and the t-test result
2.4 桑树中Fe、Mn、Zn、Cu和Cd的分配模式
除 Fe元素外,桑树叶片中的重金属含量在荔波和黄平之间有明显差异,均表现为荔波高于黄平(表2)。相反,在桑树根系中Fe含量在荔波和黄平之间有明显差异,且荔波低于黄平,而其他重金属在两地间没有明显差异(表2)。显然,这种分配模式不同于土壤中的分配模式。
2.5 桑叶中重金属元素间相互关系
桑树叶片Cd与Zn含量之间(图3a),Cd与Mn含量之间(图3b),Cd与Cu含量之间(r2=0.142,p<0.05)有显著相关性,而叶片Cd与Fe含量之间没有显著相关性。
3 讨论
3.1 桑树丛枝真菌侵染率
生长在荔波和黄平的桑树都具有丛枝菌根,但两者的侵染率水平几乎没有差异。菌根植物对营养元素的吸收有两个途径:一是从根系的表皮层吸收,另一个是通过菌丝体吸收(Smith等,2010)。如果菌丝体的根外结构和根内结构没有连接,那么共生体之间的营养物传播就不可能进行,也就是缺少菌根的吸收功能(Piao和 Liu,2011)。Piao和Liu(2011)的实验结果表明,即使以菌根为媒介的过程没有形成,在耕地中生长的杉木幼苗根系中仍然能检测出丛枝菌根的侵染。另外,检测真菌侵染率所使用的最为普通的方法是“Trypan blue staining of roots”,尽管该法能很好地指示真菌在根系中的定居和真菌的侵染,但并不能指示共生效率(Azcón等,2008)。共生效率可定义为:以 AM 为媒介的营养物吸收过程中,AM 植物吸收营养物的能力(Piao和 Liu,2011)。因此,生长在荔波和黄平的桑树AM侵染率近似,并不代表两地桑树吸收重金属的能力相同。本研究中荔波的孢子密度虽高于黄平,但两者的数量均不高。郑克举等人(2013)的数据表明在马尾松林土壤中的菌根真菌孢子数可达2925个。Aliasgharzadeh等人(2001)的研究表明,孢子密度与土壤可利用性Ca、Mg之间存在负相关关系。

图3 桑叶Cd含量与桑叶Zn含量(a),与桑叶Mn含量(b)之间的相关性Fig. 3 Relationships between foliar Cd and Zn Concentrations (a)and between foliar Cd and Mn Concentrations (b) in Mulberry
3.2 土壤pH的影响
植物通过一系列的机制来改进土壤的物理、化学和生物的性质,其中包括能酸化土壤的质子的释放(Richardson等,2009)。土壤pH的改变将直接影响营养物的可利用性,或通过与土壤微生物的相互作用间接地影响营养物的可利用性(Richardson等,2009)。土壤化学性质决定土壤中的 AM 真菌的分布状态,脱钙地区土壤中AM真菌的密度较高(Mårtensson等,2012)。因此,土壤酸性直接影响土壤中AM真菌的分布,从而间接地影响营养物的可利用性(Guo等,2012)。特定的AM种类在根系中的再育需要最佳土壤 pH环境(Orozco-Patiño和 Medina-Sierra,2013)。土壤pH或P含量的改变能够强烈的影响孢子的形成以及根系的侵染(Orozco-Patiño 和 Medina-Sierra,2013)。Mårtensson等人(2012)发现在土壤中AM真菌菌丝体随土壤pH增加而减少,但土壤pH与根系中AM真菌的数量之间没有显著的相关性。Rousk等人证明,低pH条件有利于真菌的生长,而高pH有利于细菌的生长(Rousk等,2011)。Labidi等人(2012)通过实验证明土壤CaCO3处理明显地减少根系的生长,并改变了AM真菌的与其共生相关的发育阶段,而真菌依然能够完成他的生命周期。高含量的 CaCO3降低根系的生长,值得注意的是其影响力在菌根根系的影响远大于非菌根根系。这与菌根根系把相当数量的C分配给真菌,以维持真菌的新陈代谢作用有关(Labidi等,2012)。本研究结果与上述研究相一致。在本研究中,具有较高pH的黄平的桑树根系的生物量远不如荔波,而且分配给根系的光合作用产物也远不如荔波。这些结果说明,偏酸性的土壤环境更有利于桑树与丛枝菌根形成互利共生的关系。
土壤 pH、土壤结构和土壤有机物能对重金属的溶解性和迁移性产生较大影响(Romkens 和Salomons,1998)。其中土壤pH是影响微量营养元素可利用性和吸收的最重要的因素。因为Fe和Zn在土壤中的溶解性强烈地依赖于pH值(Lindsay and Norvell,1978;Obrador等,2007)。pH 在 5 以下时,释放到土壤溶液的Mn将抑制许多植物的生长。在碱性土壤,Fe的可利用性减少,限制了许多植物种类的分布(Olsson等,2010)。土壤可利用性Fe的含量在黄平明显少于荔波(统计学上没有差异)。石灰质土壤可利用性的Cd和Mn的含量要高于砂土(Alvarez等,2006;Piao和Liu,2011),Cd和Mn具有相似的吸收模式。Tyler 和 Olsson(2001)报道说Cd在土壤溶液中的浓度遵循“U”型规律:pH在5~7之间随pH的升高而降低,而在7~8之间随pH的升高再增加。
决定土壤pH的因素较多:除土壤母岩影响外,真菌的存在总是以不同的程度降低土壤pH值,这取决于真菌种类(Orozco-Patiño和Medina-Sierra,2013)。此外,植物生长本身能够分泌酸化或碱化土壤环境的物质(Moody和Aitken, 1997)。比如,番茄根系在土壤中生长引起根际的pH上升0.1~0.2单位。许多研究者在酸性土壤中观察到同样的现象,特别是施硝酸盐时,在总体平衡中出现阴离子的吸收超过阳离子的吸收(Hinsinger等,2003)。但在石灰质土壤中,番茄根系引起土壤溶液的轻微的酸化,表明质子的释放,引起根际0.1单位的pH降低(Chaignon等,2002)。这些实验表明,植物对土壤pH的两种相反的功能行为,使植物具有适应不利的土壤条件的能力(Chaignon等,2002)。Singh 等人(1995)发现土壤pH从5.5上升到6.5时,小麦谷粒和胡箩卜中的Cd含量显著降低,但随后pH的上升反而促进Cd含量的上升。在土壤中施石灰,可减少植物对重金属元素的吸收(Jackson and Aloway,1991)。
3.3 有机分泌物的影响
植物通过一系列的机制,来改进土壤的物理、化学和生物的性质,其中包括根系分泌物的释放(Richardson等,2009)。大多数植物种类选择性地吸收重金属的能力是有限的(Marschner,1995)。因此,植物体除吸收必须的微量元素之外,还能够吸收植物所不需要的重金属(比如 Cd),甚至对有毒重金属的吸收能力非常强。有些重金属元素在大多数土壤环境中的溶解度较低,植物可利用性较低。然而,Cd在土壤中具有易溶性,其生物可利用性相对较高(Clemens,2006)。植物根系喜欢吸收金属元素的形态是溶解的游离的阳离子状态(Cd2+、Zn2+、Cu2+,),同样喜好与有机配位基相结合形成金属络合物,尤其是 Zn(Ondrasek 和 Rengel,2012)。根系分泌物包括:低分子量的氨基酸、有机酸、糖类、酚类以及次生的新陈代谢产物(Vos等,2012)。这些分泌物与重金属形成络合物后容易被植物所吸收(Shenker等,2001)。
根际沉积和根系的转换代谢的有机物要占输入土壤总碳的40%,是土壤微生物过程的主要驱动者(Richardson等,2009)。但真菌是专性共生物,如果没有植物所供给的光合产物,真菌就不能生存(Smith等,2010;Piao和Liu,2011)。因此,菌根植物根系的分泌作用是一个非常重要的过程,能把5%~20%的光合作用所产生碳释放到根际(Vos等,2012),在植物的根系系统周围形成一个小型地带,使它具有特异的物理、生物化学以及生态性质(Vos等,2012)。菌根的共生作用可改变根系分泌物的释放(Hodge,2000;Jones等,2004)。植物调配给根外AM菌丝体的C也随土壤pH的上升而减少,土壤pH从5.5变化至 8.5的过程中,13C含量的减少幅度为 1.2 μg·g-1(Vos等,2012)。本研究结果也表明,具有高pH的黄平输入到根系的光合作用产物远低于具有低pH的荔波。菌根植物种类能够释放具有高亲和力的能与重金属形成易被植物所吸收的络合物的螯合剂非-蛋白氨基酸之类的物质(Marschnetr,1995;Shenker 等,2001)。。另外,根系分泌物的另一个重要作用是溶解重金属,使它具有较强的移动能力,以便被宿主植物所吸收(Theuerl和 Buscot,2010;Piao 和 Liu,2011)。这就能够解释为什么在较低pH环境条件下生长的桑树的叶片含有较高含量的重金属。
3.4 元素之间相互作用的影响
土壤中的钙(Ca)可抑制植物对 Cd的吸收(Tyler and McBride,1982),这与本研究结果相一致。当然,植物对Cd的吸收能力与植物种类相关。比如,Ramos 等人(2002)的实验表明,莴苣植物具有相对高的吸收和迁移Cd的能力。他们的实验证明Mn在茎叶中的含量随Cd含量的增加而增加,而Fe、Cu和Zn的含量随Cd含量的增加而降低。Cd抑制Mn的吸收,以及从根系到茎叶的迁移。在紫花光叶苕中Cd与Mn,Zn与Fe之间的吸收模式一致(Piao和Liu,2010)。然而,在自然土壤环境条件下,桑树中重金属之间表现出正相关关系。因此,重金属元素间相互作用的关系是复杂无同一规律可寻的。
4 结论
从本实验结果可得出如下结论:丛枝菌根真菌的侵染率不能作为菌根植物对重金属元素的吸收能力的良好指示。菌根植物最重要的特性是营养物和光合作用产物的双向传递,即是把大量的糖类输送到根系和土壤中的真菌,并把土壤中的元素吸收到植物叶片。因此,输送到根系的糖类含量的大小决定了以AM-为媒介的重金属元素的吸收能力。本研究结果表明荔波桑树输入到根系的糖类含量远高于黄平,荔波桑树叶片中的重金属含量也远高于黄平。这是由于荔波和黄平之间土壤pH的差异性所导致。
ALIASGHARZADEH N, SALEH RASTIN N, TOWFIGHI H, et al. 2001.Occurrence of arbuscular mycorrhizal fungi in saline soils of the Tabriz Plain of Iran in relation to some physical and chemical properties of soil[J]. Mycorrhiza, 11:119-122.
ALVAREZ J M, LOPEZ-VALDIVIA L M, NOVILLO J, et al. 2006.Comparison of EDTA and sequential extraction tests for phytoavailability prediction of manganese and zinc in agricultural alkaline soils[J]. Geoderma, 132:450-463.
AZCÓN R RODRIGUEZ R, AMORA-LAZCANO E, et al. 2008. Uptake and metabolism of nitrate in mycorrhizal plants as affected by water availability and N concentration in soil[J]. European Journal of Soil Science, 59:131-138.
CHAIGNON V, BEDIN F, HINSINGER P. 2002. Copper bioavailability and rhizosphere pH changes as affected by nitrogen supply for tomato and oilseed rape cropped on an acidic and a calcareous soil[J]. Plant and Soil, 243:219-228.
CHANEY R L, REEVES P G, RYAN J A, et al. 2004. An improved understanding of soil Cd risk to humans and low cost methods to remediated soil Cd risks[J]. BioMetals 17: 549-553.
CLEMENS S. 2006. Toxic metal accumulation, responses to exposure and mechanisms of tolerance in plants[J]. Biochimie. 2004, 88:1707-1719.EIDE D, BRODENIUS M, FETT J, et al. 1996. A novel iron-regulated metal transporter from plants identified by functional expression in yeast[J]. Proceedings of the National Academy of Sciences USA,93:5624-5628.
GUO Y J, NI Y, RAMAN H, et al. 2012. Arbuscular mycorrhizal fungal diversity in perennial pastures; responses to long-term lime application.Plant and Soil, 351:389-403.
HAMEL C. 2004. Impact of arbuscular mycorrhizal fungi on N and P cycling in the root zone[J]. Canadian Journal of Soil Science,84:383-395.
HE Q B, SINGH B R. 1994. Crop uptake of Cd from phosphate fertilizers I.Yield and Cd content[J]. Water Air Soil Pollution, 74:251-265.
HINSINGER P, PLASSARD C, TANG C X, et al. 2003. Origins of root-mediated pH changes in the rhizosphere and their responses to environmental constraints: a review[J]. Plant and Soil, 248:43-59.
HODGE A. 2000. Microbial ecology of the arbuscular mycorrhiza[J].FEMS Microbiological Ecology, 32:91-96.
JACKSON A P, ALLOWAY B J. 1991. The bioavailability of cadmium to lettuce and cabbage in soils previously treated with sewage sludges[J].Plant and Soil, 132:179-186.
JOHNSON N C, GRAHAM J H. 2013. The continuum concept remains a useful framework for studying mycorrhizal functioning[J], Plant and Soil, 363:411-419.
JOHNSON N C, WILSON G W T, BOWKER M A, et al. 2010. Resource limitation is a driver of local adaptation in mycorrhizal symbioses[J].Proceedings of the National Academy of Sciences, 107:2093-2098.
JONES D L, HODGE A, KUZYAKOV Y. 2004. Plant and mycorrhizal regulation of rhizodeposition[J]. New Phytologist, 163:459-480.
LABIDI S, JEDDI F B, TISSERANT B, et al. 2012. Role of arbuscular mycorrhizal symbiosis in root mineral uptake under CaCO3 stress[J].Mycorrhiza, 22:337-345.
LINDSAY W L, NORVELL W A. 1978. Development of a DTPA test for zinc, iron, manganese, and copper[J]. Soil Science Society of America Journal, 42:421-8.
LIU R J, LUO X S, 1994. A new method to quantify the inoculum potential of arbuscular mycorrhizal fungi[J]. New Phytologist, 128:89-92.
LIU Y, WILLISON J H M. 2013. Prospects for cultivating white mulberry(Morus alba) in the drawdown zone of the Three Gorges Reservoir,China[J]. Environmental Science and Pollution Research,20:7142-7151.
MARSCHNER H. 1995. Mineral nutrition of higher plants. Academic Press.889 pp
MÅRTENSSON L M, SCHNOOR T K, OLSSON P A. 2012. Allocation of carbon to mycorrhiza in the grasses Koelerie glauca and Corynephorus canescens in sandy grasslands[J]. Applied Soil Ecology, 54:55-62.
MOODY P W, AITKEN R L. 1997. Soil acidification under some tropical agricultural systems. 1: Rates of acidification and contributing factors[J]. Australian Journal of Soil Research, 35:163-173.
OBRADOR A, ALVAREZ J M, LOPEZ-VALDIVIA L M, et al. 2007.Relationship of soil properties with Mn and Zn distribution in acidic soils and their uptake by a barley crop[J]. Geoderma, 137:432-43.
OLIVER D P, KLANNAM K G, TILLER K G, et al. 1994. The effect of zinc fertilization on cadmium concentration in wheat gain[J]. Journal of Environmental Quality, 23:705-711.
OLSSON P A, SCHNOOR T K, HANSON S A. 2010. pH preferences of red-listed gasteromycetes in calcareous sandy grasslands: Implications for conservation and restoration[J] Fungal Ecology, 3:357-365.
ONDRASEK G, RENGEL Z. 2012. The role of soil organic matter in trace element boavailability and toxicity. In: Ahmad P, Prasad MNV (eds),Abiotic stress responses in plants: metabolism, productivity and sustainability. Springer Science+Business Media, LLC. pp. 403-423.
OROZCO-PATIÑO F, MEDINA-SIERRA M. 2013. Effects of arbuscular mycorrhizal fungal species and the medium pH on the growth of Pueraria phaseoloides (Roxb.) Benth[J]. Symbiosis, 60:65-71.
OSTERTAG R. 2010. Foliar nitrogen and phosphorus accumulation responses after fertilization: an example from nutrient-limited Hawaiian forests[J]. Plant and Soil, 334:85-98.
PÁNKOVÁ H, MÜNZBERGOVÁ Z, RYDLOVÁ J, et al. 2011. The response of Aster amellus (Asteraceae) to mycorrhiza depends on the origins of both the soil and the fungi[J]. American Journal of Botany,98:850-858.
PIAO H C, LIU C Q, WANG SJ. 2012. Isotopic evaluation of the role of arbuscular mycorrhizae in Chinese fir seedlings[J].Pedobiologia-International Journal of Soil Biology, 55: 167-174.
PIAO H C, LIU C Q. 2010. Differences in uptake and distribution patterns between zinc and cadmium in Vicia villosa[J]. Chinese Journal of Geochemistry, 29:416-421.
PIAO H C, LIU C Q. 2011. Variations in nitrogen, zinc and sugar concentrations in Chinese fir seedlings grown on shrubland and ploughed soils in response to arbuscular mycorrhizae-mediated process[J]. Biology and Fertility of Soils, 47:721-727.
PIAO H C, LIU G S, WU Y Y, et al. 2001. Relationship of soil microbial biomass carbon and organic carbon with environmental parameters in mountainous soils of southwest China[J]. Biology and Fertility of Soils,33:347-359.
RAMOS I, ESTEBAN E, LUCENA J J, et al. 2002. Cadmium uptake and subcelluar distribution in plants of Lactuca sp. Cd-Mn interaction[J].Plant Science, 162:761-767.
RICHARDSON A E, BAREA J M, MCNEILL A M, et al. 2009. Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms[J]. Plant and Soil, 321:305-339.
ROMKENS P, SALOMONS W. 1998. Cd, Cu and Zn solubility in arable and forest soils: Consequences of land use changes for metal mobility and risk assessment[J]. Soil Science, 161:859-875.
ROUSK J, BROOKES P C, BAATH E. 2011. Fungal and bacteria growth responses to N fertilization and pH in the 150-year ‘Park Grass’ UK grassland experiment[J]. FEMS Microbiology Ecology, 76:89-99.
RYAN M H, KIRKEGAARD J A. 2012. The agronomic relevance of arbuscular mycorrhizas in the fertility of Australian extensive cropping systems[J]. Agriculture, Ecosystems and Environment, 163:37-53.
SHENKER M, FAN T W M, CROWLEY D E. 2001. Phytosiderophores influence on cadmium mobilization and uptake by wheat and barley plants[J]. Journal of Environmental Quality, 30:2091-2098.
SINGH B R, NARWAL R P, JENG A S, et al. 1995. Crop uptake and extractability of cadmium in soils naturally high in metals at different pH levels[J]. Communicatios in Soil Science and Plant Analysis,26:2123-2142.
SMITH FA, SMITH SE. 2013. How useful is the mutualism-parasitism continuum of arbuscular mycorrhizal functioning?[J]. Plant and Soil,363:7-18.
SMITH S E, FACELLI E, POPE S, et al. 2010. Plant performance in stressful environments: interpreting new and established knowledge of the roles of arbuscular mycorrhizas[J]. Plant and Soil, 326:3-20.
TANAKA Y, YANO K. 2005. Nitrogen delivery to maize via mycorrhizal hyphae depends on the form of N supplied[J]. Plant Cell and Environment, 28:1247-1254.
THEUERL S, BUSCOT F. 2010. Laccases: toward disentangling their diversity and functions in relation to soil organic mater cycling[J].Biology and Fertility of Soils, 46:215-225.
TYLER G, OLSSON T. 2001. Concentrations of 60 elements in the soil solution as related to the soil acidity[J]. European Journal of Soil Science, 52:151-165.
TYLER L D, MCBRIDE M B. 1982. Influence of cadmium, pH and humic acid on cadmium uptake[J]. Plant and Soil, 64:259-262.
VAN D H M, BARDGETT RD, VAN STRAALEN NM. 2008. Mycorrhizal fungi reduce the negative effects of nitrogen enrichment on plant community structure in dune grassland[J]. Global Change Biology,14:2626-2635.
VAN D H M. 2010. Mycorrhizal fungi reduce nutrient loss from model grassland ecosystems[J]. Ecology, 91:1163-1171.
VOS C, CLAERHOUT S, MKANDAWIRE R, et al. 2012. Arbuscular mycorrhizal fungi reduce root-knot nematode penetration through altered root exudation of their host[J]. Plant and Soil, 354:335-345.
黄小辉,刘芸, 李佳杏, 等. 2012. 水分胁迫对三峡库区消落带桑树幼苗生理特性的影响[J]. 林业科学, 48 (12): 122-127.
凌宏文, 朱书法,朴河春. 2007. 石灰岩和砂岩地区豆科类植物紫花光叶苕(Vicia villosa)中铁和锰的不同分配模式[J]. 地球与环境, 35 (2):97-102.
刘代军, 涂波, 施松梅, 等. 2012. 石漠化地区的生态危机及菌根生物修复潜力研究进展[J]. 中国岩溶, 31 (2): 185-190.
石娟华, 袁玉欣, 李玉灵, 等. 2008. 铁尾矿坝沙棘、桑树人工林生物量分配及根系分布研究[J]. 河北农业大学学报, 31 (4): 30-35.
舒玉芳, 叶娇, 潘程远, 等. 2011. 三峡库区桑树菌根发育特征及菌根对桑苗生长的促进作用[J]. 蚕业科学, 37 (6): 0978-0984.
叶娇, 涂波, 施宋梅, 等. 2012. 桑菌根初生结构对梯度水分胁迫的细胞学生态响应[J]. 西南大学学报 (自然科学版), 34 (8): 67-72.
张光灿, 杨吉华, 赵新明, 等. 1997. 桑树根系分布及水土保持特性的研究[J]. 蚕业科学, 23 (1): 59-60.
郑克举, 唐旭利, 张静, 等. 2013. 季风常绿阔叶林演替系列菌根资源及其与群落多样性的关系[J]. 生态环境学报, 22 (5): 729-738.
