区域及全球尺度的NPP过程模型和NPP对全球变化的响应
2014-05-08冯险峰孙庆龄林斌
冯险峰,孙庆龄, ,林斌
1. 中国科学院地理科学与资源研究所, 北京 100101;2. 中国科学院大学, 北京 100049;3. 武汉大学资源与环境科学学院, 湖北 武汉 430079
植被是陆地生物圈的主体,是全球物质和能量循环的基础(Running, 2012)。植被净第一性生产力(Net Primary Productivity, NPP)作为碳循环和碳收支研究的重要组成部分(Matsushita和 Tamura,2002; Feng等, 2007),被定义为绿色植物在单位时间、单位面积内净增长的有机干物质,是光合作用产生的有机质总量(Gross Primary Productivity, GPP)与植物自养呼吸(Autotrophic Respiration, RA)的差(Lieth和Whittaker, 1975; Liu等, 1997; 周广胜和张新时, 1995; 冯险峰等, 2004)。NPP不仅是表征植被活动和生态过程的关键参数,而且是判定生态系统碳汇和反映生态系统对全球变化响应的主要因子(Fang等, 2000)。当前研究陆地植被NPP的方法有很多,如野外调查、定位观测、模型模拟等。野外调查一般以样方(1~100 m2)为单位搜集植物的根、茎、叶及其凋落部分的生物量数据,以此来获得植被的真实NPP。定位观测,如通量塔观测的数据,则代表了周围数公顷范围内生态系统与大气的碳交换率(0.1~1 km2),在天气允许的情况下,定位观测几乎可以获得每30 min的碳通量数据,因此可以通过通量拆分的方法间接得到分或时时间尺度上的生态系统NPP。但是,野外调查和定位观测的空间范围有限,而且调查和观测的结果不能直接反映生态系统内部的过程和机理,更不能预测未来植被生产力的分布和变化。因此在较大的空间范围或较长的时间尺度,模型模拟成为 NPP研究的主要手段,野外调查和定位观测的数据一般作为验证数据对模型模拟的结果进行检验。
在众多NPP估算模型中(Ruimy等, 1994),过程模型以其完整的理论框架、清晰的过程机理而逐渐趋于主导地位(朱文泉等, 2005)。根据模型应用的空间尺度不同,NPP过程模型可分为斑块尺度的过程模型和区域及全球尺度的过程模型。斑块尺度的过程模型包含以个体为基础的模型和样地水平的过程模型,如20世纪70年代发展起来的林窗模型(Botkin等, 1972)及后来的FOREST-BGC模型、BIOME-BGC模型(Running和Hunt, 1993; Wang等, 2005)等。斑块尺度的NPP模型对机理过程的模拟只需从个体器官水平扩展到冠层尺度,模拟结果可通过校准而达到较高的精度,但其没有或不易于应用到区域及全球尺度的植被生产力评估。在当前全球变化背景下,大尺度植被NPP模拟及其对全球变化的响应已成为多领域研究的热点,因此,本文着重介绍区域及全球尺度的NPP估算过程模型,阐明模型间的区别与联系,总结其应用框架,并详细归纳NPP对全球变化的响应机制。虽然目前NPP研究的综述性文章有很多,但还没有关注于大尺度模型及其模拟的NPP对全球变化的响应,希望本文能为当前或未来的NPP研究提供参考和借鉴。
1 区域及全球尺度的NPP过程模型
1.1 模型概述
当前,已有大量的区域及全球尺度的NPP过程模型(Cramer和 Field, 1999)被广泛使用,如CENTURY、TEM、BEPS、InTEC、CARAIB、DLEM等,这些模型的时空分辨率不一,模拟时侧重点不同,可以说是各有其独到之处。1999年,德国Potsdam专题会议对 17个区域及全球尺度的NPP模型进行了比较研究(Cramer等, 1999),其中大多数是过程模型,可见区域及全球尺度NPP过程模型应用的广泛性及其巨大潜力。区域及全球尺度的过程模型又可根据是否考虑植被的动态分布分为静态植被模型和动态植被模型。
1.1.1 静态植被模型
静态植被模型假定植被分布是不变的,即模型输入的是静态的植被分布数据,没有考虑植被的动态变化。植被分布数据一般通过遥感技术提取或根据气候条件模拟得到,也可以是植被类型图。此类模型有 CENTURY(Parton等, 1993)、TEM(McGuire等, 1997)、BEPS(Liu等, 1997,1999)等。CENTURY模型是通过模拟C、N、P、S的生物地球化学循环,并考虑植被因素和气候驱动因子,而实现对生态系统的生产力进行模拟。CENTURY模型的结构包括一个生物模块、一个土壤有机质模块和一个水分模块。但是该模型没有精细的光合作用模拟,NPP仅是植被因子、气候和其他非生物因子的函数。TEM 模型和CENTURY模型一样都是以月为时间步长的水、碳、氮耦合模型,但是其NPP是根据植物从大气中获得的碳与植物呼吸到大气中的碳的差额表示的。BEPS模型则是一个生态遥感耦合模型,它的输入数据中土地覆盖及植被LAI等都是应用遥感技术获取的,而且 BEPS模型是在斑块尺度的过程模型FOREST-BGC的基础上发展起来的,但拥有更加精细的光合作用模块和冠层辐射传输理论。这些模型由于植被类型确定,植被相应的生理生态参数不变,因此碳在生态系统内的生产和传递过程更多地依赖于气候与土壤条件,并且对初值的要求较高。
1.1.2 动态植被模型
动态植被模型将静态植被模型中固定的初始植被分布替换为依赖于气候和土壤条件的动态植被,或考虑植物的竞争和演替过程,使植被结构和组成特征更接近于实际情况,其实质可认为是预测而不是静态地描述植被状态。模型一般具有2个前提假设:①植被分布与气候条件处于平衡状态并且没有滞后效应;②气候和土壤因子决定不同植被类型的分布特征。此类模型有CARAIB(Warnant等, 1994)、DLEM(Piao等,2012)、ORCHIDEE(Tian等, 2010)等。CARAIB模型基于3个子模型:一个叶面吸收模型、一个冠层模型和一个木质呼吸模型,能够与大气环流模式(GCMs)相耦合来预测全球变化对植被NPP的影响。DLEM是一个高度综合的模拟碳、氮、水循环的过程模型,由4个核心模块组成:生物物理模块、植物生理模块、土壤生物地球化学模块以及动态植被和土地利用模块,其中动态植被和土地利用模块能够反映植被功能型的生物地理重分布以及植物的竞争和演替过程。ORCHIDEE是一个动态耦合的生物地理—生物地球化学模型,包括土壤—植被—大气传输(SVAT)子模块SECHIBA、植被动态子模块和生物地球化学模块STOMATE,SECHIBA能够监测快速的SVAT过程,植被动态子模块可以动态地模拟植被分布,STOMATE则用于植被物候以及重要的碳动态过程的模拟。在区域及全球尺度,动态植被过程模型与GCMs的耦合有助于研究陆地植被NPP对全球变化的响应机制,具体将在下面第2部分进行阐述。
部分区域及全球尺度的 NPP过程模型的详细表达见表1。
1.2 模型间区别与联系
模型的发展是渐进的,一个模型不可能解决所有的问题,当新的问题出现而原有的模型不能解决或原有模型的模拟精度达不到应用要求时,就发展出新的模型。目前已经发展出很多区域及全球尺度的NPP过程模型,这些模型之间既有区别又相互联系。模型间的区别至少包括:①运行步长,见表1;②生态系统碳库的划分,如 TEM 模型将整个生态系统作为一个分类来估算植被碳库,但CENTURY模型中NPP涉及到5个碳库,即叶、粗根、细根、细枝和主干;③NPP的计算方式及其主要影响因子,如CENTURY模型中植被生产力取决于土壤温度、有效水分、LAI和林龄等,但BEPS模型是使用Farquhar光合模型(Farquhar等, 1980)先计算GPP,然后去除掉自养呼吸来得到NPP;④对气候变化的反馈机理,如对于大气 CO2浓度升高,CENTURY模型是直接限制植被N含量,TEM模型则通过改变植被C-N状态作为对其的反馈。对于同一地区、同一时间段,由于使用的模型不同,模拟的结果也会不同,甚至差别很大,如刘明亮(2001)得到的全国 2001年 NPP总量是 Feng等(2007)模拟结果的 2倍多,而王军邦(2004)的研究结果则相当于是两者的平均值(表2)。

表1 部分区域及全球尺度的NPP过程模型Table 1 Several NPP process models in regional and global scales
另一方面,模型之间也是相互联系的,最具代表性的例子就是以 FOREST-BGC为基础发展起来的一系列NPP过程模型,包括BIOME-BGC、BEPS、InTEC等。BIOME-BGC一般是应用于斑块尺度的陆地碳循环模型,BEPS、InTEC则是扩展到区域及全球尺度的生物地球化学循环模型。以FOREST-BGC为基础,BEPS引入了Farquhar光合模型并改进了冠层辐射传输模块,同时引入叶片集聚指数,以减少植被冠层结构对叶面受光和辐射吸收产生的影响,最后提出一个时空升尺度方案来解决 FOREST-BGC在区域尺度应用的问题。但是BEPS模型不能动态地耦合C、N循环,而且没有考虑现实中存在的各种扰动因子及生态系统生产力随林龄的变化关系,于是在BEPS模型的基础上又发展出InTEC模型(Shao等, 2007)。InTEC模型中关于碳循环过程及土壤碳库的描述又与CENTURY模型非常类似,但InTEC模型对土壤碳库的划分更加详细并考虑了扰动因子(如火灾、虫害和砍伐等)和非扰动因子(如气候变化、CO2浓度升高和氮沉降等)对生态系统生产力的影响(Chen等, 2000)。
1.3 模型应用框架
NPP过程模型在区域及全球尺度应用的挑战在于:①时空尺度的扩展;②模型所需的多源数据的获取与融合;③模型模拟结果的检验。区域及全球尺度的NPP过程模型多是在器官(叶片)或个体尺度模型的基础上,通过相应的时空尺度转换策略来进行推广和延伸的,如 BEPS模型考虑光合作用对日气象条件的非线性响应,从而在利用Farquhar光合模型计算日时间尺度上的总光合速率时,对导度(CO2从叶肉细胞到大气)进行积分而非直接对时间进行积分;空间上则通过阳生叶和阴生叶分离的方式,结合冠层辐射传输及LAI的概念实现叶片到冠层再到区域及全球尺度的转换(Liu等, 1999)。此外,还有Amthor(1994)提出的大叶模式,即将冠层作为一个伸展的叶片从而直接将叶片尺度的光合模型扩展到冠层尺度,以及冠层垂直积分的方法,如Leuning(1995)提出的时空积分模型,最后利用植被LAI也可以实现至区域和全球尺度的扩展。
对于多源数据的获取和融合,遥感技术的应用可以说为过程模型注入了新的活力。遥感不但能提供过去几十年的地表和大气数据作为模型的输入参数,而且可以定量化评估输入数据的精度和尺度转换效应,从而减少了模型模拟的不确定性。一般情况下,区域及全球尺度的NPP过程模型中植被指数、叶面积指数、土地利用类型等都是通过遥感解译、分类或反演的方式得到。除此之外,气象和土壤数据也几乎是所有 NPP过程模型都需要的输入参数,有些可能还需要外界扰动等其他数据。

表2 不同模型对2001年中国陆地植被NPP的模拟比较Table 2 Estimations of Chinese terrestrial NPP in 2001
至于模型模拟的精度,目前主要利用实测的生物量数据(长期)或通量观测数据(短期)来进行检验和评价,但它们实质上都是点尺度上的验证,因为可靠的验证数据始终还是基于点的观测数据或样地水平上的实测数据。此外,模型间互相比较的方法也可以提供一致性的检验,能够在一定程度上说明问题,但是由于无法确定哪个模型模拟的结果是准确的,比较依据不充分,因此不提倡使用。
综上所述,无论是模型的过程原理,还是模型所需的输入数据,以及最后结果的检验和评价,区域及全球尺度的 NPP过程模型都面临着全新的挑战,却也因此更具有现实意义,其应用框架可总结为图1。
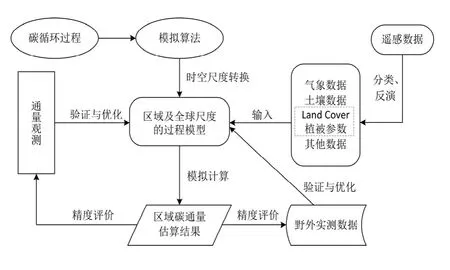
图1 区域及全球尺度的NPP过程模型应用框架Fig.1 Application framework of NPP process models applied in regional and global scales
2 NPP对全球变化的响应
根据周广胜等(2003)的定义,全球变化是指由于自然和人为因素引起的全球性的环境变化,包括气候变化、大气组成成分变化(如CO2浓度的变化),以及由于人口、经济、技术和社会的压力造成的土地利用/土地覆盖的变化3个方面。这3个方面均会对陆地植被NPP产生重要的影响,国内外学者们也在不断地探索NPP对它们的响应机制,下面将详细地归纳各方面的一些研究成果,以期找到NPP变化的规律与模式。
2.1 气候变化
虽然目前关于气候变化的预测还存在很多的不确定性,各种GCMs对气候变化的估计值也不尽相同,但它们所预测的未来气候变化的总体趋势是一致的,可归结为以下4点:①全球平均气温将增加 1.5~4.5 ℃,气候带将向极地方向位移;②夜间增温比白天增温明显,冬季温度增幅比夏季温度增幅大;③全球降水格局有所改变,降水量总体上将增加;④由于蒸散损失的水分远大于降水的增加量,因此中纬度内陆地区的夏季干旱将明显增加(Gates, 1993)。
全球气候变化已是不争的事实,但其对NPP的影响却是不确定的。Bergh(1997)用 BIOMASS模拟得到,由于气候变暖引起生长季延长,挪威云杉NPP升高了20%。Melillo等(1993)利用TEM和GCMs耦合研究了单纯气候变化条件下全球NPP的变化,发现只有在OSU(Oregon State University)气候情景下全球NPP是减小的,而在其他气候情景下都是不变的,分析认为,温度升高引起的土壤中氮素有效性的增强使北方森林、温带落叶阔叶林的NPP增加,而在热带雨林地区,由于植物自养呼吸增强和土壤水分缺失导致 NPP下降。Nemani等(2003)研究了1982—1999年全球NPP的变化,结果表明,全球NPP增加了6%,而云量的减少和辐射的增加(促进了光合作用)使热带雨林NPP增加的贡献达42%。Zhao等(2010)对2000—2009年全球 NPP估算的结果显示,气候变化使全球 NPP减少了0.55 Pg (1 Pg=1015g)的C,其中南半球干旱是最主要的原因。气候变化还将影响生态系统的分布、结构和物种组成,如对于占地球陆地面积约26%的森林生态系统而言,由于气候变暖,温带森林将侵入到当前北方森林带,其南界将被亚热带或热带森林取代,雨林面积也将有所增加(刘国华和傅伯杰, 2001)。鉴于森林在全球碳平衡中的重要地位,其分布或结构的改变也将使全球NPP发生很大的变化。总结认为,NPP对气候变化的响应是图2中多个反馈过程综合作用的结果,其中实线表示正反馈,虚线表示负反馈。
2.2 大气中CO2浓度变化
IPCC第四次评估报告(Fourth Assessment Report, AR4)表明, 全球大气 CO2体积分数已经从前工业化社会的约 280×10-6增加到 2005年的379×10-6,而气候—碳循环之间的正反馈机制预计将使更多的 CO2进入到大气中(见http://www.ipcc.ch/)。一般认为,CO2浓度升高对植物生长具有“施肥”效应,大部分控制实验的结果也表明,CO2浓度升高使植物生长加快从而促进植物生物量的累积,尤其对于C3类植物,其增加的程度可能更大。但并不是所有的植物都对CO2浓度升高具有敏感性,研究表明有些物种对CO2浓度升高是没有反应的(Oechel等, 1994)。
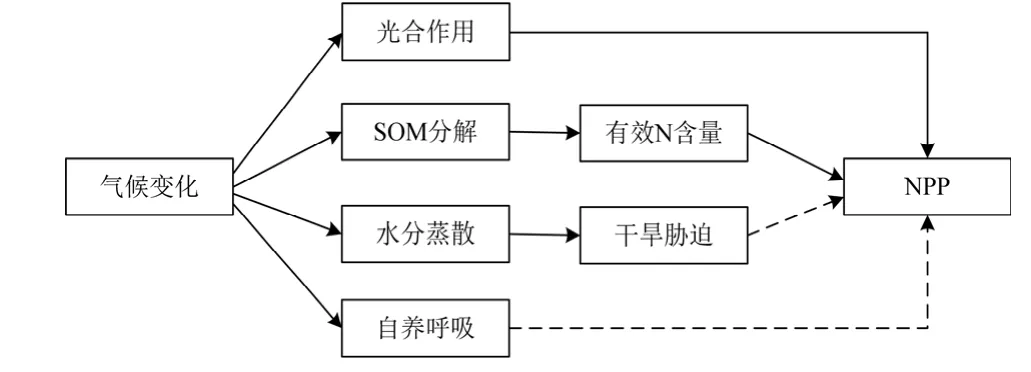
图2 NPP对气候变化的响应机制Fig.2 Response mechanism of NPP to the climate change
模型模拟一般是假设所有陆地植被对CO2浓度升高具有敏感性。Melillo等(1993)模拟CO2浓度加倍(没有气候变化)条件下,全球NPP增加了16.3%,其中寒温带的生态系统由于是受 N限制而对 CO2浓度加倍不敏感,但在干旱地区,CO2浓度加倍使水分利用率提高,从而使 NPP增加了 50%。Friedlingstein等(2006)利用11个气候—碳循环耦合模型比较了在 CO2浓度加倍条件下NPP的变化,结果表明,CO2浓度加倍使温度升高了0.1~1.5 ℃,而各模型模拟的NPP响应范围从0变化到60%,平均达40%。Johnson等(1993)认为随着CO2浓度的升高,C3植物的竞争优势将凸显出来,以 C4植物为优势种的群落更容易被 C3植物入侵;但 Sage等(2003)认为,CO2浓度升高加剧了N对植物生长的限制作用,而C4植物能更有效地利用氮,所以C4植物的优势会得到增强,可以肯定的是,CO2浓度升高会影响植物入侵和生物分布,从而使生态系统NPP发生变化。可见,大气中 CO2浓度的变化对NPP的影响是多方面的:①将使全球大部分植物固定更多的碳;②会带来气候上的变化;③会改变植物种群间的竞争关系,使生态系统结构发生变化。其中,CO2浓度增加引起的全球气候变化是不均一的,至今还无法归纳出一个统一的模式。
2.3 土地利用/土地覆盖变化
据统计,全球的碳有46%贮存在森林中,23%贮存在热带及温带草原,其余的贮存在耕地、湿地、冻原、高山草地及沙漠和半沙漠中(周广胜和王玉辉, 2003)。20世纪以来,土地利用/土地覆盖变化(Land Use and land Cover Change, LUCC)尤其显著,它不仅能够改变下垫面的热力性质(如地表反射率)和动力性质(如表面粗糙度),对气候系统产生影响,还可以通过改变大气中的CO2浓度,进而影响陆地碳循环。1995年,IGBP (International Geosphere-Biosphere Programme) 和 IHDP(International Human Dimension Programme on global environmental change) 共同拟定并发表了《土地利用/土地覆盖变化科学研究计划》,积极推动了LUCC的相关研究(李秀彬, 1996)。
Caspersen等(2000)对美国东部地区碳汇形成的可能原因进行分析后认为,是友好的土地利用方式,而不是CO2施肥效应、N沉降或气候变化,促进了该地区生产力的增长和净碳累积。McGuire等(2001)利用HRBM、IBIS、LPJ和TEM四个过程模型研究 1920—1992年间陆地生物圈的碳平衡,发现LUCC引起的碳通量变化比气候因子引起的变化大得多,而且农田和森林面积增加的时期 NPP均有所上升。高志强等(2004)对中国北方的研究表明,整体上气候变化对区域NPP的影响占主导地位,但在土地利用发生变化的区域,土地利用变化的影响占绝对地位。Niedertscheider等(2012)基于NPP和HANPP对1961—2006年间的南非LUCC进行了综合分析,结果表明,期间由LUCC引起的NPP变化(VNPPlc)占总NPP变化的7%~11%,高于全球5.2%的平均水平,其中,耕地和城市用地变化是VNPPlc产生的最主要因素。根据Matsushita等(2002)的研究,土地覆盖信息对于准确估计NPP至关重要,尤其对于单个的生物群区或植被类型而言,但由于LUCC涉及众多社会经济因素,而且变化快速、复杂,驱动因子间又相互关联,因此对其研究得还不够深入,关于LUCC与NPP之间关系的研究更是不多见,但已引起越来越多的关注与重视。
3 讨论
现今,遥感技术在NPP估算中的应用已经非常普遍,尤其对于区域及全球尺度的NPP过程模型,遥感数据是最重要的数据来源之一(陈利军等,2002)。虽然遥感技术在NPP研究中广为应用,但还是存在很多问题值得谨慎对待。比如对于土地覆盖数据,传统的土地覆盖分类都是考虑功能、生理或生态特征,可能不太适合NDVI-LAI算法,但遥感手段反演LAI时普遍使用的NDVI-LAI线性方程的系数是与土地覆盖类型直接相关的,因此采用适合NDVI-LAI算法的土地覆盖分类数据获取的LAI将更加合理(Loveland等, 1991)。由于较大尺度的NPP模型模拟都是假设栅格单元内的气象条件和土壤因子是均质的而后进行栅格运算,因此引入高分辨率的遥感数据有望能够减小空间异质性带来的误差。
根据NPP形成的生理生态机制:(1)环境因子,尤其是温度,对植被GPP形成和自养呼吸过程的控制是完全基于不同的形式,因此应把总初级生产和自养呼吸看作是 2个独立的过程,在进行NPP估算时,不能简单地在GPP的基础上乘以一个呼吸消耗系数,而应该是从GPP中扣除自养呼吸消耗的部分。(2)植物维持呼吸速率除与温度有关外,和植物组织氮含量也密切相关,但目前很多模型中维持呼吸的计算并没有考虑氮素水平,如TEM、BEPS、SILVAN、TURC、FBM等;对于生长呼吸,其实质是光呼吸,由于缺乏实验研究,大多数模型只是根据光合和光呼吸相伴随的事实,将生长呼吸简单地表示为GPP的函数,更准确的生长呼吸模型还需要进一步地研究。(3)C3和 C4植物的光合作用类型不同,在 NPP估算时应尽量将两者区分开来,尤其是利用 Farquhar光合模型模拟叶片光合作用时,要对C4植物进行模型的修正。(4)Ren等(2011)研究表明,对流层O3浓度对NPP估算结果的影响不可忽略,但当前陆地生态系统模型中考虑O3损耗的还很少,大气组成成分的变化一般只考虑到 CO2浓度的增加,少数模型加入了大气N沉降的影响,未来需重视并加强O3对NPP的损耗效应的研究。
4 总结与展望
(1)陆地植被 NPP是一个非常重要的生态指标,在全球变化研究中具有重要地位。在较大的空间范围或较长的时间尺度,模型模拟成为NPP研究的主要手段。根据模型应用的空间尺度不同,NPP过程模型可分为斑块尺度的过程模型和区域及全球尺度的过程模型。在全球变化背景下,区域及全球尺度的 NPP过程模型被广泛用于估算陆地植被的生产力。
(2)区域及全球尺度的过程模型又可根据是否考虑植被的动态分布分为静态植被模型和动态植被模型,这些模型间既有区别又有联系。NPP过程模型在区域及全球尺度上的应用具有3大挑战:时空尺度的扩展、模型所需的多源数据的获取与融合以及模型模拟结果的检验,根据其解决方案进行综合,归纳出了一个通用的应用框架。
(3)全球变化对陆地生态系统产生了很大影响,并进而影响到陆地植被NPP。一般认为,全球变化包括气候变化、大气成分变化(主要是大气中CO2浓度变化)和土地利用/土地覆盖变化3个方面。NPP对全球变化的响应是多方面的,是多过程综合作用的一个结果,而且响应具有地域差异,目前还无法归纳出适合任意地区的统一模式。
(4)虽然遥感技术在NPP研究中广为应用,但还是存在很多不确定性,在具体估算过程中要谨慎对待;相反,NPP形成的生理生态机制相对比较清晰,模拟时应尽量使模拟的过程与实际生理生态过程相符合,避免出现机理上的错误。
根据近年来NPP模型的发展可以看出:(1)区域及全球尺度的 NPP过程模型逐渐考虑了系统的动力学特征(王绍强和陈育峰, 1998),集成了陆地表层碳循环的各个动态过程,因此未来模型的综合性将更高,机理性也将更强;(2)模型与全球变化研究结合得将更加紧密,目前很多模型考虑到CO2等大气组成成分的变化,有些模型还加入了干扰因子,尤其是人为因素的影响,积极探讨由此产生的生态系统 NPP与大气之间的动态响应以及相互作用;(3)基于多个已有模型的混合模型也是未来NPP模型发展的一个重要方向,如Peng等(2002)将森林生产模型(3-PG)、森林生长和产量模型(TREEDYN 3.0)以及土壤-碳-氮模型(CENTURY 4.0)整合在一起,提出了基于3个过程模型的混合模型TRIP-LEX模型。除此之外,由于大尺度模型无法考虑地面栅格单元内植被、地形以及气候条件等的异质性,因此对NPP模拟结果的尺度效应研究也将是未来 NPP研究的热点之一(Simic等, 2004;Chen 等, 2013)。
AMTHOR J S. 1994. Scaling CO2photosynthesis relationships from the leaf to the canopy[J]. Photosynthesis Research, 39(3): 321-350.
BERGH J. 1997. Climatic and nutritional constraint to productivity in Norway spruce[D]. Silvestria: Acta Universitatis Agriculturae Sueciae:34.
BOTKIN D B, JANAK J F, WALLIS J R. 1972. Some ecological consequences of a computer model of forest growth[J]. Journal of Ecology, 60(3): 849-873.
CASPERSEN J P, PACALA S W, JENKINS J C, et al. 2000. Contributions of land-use history to carbon accumulation in US forests[J]. Science,290(5494): 1148-1151.
CHEN J M, CHEN X, JU W. 2013. Effects of vegetation heterogeneity and surface topography on spatial scaling of net primary productivity[J].Biogeosciences Discussions, 10(3): 4879-4896.
CHEN J, CHEN W, LIU J, et al. 2000. Annual carbon balance of Canada’s forests during 1895-1996[J]. Global biogeochemical cycles, 14(3):839-849.
CRAMER W, FIELD C B. 1999. Comparing global models of terrestrial net primary productivity (NPP): Introduction[J]. Global Change Biology,5(S1): iii-iv.
CRAMER W, KICKLIGHTER D W, BONDEAU A, et al. 1999. Comparing global models of terrestrial net primary productivity (NPP): overview and key results[J]. Global Change Biology, 5(S1): 1-15.
FANG J, TANG Y H, LIN J D, et al. 2000. Global ecology: Climate change and ecological responses[M]. Beijing: Chinese Higher Education Press,Heidelberg: Springer-Verlag: 1-10.
FARQUHAR G D, CAEMMERER S V, BERRY J A. 1980. A biochemical model of photosynthetic CO2assimilation in leaves of C3species[J].Planta, 149(1): 78-90.
FENG X F, LIU G H, CHEN J M, et al. 2007. Net primary productivity of China's terrestrial ecosystems from a process model driven by remote sensing[J]. Journal of Environmental Management, 85(3): 563-573.
FRIEDLINGSTEIN P, COX P, BETTS R, et al. 2006. Climate-carbon cycle feedback analysis: Results from the C4MIP model intercomparison[J].Journal of Climate, 19(14): 3337-3353.
GATES D M. 1993. Climate change and its biological consequences[M].Sunderland, MA: Sinauer Associates: 45-87.
JOHNSON H B, POLLEY H W, MAYEUX H S. 1993. Increasing CO2and plant-plant interactions: effects on natural vegetation[J]. Vegetatio,14(104/105): 157-170.
LEUNING R. 1995. Critical appraisal of a combined stomatal-photosynthesis model for C3plants[J]. Plant, Cell and Environment, 18(4): 339-355.
LIETH H, WHITTAKER R H. 1975. Primary productivity of the biosphere[M]. New York: Springer-Verlad Press: 1-10.
LIU J, CHEN J M, CIHLAR J, et al. 1997. A process-based boreal ecosystem productivity simulator using remote sensing inputs[J].Remote Sensing of Environment, 62(2): 158-175.
LIU J, CHEN J M, CIHLAR J, et al. 1999. Net primary productivity distribution in the BOREAS region from a process model using satellite and surface data[J]. Journal of Geophysical Research,104(D22): 27735-27754.
LOVELAND T R, MERCHANT J W, OHLEN D O, et al. 1991.Development of a land cover characteristic data base for the conterminous US[J]. Photogrammetric Engineering and Remote Sensing, 57(11): 1453-1463.
MATSUSHITA B, TAMURA M. 2002. Integrating remotely sensed data with an ecosystem model to estimate net primary productivity in East Asia[J]. Remote Sensing of Environment, 81(1): 58-66.
MCGUIRE A D, MELILLO J M, KICKLIGHTER D W, et al. 1997.Equilibrium responses of global net primary production and carbon storage to doubled atmospheric carbon dioxide: Sensitivity to changes in vegetation nitrogen concentration[J]. Global Biogeochemical Cycles,11(2): 173-189.
MCGUIRE A D, SITCH S, CLEIN J S, et al. 2001. Carbon balance of the terrestrial biosphere in the twentieth century: Analyses of CO2, climate and land use effects with four process‐based ecosystem models[J].Global Biogeochemical Cycles, 15(1): 183-206.
MELILLO J M, MCGUIRE A D, KICKLIGHTER D W, et al. 1993. Global climate change and terrestrial net primary production[J]. Nature,363(6426): 234-240.
NEMANI R R, KEELING C D, HASHIMOTO H, et al. 2003.Climate-driven increases in global terrestrial net primary production from 1982 to 1999[J]. Science, 300(5625): 1560-1563.
NIEDERTSCHEIDER M, GINGRICH S, ERB K H. 2012. Changes in land use in South Africa between 1961 and 2006: an integrated socio-ecological analysis based on the human appropriation of net primary production framework[J]. Regional Environmental Change,12(4): 715-727.
OECHEL W C, COWLS S, GRULKE N, et al. 1994. Transient nature of CO2fertilization in Artic tundra[J]. Nature, 371: 500-503.
PARTON W J, SCURLOCK J M O, OJIMA D S, et al. 1993. Observations and modeling of biomass and soil organic matter dynamics for the grassland biome worldwide[J]. Global biogeochemical cycles, 7(4):785-809.
PENG C H, LIU J X, DANG Q L. 2002. TRIPLEX: A generic hybrid model for predicting forest growth and carbon and nitrogen dynamics[J].Ecological Modelling, 153(1-2): 109-130.
PIAO S L, TAN K, NAN H J, et al. 2012. Impacts of climate and CO2changes on the vegetation growth and carbon balance of Qinghai–Tibetan grasslands over the past five decades[J]. Global and Planetary Change, 98-99: 73-80.
REN W, TIAN H, TAO B, et al. 2011. Impacts of tropospheric ozone and climate change on net primary productivity and net carbon exchange of China's forest ecosystems[J]. Global Ecology and Biogeography, 20(3):391-406.
RUIMY A, SAUGIER B, DEDIEU G. 1994. Methodology for the estimation of terrestrial net primary production from remotely sensed data[J]. Journal of Geophysical Research: Atmospheres (1984–2012),99(D3): 5263-5283.
RUNNING S W, HUNT E R. 1993. Generalization of a forest ecosystem process model for other biomes, BIOME-BGC, and an application for global-scale models[C] // EHLERINGER J R, FIELD C B. Scaling Physiologic Processes: Leaf to Globe.; San Diego, CA: Academic Press: 141-158.
RUNNING S W. 2012. A measurable planetary boundary for the biosphere[J]. Science, 337(6101): 1458-1459.
SAGE R F, KUBIEN D S. 2003. Quo vadis C4? An ecophysiological perspective on global change and the future of C4 plants[J].Photosynthesis Research, 77(2-3): 209-225.
SHAO Y, PAN J, YANG L, et al. 2007. Tests of soil organic carbon density modeled by InTEC in China’s forest ecosystems[J]. Journal of Environment Management, 85(2007): 696-701.
SIMIC A, CHEN J M, LIU J, et al. 2004. Spatial scaling of net primary productivity using subpixel information[J]. Remote Sensing of Environment, 93(1-2): 246-258.
TIAN H, CHEN G, LIU M, et al. 2010. Model estimates of net primary
productivity, evapotranspiration, and water use efficiency in the terrestrial ecosystems of the southern United States during 1895-2007[J]. Forest Ecology and Management, 259(7): 1311-1327.WANG Q, MASATAKA W, ZHU O. 2005. Simulation of water and carbon fluxes using BIOME-BGC model over crops in China[J]. Agricultural and Forest Meteorology, 131(3): 209-224.
WARNANT P, FRANCOIS L, STRIVAY D, et al. 1994. CARAIB: a global model of terrestrial biological productivity[J]. Global Biogeochemical Cycles, 8(3): 255-270.
ZHAO M, RUNNING S W. 2010. Drought-induced reduction in global terrestrial net primary production from 2000 through 2009[J]. Science,329(5994): 940-943.
陈利军, 刘高焕, 冯险峰, 等. 2002. 遥感在植被净第一性生产力研究中的应用[J]. 生态学杂志, 21(2): 53-57.
冯险峰, 刘高焕, 陈述彭, 等. 2004. 陆地生态系统净第一性生产力过程模型研究综述[J]. 自然资源学报, 19(3): 369-378.
高志强, 刘纪远, 曹明奎, 等. 2004. 土地利用和气候变化对区域净初级生产力的影响[J]. 地理学报, 59(4): 581-591.
李秀彬. 1996. 全球环境变化研究的核心领域:土地利用/土地覆被变化的国际研究动向[J]. 地理学报, 51(5): 553-557.
刘国华, 傅伯杰. 2001. 全球气候变化对森林生态系统的影响[J].自然资源学报, 16(1): 71-78.
刘明亮. 2001. 中国土地利用/土地覆盖变化与陆地生态系统植被碳库和生产力研究[D]. 北京:中国科学院遥感应用研究所: 80-102.
王军邦. 2004. 中国陆地净生态系统生产力遥感模型研究 [D]. 杭州:浙江大学: 91.
王绍强, 陈育峰. 1998. 陆地表层碳循环模型研究及其趋势[J]. 地理科学进展, 17(4): 64-72.
周广胜, 王玉辉. 2003. 全球生态学[M]. 北京:气象出版社: 17.
周广胜, 张新时. 1995. 自然植被净第一性生产力模型初探[J]. 植物生态学报, 19(3): 193-200.
朱文泉, 陈云浩, 徐丹, 等. 2005. 陆地植被净初级生产力计算模型研究进展[J]. 生态学杂志, 24(3): 296-300.
