源地沙尘对南海东北部海域异养细菌生物量及群落结构的影响
2014-05-08侯瑞白洁高会旺赵阳国张晓浩
侯瑞,白洁*,高会旺,赵阳国,张晓浩
1. 中国海洋大学海洋环境与生态教育部重点实验室,山东 青岛 266100;2. 中国海洋大学环境科学与工程学院,山东 青岛 266100
海洋异养细菌是海洋生态系统中物质循环和能量流动的重要组成部分,在海洋环境中占有重要地位(赵三军等,2003)。由于海洋异养细菌数量大、繁殖速度快、转换效率高、生物量循环迅速,海水中的氮、磷等营养盐常常成为影响异养细菌生长的重要限制因子(Rivkin等,1997)。沙尘沉降作为陆源营养物质和污染物质向海洋输送的重要途径,是海洋中这些限制性营养元素的重要来源(Griffin等,2004;高会旺等,2009)。因此,沙尘沉降对于海洋异养细菌的作用,尤其是对贫营养海域异养细菌生长的影响十分巨大。相关研究发现,沙尘沉降不仅可以显著影响海洋异养细菌的生物量和活性(Herut等,2005;Pulido-Villena等,2010),还能够使细菌的群落结构发生一定的变化(Lekunberri等,2010)。
南海是我国面积最大的海域,具有典型的大洋特征,属于贫营养海区(袁梁英,2005),其海水中异养细菌数量较小且分布不均,极易受外界营养物质的影响(Yuan等,2011)。而且南海是亚洲沙尘沉降的主要区域(Gao等,1997),沙尘所携带的营养物质在一定程度上缓解了南海的海水营养限制(Wong等,2002),对南海贫营养海区异养细菌的生长有积极的影响。Guo等(2013)对南海北部的研究中发现,沙尘气溶胶的添加可以促进异养细菌的生长,并使细菌的异养程度进一步加大;但由于没有去除浮游动物的摄食压力,其研究中并未出现异养细菌生物量的显著增加,细菌群落结构也没有出现明显变化。并且,沙尘在远距离输运过程中与会与空气中的污染物相互作用,使其含有重金属和有毒有机物等,从而可能对海洋生物和生态系统产生损害效应(高会旺等,2009)。因此,为了单纯考虑沙尘中营养物质对南海营养限制的缓解和对异养细菌生长的促进;在去除摄食压力的条件下,进行源地沙尘对南海异养细菌生物量和群落结构影响的研究具有重要的科学意义。
本论文拟在已有研究的基础上,通过对南海东北部海域海洋异养细菌进行沙尘富集模拟培养研究,在单独添加两种沙尘和耦合添加营养盐与沙尘的情况下,观察沙尘的营养物质溶出情况和培养体系内细菌生物量的变化,讨论两种沙尘对南海异养细菌生长的短期和长期影响;分析不同的沙尘添加组培养始末的细菌群落结构的变化,探讨异养细菌群落结构对沙尘添加的响应机制。
1 材料与方法
1.1 沙尘采集处理
采集中国沙尘暴沙源地之一库布奇沙漠包头附近的表层沙尘样品,用干净无菌的 PET瓶 4 ℃保存。在实验室对沙尘过网筛进行粒径分级,分为直径25 μm以下(标记为D1)和直径150 μm(标记为 D2)以下的沙尘样品,分别保存。因为小于40 μm的沙尘是能够形成沙尘暴的粒径范围,所以用粒径25 μm以下的沙尘D2代表能够漂浮到空中形成沙尘暴的沙尘部分,用粒径150 μm以下的沙尘样品D1代表原位沙尘。
1.2 沙尘沉降模拟培养
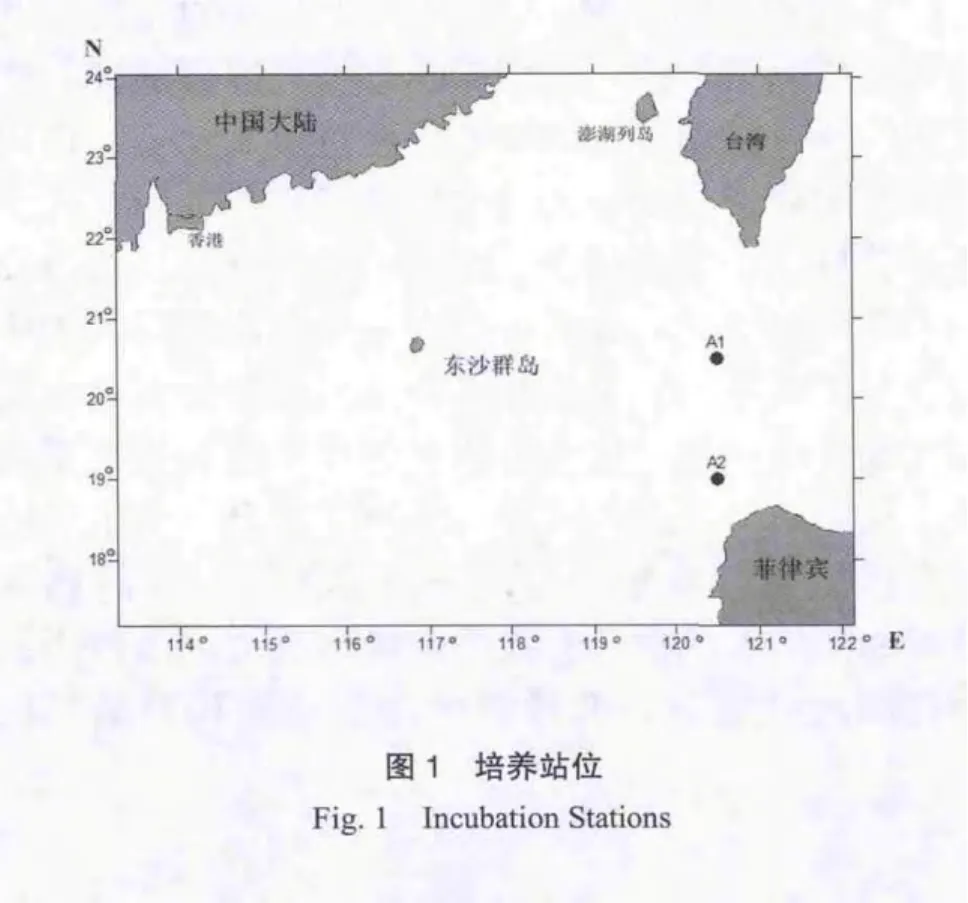
于2013年3月份利用 “东方红2号” 科学考察船 , 在 南 海 东 北 部 A1(20.50°N,120.50°E)、A2(19.00°N,120.50°E)作为采水站位(图 1)。由CTD采水器(Seabird 25,USA)采集3 m深的表层海水并测得其初始温度、盐度和PH等现场数据。溶解氧DO由WTW 500i便携水质分析仪测得。水样采集后,通过63 μm的筛绢过滤以除去大型浮游动物,装于1.5 L无菌的PET瓶中,在通有循环海水的培养箱中进行培养。在A1站做长时间培养,时间为7 d;A2为短时间培养站,时间为3 d。
培养共分为 6组:对照组、D1、D2、N+P、D1+N+P、D2+N+P,每个组都包含3个平行。其中,添加的D1为粒径150 μm的沙尘、D2为粒径25 μm的沙尘、添加的N为KNO3、P为KH2PO4。添加营养物的量为沙尘添加量为0.05 g·L-1。分别在每天的固定时间在无菌的条件下取培养系统的细菌样品。取样时,用WTW 500i便携水质分析仪测定培养瓶中的温度、盐度、pH、DO等现场数据。在培养结束后,在无菌的条件下用0.22 μm的核孔膜过滤瓶中的海水作为分子生物学样品,于-80 ℃保存。
培养进行的同时,参照 Lekunberri等在 2010年的沙尘营养物质溶出的方法,将两种沙尘添加到通过0.22 μm核孔膜过滤的海水中进行溶出实验。溶出实验的沙尘添加量与培养条件相同,在溶出1 d后取DOC和营养盐样品。
1.3 DOC和营养盐
DOC样品用高温燃烧氧化法由岛津TOC-V型总有机碳测定仪测定(Knap等,1994)。
1.4 异养细菌生物量
将细菌样品过滤到0.22 μm的核孔膜上,经过DAPI染色,用Leica Dmla荧光显微镜进行计数。用换算因子20 fg·cell-1将异养细菌数量换算为以碳单位表示的细菌的生物量(赵三军等,2003)。
1.5 异养细菌群落结构
1.5.1 DNA提取与扩增
采用美国产环境微生物样品总群落基因组DNA提取(PowerSoil_DNA提取)试剂盒提取总DNA。采用16S rRNA基因通用引物,以总DNA为模板,进行PCR扩增。PCR 引物采用真细菌16S rRNA 通用引物,分别为 BA101F:5’-TGGCGGACGGGTGAGTAA-3’; BA534R :5’-ATTACCGCGGCTGCTGG-3’。引物 BA534R 的5’端有一个40 bp的GC夹,由Invitrogen合成。PCR反应程序为:预变性94 ℃,5 min;并接以30个循环包括,94 ℃变性40 s,55 ℃退火40 s,每一循环降0.1 ℃,72 ℃延伸1 min,循环完毕,72 ℃延伸5 min。
1.5.2 DGGE分析
采用Bio-Rad公司DcodeTM基因突变检测系统进行DGGE分析。电泳结束后,剥胶银染,并扫描获取胶图。将DGGE图谱数字化,以同一迁移率下,有条带计为1,无条带计为0。采用SPSS软件(SPSS Inc., Chicago IL)对各泳道群落进行聚类分析,并进行 Shannon-Weiner多样性指数(H′)分析,H′通过公式H′ = −∑PilnPi计算,其中Pi是泳道中条带的相对信号强度。
1.5.3 序列测定与分析
选取数量较大或变化较大的条带回收 DNA(Schwirger等,1998)。取回收的 DNA为模板,以产生该DGGE图谱相同的不带GC夹的引物,采用同前体系和PCR程序进行扩增,PCR产物切胶纯化(德国,Nucleo Spin ExtractⅡ,Macherey-Nagel生产)后,按产品说明书克隆 T-载体(PMD19-T,宝生物)。对转化子的筛选采用了蓝白斑及PCR的方法,PCR直接以白斑菌落为模板,采用能与 T-载体插入点两侧特异结合的M13通用引物进行检测。每条带选取5个阳性克隆,同样以M13通用引物进行测序。
将所有序列提交到 RDP Ⅱ数据库中进行在线分类,同时计算各类群的比例。下载相似序列后,采用Clustal W对齐序列并去除冗余序列后,应用MEGA 4.0软件以相邻法绘制系统进化树。
1.6 数据处理
采用SPSS软件(SPSS Inc., Chicago IL)中多因素方差分析计算各培养分组的结果之间的差异显著性;应用 Correlate 程序计算分析不同指标类型结果之间的相关性。
2 结果与讨论
2.1 站位初始环境特征和沙尘溶出情况
A1、A2站位都位于南海东北部巴士海峡区域,它是南海连通大洋的唯一深水通道,有着重要的地理位置(李立,2002)。2个站位现场环境情况见表1,其表层海水都处于高水温、高盐度和高pH值的状态。A1站位的DOC、DIN和磷酸盐浓度都处于较低的水平,与Yuan等(2011)在附近海域的观测值(DOC:70 μmol·L-1,DIN:4 μmol·L-1,:0.1 μmol·L-1)相比;2个站位的DOC浓度均低于检测值,A2站的DIN浓度相对较低,而2个站位磷酸盐浓度则较高。根据Fisher等(1992)提出营养盐的限制浓度 DIN:2 µmol·L-1,:0.2 µmol·L-1;可知A2可能受氮限制,A1可能受到磷限制。2个站位异养细菌丰度与 He等(2009)对邻近海域的观测值对比(异养细菌丰度:(1.6±0.8)×106cell·mL-1),可知A2站异养细菌水平正常,而A1站可能处于异养细菌暴发的状态。
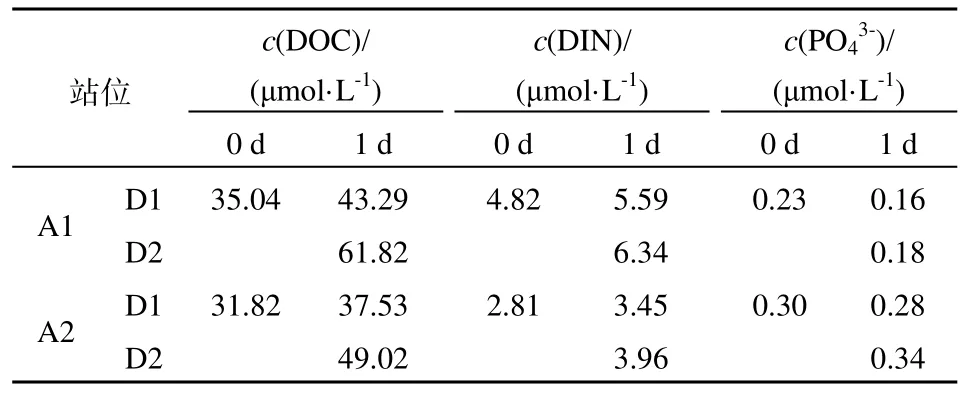
表2 1 d内沙尘溶出情况Table 2 Nutrient concentration dissolution from dust
在2个站位的沙尘溶出实验中,添加沙尘1 d时各种营养物质的浓度均发生了一定变化(表2)。在A1站,原位沙尘D1的添加分别使DOC和DIN浓度增加了 8.25 μmol·L-1和 0.77 μmol·L-1;而小粒径沙尘D2的添加使DOC和DIN浓度分别增加了26.76 μmol·L-1和 1.52 μmol·L-1;两种沙尘的添加没有使培养体系中磷酸盐浓度得以增加。同样在 A2站,原位沙尘D1的添加分别使DOC和DIN浓度增加了 5.71 μmol·L-1和 0.64 μmol·L-1,而小粒径沙尘D2的添加分别使培养体系中DOC和DIN浓度增加了 17.20 μmol·L-1和 1.15 μmol·L-1;A2 站位的磷酸盐浓度在1 d内也没有发生明显变化。
两种沙尘在1 d内基本没有溶出磷酸盐,原位沙尘D1和小粒径沙尘D2的添加平均分别使初始海水的DOC增加了0.21倍和0.65倍,使DIN浓度平均分别增加了0.19倍和0.36倍。结果说明,本次研究中所用的沙尘能够在短时间内能缓解海水中的营养限制,特别是DOC和氮限制;而能够形成沙尘暴的小粒径沙尘在短期内溶出的营养物质比原位沙尘多,在短期内对海水异养细菌的影响更大。
2.2 异养细菌生物量的变化
根据图2结果,沙尘和营养盐的不同添加组均使培养体系中异养细菌生物量相对于对照组出现了明显增长(P<0.05)。在A1站,培养周期7 d内除对照组外,各组的异养细菌生物量都出现了增长。其中D2组的细菌生物量在第3天达到最大值0.109 mg·L-1,是对照组的2.79倍;D1组在第6天才达到最大值0.099 mg·L-1,是对照组的3.19倍。然而,沙尘与营养盐联合添加的培养组则呈现出不同的趋势。由于氮和磷的添加,这三个组的异养细菌生物量短期内会迅速增长,分别在第2天达到最大值; NP组为0.155 mg·L-1,是对照组的3.23倍;D1+NP组为 0.164 mg·L-1,是对照组的 3.42倍;D2+NP为 0.188 mg·L-1,是对照组的 3.92倍。与A1相似的结果,A2站的3 d的短期培养中,对照组的异养细菌生物量缓慢下降;NP组、D1+NP组和D2+NP组的细菌生物量均在第2天达到了最大值;NP组为 0.114 mg·L-1,是对照组的 3.17倍;D1+NP组为 0.120 mg·L-1,是对照组的 3.33倍;D2+NP为 0.133 mg·L-1,是对照组的 3.69倍。而D1组和D2组细菌生物量则一直呈现上升趋势;其中在第3天时,D2组的细菌生物量为0.055 mg·L-1,是对照组的 1.96倍;D2组的细菌生物量为 0.072 mg·L-1,是对照组的2.57倍。
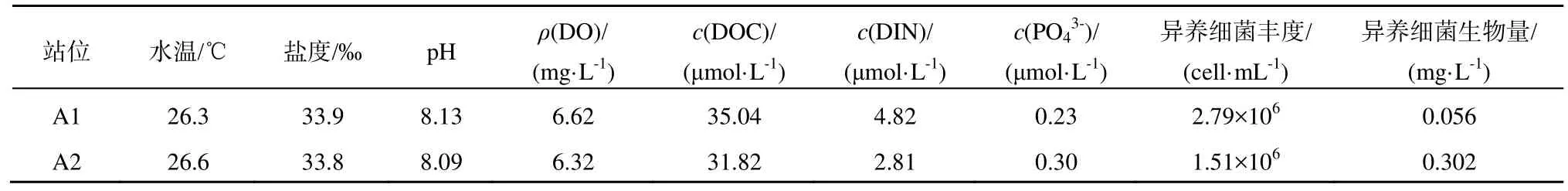
表1 站位环境初始值Table 1 Initial environmental factors of the stations
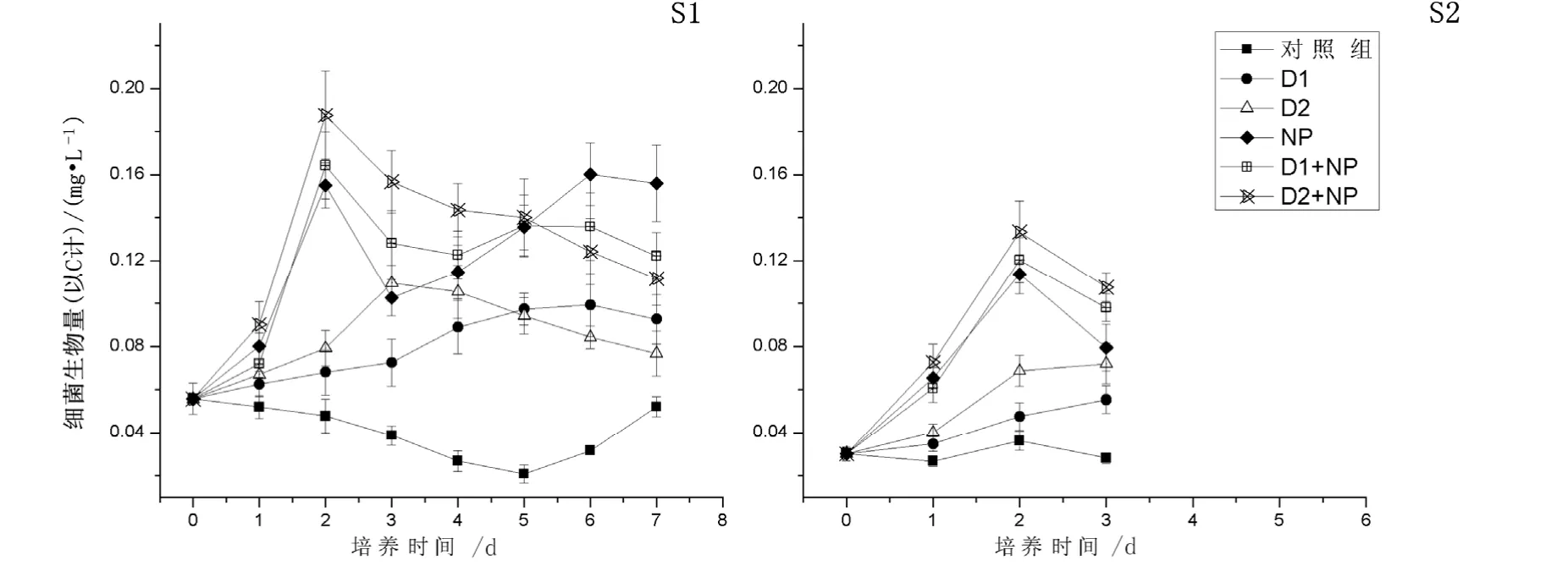
图2 不同营养物添加组细菌生物量的变化Fig. 2 Variation of bacterial biomass among different treatments
在2个站位第3天,添加原位沙尘的D1组和添加小粒径沙尘D2组的细菌生物量都明显大于对照组(P<0.05),而且D2组的细菌生物量明显大于D1组(P<0.05);在联合添加氮和磷的情况下,添加原位沙尘的D1+NP组和添加小粒径沙尘D2+NP组的细菌生物量比只添加氮和磷的NP组大,但不明显(P>0.05),生物量在D1+NP组与D2+NP组之间也不存在显著差异性(P>0.05)。这说明在营养受限制的情况下,两种沙尘的添加均可在短期内极大地促进异养细菌的生长,而能够形成沙尘暴的小粒径沙尘对异养细菌生长的影响尤为明显;在营养不受限制的情况下,沙尘的添加对细菌生物量的增加的促进作用不明显。
在A1站培养第7天时,NP组的细菌生物量明显大于D1+NP组和D2+NP组(P<0.05);D1组和D2组的细菌生物量明显大于对照组(P<0.05);而细菌生物量在D1+NP组与D2+NP组之间和D1组与D2组之间都没有显著性差异(P>0.05)。这说明,在营养盐受限制的情况下,沙尘的添加长期内会促进异养细菌的生长;在营养盐充足的情况下,沙尘的添加在长期内会抑制异养细菌的生长;而小粒径沙尘和原位沙尘对异养细菌生物量的长期影响差别不大。
2.3 细菌群落结构变化
因为在贫营养条件下沙尘对异养细菌的生物量影响更为明显,所以本研究对A1站的D1组和D2组在培养7 d前后的细菌群落结构进行研究。图3-A是A1站添加沙尘培养7 d前后海水中细菌群落结构变化的DGGE指纹图谱,分别对应了A1站位分别在培养前0 d时、D1组和D2组7 d时的细菌群落结构情况。根据聚类分析图3-B,初始0 d的样品与2个培养7 d后样品相似性平均为47%,而2个培养7 d后样品之间的相似性为60%。对各样品DGGE条带多样性分析的结果,培养0 d样品的香农指数(H’)最大,7 d的培养后添加沙尘D1的D1-7d样品的香农指数(H’)大于添加沙尘D2的D2-7d样品。结果说明,在A1站培养初始0 d的细菌群落功能多样性最高且与其余样品相似度最差,添加D1和D2两种沙尘培养7 d后的细菌群落结构会相对简化,其中添加小粒径沙尘 D2在培养 7 d后的细菌群落结构多样性最低。之前研究也出现添加沙尘后,能够利用沙尘溶出营养物质的细菌会大量地生长繁殖,使细菌群落结构趋于简单,物种多样性出现降低的情况(Schafer等,2001;Guo等,2013)。
从DGGE图中可明显分辨出10个条带,编号为1-10。可以发现,不同样品在 DGGE 上呈现的条带在数目与亮度上均存在差异。细菌条带数目的多少可以反映出样品中优势细菌菌群的多少,而同一位置条带亮度的不同,则可反映出不同样品中优势细菌数量的差异。从整体看,样品0 d的优势菌最多,样品 D1-7d、D2-7d中优势菌较少,并且优势菌数量和种类较为一致。对比添加沙尘培养前后细菌群落中优势菌的变化,发现培养前的优质菌条带1、条带5的和条带8代表的在培养后失去了优势地位;条带4、条带10在培养前后均为优势菌;而条带2、条带3、条带6和条带9在培养结束后成为优势菌。这说明,在添加两种不同沙尘后细菌的群落结构发生了一定的变化,而且两种沙尘添加后的群落结构相似。
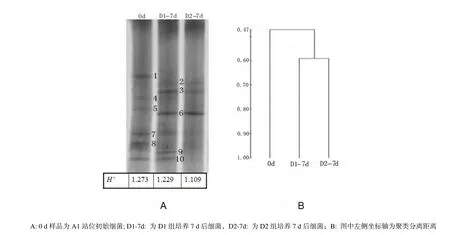
图3 A1站位培养前后细菌群落DGGE (A)与聚类分析图谱(B)Fig. 3 Bacterial DGGE profiles and Cluster analysis trees of A1 station samples
将典型条带1-10进行克隆测序后,采用RDP中的Sequence Match程序与已知序列对比,并构建系统发育树,结果如图4。结果表明,这10个克隆属于细菌界,主要分布于 α-变形菌纲( Alphaproteobacteria ) 、 γ-变 形 菌 纲(Gammaproteobacteria)、鞘脂杆菌纲(Sphingobacteria)、疣微菌纲(Verrucomicrobiae)、叶绿体(chloroplast)和放线菌(Actinobacteria)。其中,γ-变形菌纲(Gammaproteobacteria)和 α-变形菌纲(Alphaproteobacteria)一直是细菌群落中的优势菌,并且培养后它们的优势均进一步增大(条带2、条带4、条带6和条带9),成为培养结束后的最优势菌群;这是因为它们都能够快速适应对外界环境的变化,其中γ-变形菌纲能够适应外部事件对生存环境的不规则扰动,并能直接利用外源DOC作为生长的碳源,而α-变形菌纲则会更多的从浮游植物的暴发中获得生长需要的营养物质(Pukall等,1999)。另外,培养后鞘脂杆菌(Sphingobacteria)也成为优势菌(条带 3);而疣微菌纲(Verrucomicrobiae)和叶绿体(chloroplast)在沙尘添加培养后的明显减小(条带1、条带5)。细菌群落结构的变化说明了沙尘的添加培养后,细菌群落中异养菌群优势凸显,自养菌相对衰弱,细菌群落的异养程度增大。
3 结论
1)南海东北部两个典型站位A1、A2都属贫营养状态,其异养细菌丰度相对较低。本次研究中的沙尘能够在短时间内溶出DOC和DIN,并且小粒径沙尘D2在段时间内溶出的营养物质较多,平均使系统中DOC和DIN浓度增加了0.65倍和0.36倍。
2)添加沙尘后,2个站位的培养系统中异养细菌生物量出现不同程度增长。在短期内,两种沙尘的单独添加均可极大地促进异养细菌的生长,而能够形成沙尘暴的小粒径沙尘对异养细菌生长的影响尤为明显;在添加氮和磷的情况下,两种沙尘的添加对异养细菌生物量的增加的促进作用不明显。长时间培养后,沙尘的单独添加会促进异养细菌生物量的增加,而在添加沙尘和磷的情况下,两种沙尘的添加会抑制异养细菌生物量的增长;而且小粒径沙尘和原位沙尘对异养细菌生物量的长期影响差别不大。
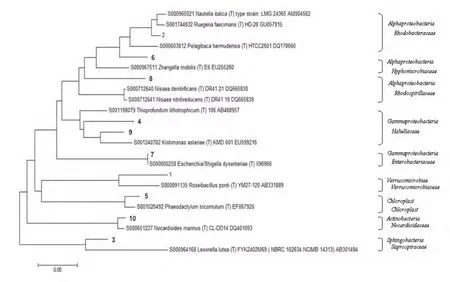
图4 DGGE优势条带系统发育图谱Fig. 4 Phylogenetic tree of constructed by the sequences of t he excised DGGE bands
3)对A1站的在单独添加两种沙尘培养7 d前后的细菌群落结构分析的对比发现:添加两种沙尘后,能够利用外源营养的 α-变形菌纲( Alphaproteobacteria) 和 γ-变 形 菌 纲(Gammaproteobacteria)成为培养结束后的优势菌群,而且细菌群落的异养程度进一步增大;并且细菌群落的生物多样性会降低,细菌群落结构出现简化的趋势。两种沙尘的添加后细菌的群落结构的变化基本一致,而小粒径沙尘D2的添加使得细菌群落多样性的降低最明显。
FISHER T R, PEELE E R.1992. Ammerman J.W., Harding LW. Nutrient limition of hytoplankton in Chesapeake Bay [J]. Marine Ecology Progress Series, 82: 51-63.
GAO Y, AROMOTO R, Duce R A, et al. 1997.Temporal and spatial distribution of dust and its deposition to the China Sea [J]. Tell Us,49B: 172-189.
GRIFFIN D W, KELLOGG C A. 2004.Dust storms and their impact on ocean and human health: Dust in earth atmosphere [J]. Eco Health, 1:284-295.
GUO C, JING H, KONG L, et al. 2013. Effect of East Asian aerosol enrichment on microbial community composition in the South China Sea [J]. Journal of Plankton Research, 35: 485-503.
HE L, YIN K, YUAN X C, LI D M, et al.2009.Spatial distribution of viruses,bacteria and chlorophyll in the northern South China Sea [J]. Aquatic Microbial Ecology, 54: 153-162.
HERUT B, ZOHARY T, KROM M D, et al. 2005. Response of East Mediterranean surface water to Saharan dust: On-board microcosm experiment and fi eld observations[J]. Deep-Sea Research II, 52:3024-3040.
KNAP A, MICHAELS A, CLOSE A, et al. 1994. Protocols for the Joint Global Ocean Flux Study (JGOFS) Core Measurement. Scientific Committee on Oceanic Research Manual and Guides[S]. Paris:UNESCO, 29: 10-243.
LEKUNBERRI I, THOMAS L, ESTELA R.2010.Effects of a dust deposition event on coastal marine microbial abundance and activity,bacterial community structure and ecosystem function [J]. Journal of Plankton Research, 32 (4): 381-396.
PUKALL R, PAE¨UKER O, BUNTEFUM D, et al. 1999. High sequence diversity of Alteromonas macleodii-related cloned and cellular 16S rDNAs from a Mediterranean seawater mesocosm experiment [J].FEMS Microbiology Ecology, 28: 335-344.
PULIDO-VILLENA E, REROLLE V, GUIEU C. 2010. Transient fertilizing effect of dust in P-deficient LNLC surface ocean [J]. Geophysical Research Letters, 37: L01603.
RIVKIN R B, ANDERSON M R. 1997. Inorganic nutrient limitation of oceanic bacterioplankton. Limnology and Oceanography [J]. 42:730-740.
SCHAFER H, BERNARD L, COURTIES C. 2001.Microbial community dynamics in Mediterranean nutrient-enriched seawater mesocosms:changes in the genetic diversity of bacterial populations [J]. FEMS Microbiology Ecology, 34 (3): 243-253.
SCHWIRGER F, TEBBE C C. 1998. A new approach to utilize PCR-single strand conformation polymorphism for 16S rRNA based microbial community analysis [J]. Applied and Environmental Microbiology, 64:4870-4876.
WONG G T F, CHUNG S W, SHIAH F K,et al. 2002. Nitrate anomaly in the upper nutricline in the northern South China Sea-evidence for nitrogen fixation [J]. Geophysical Research Letters, 29: 2097.
YUAN X, HE L, YIN K, et al. 2011. Bacterial distribution and nutrient limitation in relation to different water masses in the coastal and northwestern South China Sea in late summer [J]. Continental Shelf Research, 31: 1214-1223.
曾爱娣. 2010. AA3连续流动注射法测定水中的氨氮和总磷[J].环境研究与监测, 22 (3): 54-55.
陈广善, 刘晓东, 陈葆德. 2006.亚洲大陆 2000-2002年春季大气沙尘时空特征的数值模拟[J]. 环境科学, 27 (1): 18.
高会旺, 祁建华, 石金辉, 等. 2009.亚洲沙尘的远距离输送及对海洋生态系统的影响[J]. 地球科学进展, 24 (1): 1-10.
李立. 2002. 南海上层环流观测研究进展[J]. 台湾海峡, 21: 114-125.
孙西艳,洪陵成,叶宏萌. 2010.在线镉柱还原-流动注射法测定水样中硝酸盐氮实验[J].水资源保护, 26 (5): 75-77.
袁梁英. 2005. 南海北部营养盐结构特征 [D]. 厦门: 厦门大学: 10-12.
赵三军,肖 天,岳东海. 2003.秋季东黄海异养细菌 (heterotrophic bacteria)的分布特点[J]. 海洋与湖沼, 34(3): 295-305.
