施氮对不同有机碳水平桉树林土壤微生物群落结构和功能的影响
2014-05-08苏丹张凯陈法霖李睿达郑华
苏丹,张凯,陈法霖,李睿达,郑华
中国科学院生态环境研究中心城市与区域生态国家重点实验室,北京100085
土壤微生物是土壤中营养周转的主要参与者,对碳氮变化较为敏感。施氮及氮素的添加都可能影响土壤中微生物群落的变化,进而影响微生物群落功能和土壤营养过程。围绕氮素施用对土壤微生物群落的影响已经开展了大量研究(Cusack等,2011;Waldrop等,2004;Zhong等,2010),并发现施氮可以改变土壤中主导微群落,由真菌主导的微生物群落转化为细菌主导。Frey等施氮研究发现,真菌微生物量随着氮的增加而降低,而细菌变化并不显著(Frey等,2004)。微生物群落的变化——真菌和细菌比例等变化,可能导致参与木质素降解的真菌功能群丰度及土壤中酚氧化酶等酶活性降低,而改变土壤中有机物的代谢(Osono, 2007)。
土壤微生物群落同样受到土壤中有机碳含量的影响,有机碳含量直接影响土壤微生物的生长,而影响土壤微生物群落丰度。其中有机质高的土壤中微生物量往往高于有机质低的土壤(Burger和Jackson,2003)。此外土壤有机物的组成中碳氮比影响土壤中微生物活性Hobbie, 1996),而影响微生物群落功能,如通过改变土壤酶活,影响土壤碳形态,最终影响土壤物质代谢。然而,在研究施氮水平对土壤微生物群落的影响时,很少考虑土壤有机碳水平的影响。
桉树人工林是我国南方广泛种植的经济速生林,土壤养分缺乏(陈少雄,2009;廖观荣,2003)。而氮肥的补充是维持桉树养分的重要方式,则土壤中微生物群落及功能变化对营养周转更为敏感。本研究以我国南方广泛种植的桉树人工林为研究对象,采用野外控制试验的方法,探究不同土壤有机碳水平下施氮对桉树林土壤微生物群落结构及功能的影响,其目标是:明确不同有机碳水平桉树林土壤微生物群落对施氮水平的响应是否一致,并探讨微生物群落变化在土壤养分维持中的意义。
1 研究区域概况与研究方法
1.1 研究区域概况
本研究样地位于我国广西扶绥县国有东门林场(E107°15′~108°00′,N22°17′~22°30′)。广西东门林场是亚洲最大的桉树基因库,主要经营以桉树为主的商品用材林。该地区属于北热带季风气候区,光热充足,雨热同季,夏湿冬干,年平均气温21.2~22.3 ℃,1月均温13.2 ℃,7月均温27.9 ℃。年降雨量1100~1300 mm,主要集中在6—8月,占全年降雨量的51.03%。研究区域土壤以砂页岩发育而成的赤红壤为主,pH值在4.5~6.0。
1.2 实验设计
为了研究不同有机碳水平桉树林土壤微生物群落碳代谢功能对施氮的响应特征,本研究从预实验的 20个样地中,选取土壤有机碳含量差异显著(P<0.01)的 2个二代桉树林样地:高有机碳样地(HC):有机碳含量 14.80 g·kg-1;低土壤有机碳样地(LC):有机碳含量12.89 g·kg-1),开展野外控制实验。两块样地平均坡度约为10°。林木行距4 m,
株距2 m,林下植被有桃金娘Rhodomyrtus tomentos、余甘子Phyllanthus emblica、三叉苦Euodi lepta、飞机草Eupatorium odoratum、白茅Imperata cylindrica等,植被覆盖度为60%。样地的基本特征见表1。
结合当地施肥习惯和施肥强度,在桉树林样地中设置3个施氮梯度:对照(CK,0 kg·hm-2)、常规氮(NN,166.8 kg·hm-2)和高氮(HN,333.7 kg·hm-2)。每个施氮水平设置重复 3个,每个样方面积10 m×10 m。施氮时间为2013年5月20日,肥料种类为脲甲醛缓释肥。取样时间为 2013年 8月26日。
1.3 土壤理化性质测定及酶活测定
土壤理化性质测定参考土壤农化分析(鲍士旦,2000)。土壤总碳、总氮使用元素分析仪测定(Vario EL III,Elementar,Germany),有机碳含量用重铬酸钾滴定法(LYT 1237-1999),土壤pH值采用土水比(质量体积比)为1:2.5的方法测定。土壤可溶性有机碳由0.5 mol/L MK2SO4提取(Högberg等2002;Jones和Willett,2006)并通过Liqui TOCⅡ分析仪(Elementar,Germany)测定,土壤酶活的测定参考DeForest荧光酶测定方法,及L-DOPA为底物酶培养测定方法(Deforest, 2009; Marx等,2001)。
1.4 磷脂脂肪酸(Phospholipid Fatty-acid Analysis,PLFA)提取、分离、鉴定
利用有机试剂对PLFA进行提取(氯仿、甲醇),分离(氯仿、甲醇、丙酮),甲酯化(甲醇、甲苯、正己烷)后,上机前用1 mL含内标物19:0的正己烷溶液溶解吹干的脂肪酸甲脂,进行 GC-MS(HP6890/MSD5793(Agilent Technologies,Bracknell,UK))测试(陈法霖等,2012;Frostegård 等,1996)。
1.5 数据分析
据表2将PLFA划分不同的微生物类群,并计算细菌和真菌含量,及真菌与细菌的比例。
通过主成分分析及方差分析实现不同处理上土壤微生物群落结构的差异,由 CANOCO 5.0及SPSS 16.0统计软件实现,画图工具为Excel。

表1 土壤基本性质Table 1 Property of the soil in the experiment

表2 微生物群落分类的PLFA标记Table 2 PLFA markers for taxonomic microbial groups
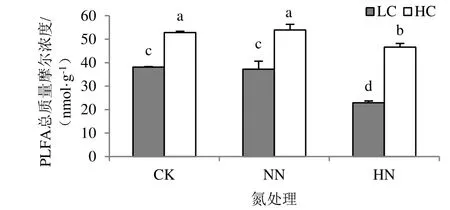
图1 土壤微生物PLFA总量Fig.1 Soil microbial total PLFA
2 结果
2.1 土壤微生物群落PLFA总量
施氮显著影响土壤微生物群落磷脂脂肪酸总量(P<0.01),施二倍氮素处理(HN)的土壤微生物磷脂脂肪酸总量显著低于对照(CK)和常规施氮处理(NN)(图1)。高有机碳水平土壤微生物群落磷脂脂肪酸生物量显著高于低有机碳水平(P<0.01)。
土壤有机碳水平和施氮水平对土壤微生物群落磷脂脂肪酸总量的影响存在交互作用(P<0.01),高有机碳水平与对照、常规施氮水平和施二倍氮素组合的土壤微生物群落磷脂脂肪酸总量均显著高于低有机碳水平与对照、常规施氮水平和施二倍氮素组合,低有机碳水平和施二倍氮素组合的土壤微生物群落磷脂脂肪酸总量显著最低。
2.2 微生物群落结构
2.2.1 微生物群落组成
施氮显著影响土壤细菌、真菌、放线菌磷脂脂肪酸量以及真菌/细菌比值,施二倍氮素处理的土壤细菌、放线菌磷脂脂肪酸量显著低于对照和常规施氮处理;随着施氮水平的增加,土壤真菌磷脂脂肪酸量和真菌/细菌比值显著降低,对照、常规施氮水平和施二倍氮素处理之间土壤真菌磷脂脂肪酸量、真菌/细菌比值差异均达显著水平(P<0.05)。高有机碳土壤细菌、真菌、放线菌磷脂脂肪酸生物量以及真菌/细菌比值均显著高于低有机碳土壤处理(表3)。
土壤有机碳水平和施氮水平对土壤细菌、真菌、放线菌和真菌/细菌比值的影响存在交互作用,在低土壤有机碳水平中,施二倍氮素能显著降低细菌磷脂脂肪酸量,但在高土壤有机碳水平中施氮对细菌磷脂脂肪酸量的影响不显著。在低、高土壤有机碳水平中,真菌磷脂脂肪酸量对施氮的响应不一致,在低土壤有机碳水平中,常规施氮水平显著降低了真菌磷脂脂肪酸量;而在高土壤有机碳水平中,施二倍氮素水平才显著降低真菌磷脂脂肪酸量。在低、高土壤有机碳土壤中,常规施氮水平均显著降低了土壤真菌/细菌比值。
2.2.2 微生物群落主成分分析
土壤微生物群落磷脂脂肪酸PLFA主成分分析表明:PC1可以解释56.63%的变异,土壤微生物群落的差异主要表现在主成分1(PC1),即:不同有机碳水平下的土壤微生物群落;在2种有机碳水平上,高氮与其他处理之间分异均明显(图2)。
真菌特征脂肪酸 16:1ω5c、18:1ω9c、18:2ω9c及细菌特征脂肪酸16:1ω7c、i17:0和放线菌特征脂肪酸10Me18:0等与PC1显著相关,而16:0、14:0、17:0、18:0在PC2上得分较高,这些脂肪酸对土壤微生物群落分异起到主要作用。
2.3 土壤酶活性及可溶性有机碳(DOC)特征
施氮显著增加了土壤纤维素酶、酚氧化酶活性及土壤可溶性有机碳含量,施二倍氮素处理的土壤纤维素酶活性显著高于对照和常规施氮水平处理;对照、常规施氮水平和施二倍氮素处理的酚氧化酶差异和土壤有机碳含量差异均显著(P<0.05)(表4)。土壤有机碳水平也影响土壤纤维素酶活性和土壤可溶性有机碳含量,高土壤有机碳样地中的土壤纤维素酶活性和土壤可溶性有机碳含量显著高于低土壤有机碳样地(表4)。
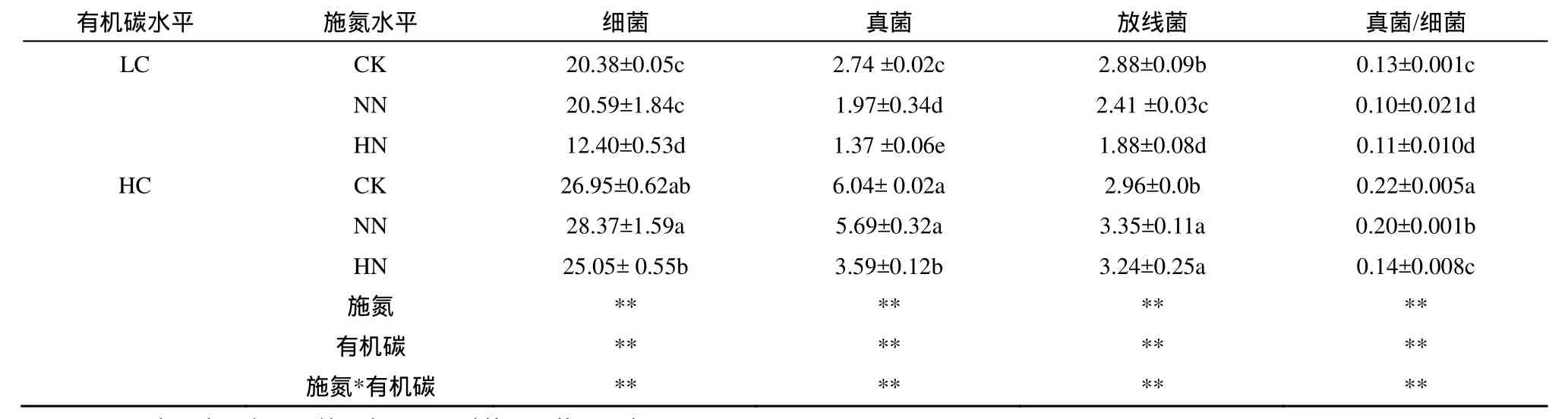
表3 土壤微生物群落组成1)Table 3 Soil microbial community composition
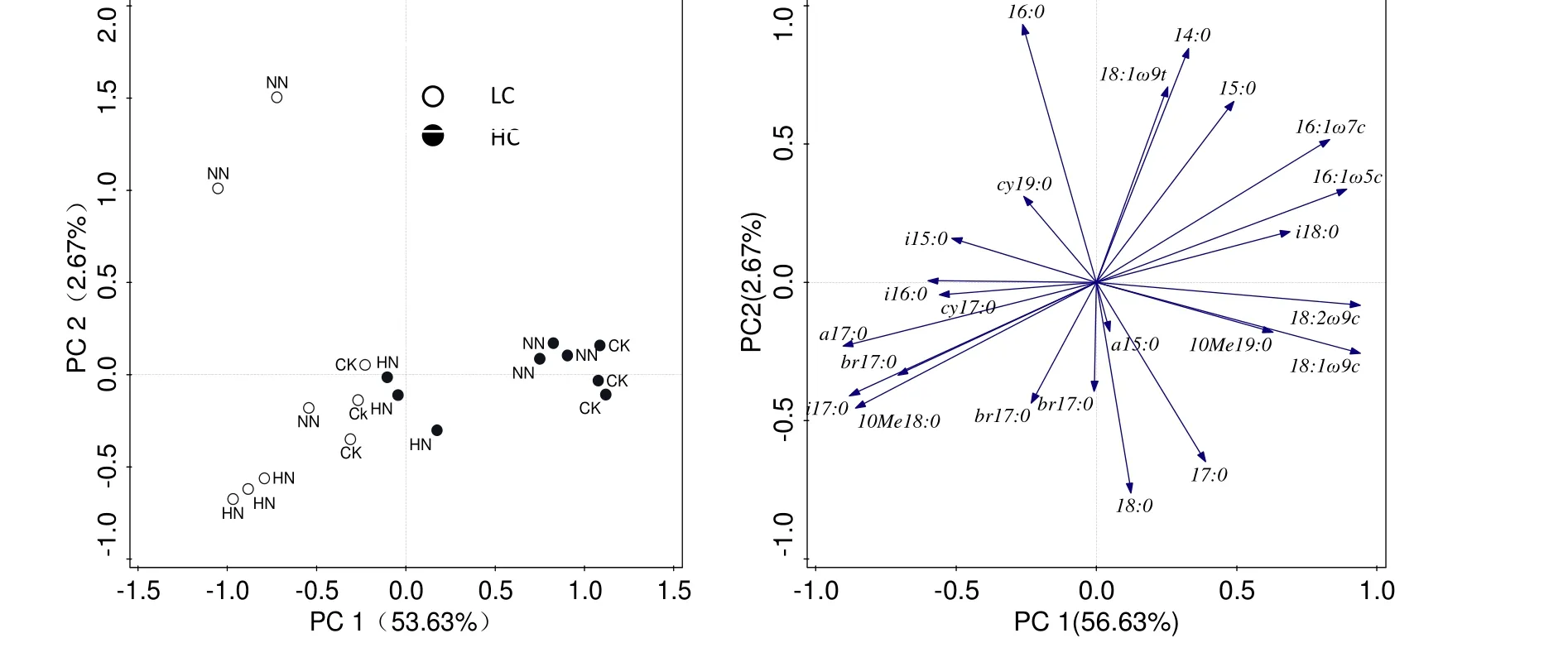
图2 土壤微生物的群落结构主成分分析Fig.2 The principal components analysis of soil microbial community composition
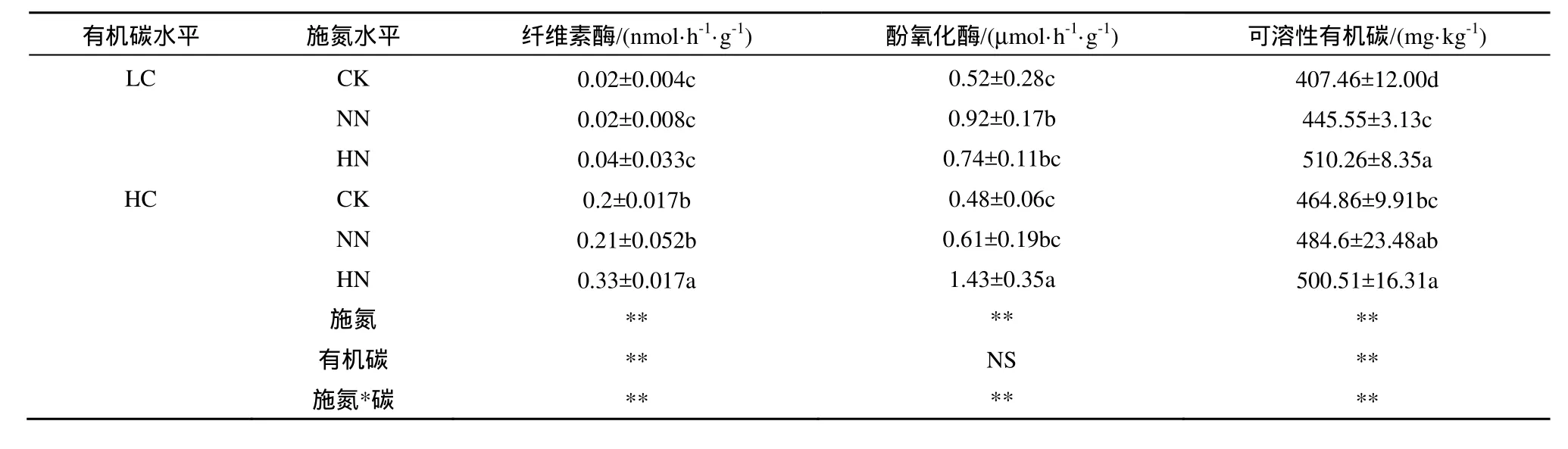
表4 土壤酶活及DOC 含量Table 4 Soil extracellular enzymes activity and DOC content
施氮水平和土壤有机碳含量对土壤纤维素酶、酚氧化酶活性及土壤可溶性有机碳含量的影响存在交互作用。在低土壤有机碳样地中,土壤纤维素酶活性对施氮的响应没差异,但在高土壤有机碳样地中,施二倍氮素处理的土壤纤维素酶活性显著高于对照和常规施氮水平处理;在低土壤有机碳样地中,常规施氮水平和施二倍氮素处理的酚氧化酶活性均显著高于对照,而在高土壤有机碳样地中,施二倍氮素处理的酚氧化酶显著高于对照和常规施氮水平;对于土壤可溶性有机碳,低土壤有机碳样地中,随施氮水平的增加,土壤可溶性有机碳含量显著增加,而在高土壤有机碳样地中,施二倍氮素处理的土壤可溶性有机碳含量才显著高于对照(表4)。
3 讨论
土壤中氮可以通过调节微生物参与的碳氮代谢过程而影响微生物群落结构(DeForest等,2004)。本实验发现施氮显著影响了土壤微生物群落:(1)降低土壤微生物群落磷脂脂肪酸总量及土壤中细菌、真菌、放线菌磷脂脂肪酸量(P<0.05)。可能是因为外源氮的添加影响了土壤中微生物腐食食物链,而降低微生物对凋落物的吸收(Gan等2013),进而降低了土壤微生物的PLFA总量。氮添加处理后革兰氏阳性及阴性菌、真菌丰度都降低,这与Bi等的实验结果一致(Bi等,2012)。(2)施氮处理下,真菌/细菌比值显著降低(P<0.05)。可能是施氮改变了土壤有机物的组成,而减少了真菌可利用有机物的比例,从而抑制了真菌的生长。Norris等认为土壤中外源氮的添加超过一定有效氮阈值,微生物真菌丰度降低,有真菌主导的微生物群落转化为细菌主导(Janssens等,2010),进而改变土壤微生物分解功能(Norris等,2012;Wallenstein等,2006),同样Tietema发现氮饱和土壤中真菌含量降低(Tietema等,1998),与本文实验结果表现一致。
同时施氮土壤影响微生物群落进而调节了土壤中酶活,而影响土壤碳代谢过程(Sinsabaugh等,2005;Carreiro等2000)。本实验发现施氮显著增加了土壤纤维素酶、酚氧化酶活性及土壤中 DOC含量。酶活性在不同氮水平间的变化与相应微生物PLFA总量变化并不一致,可能是由于施氮主要是通过影响微生物功能群的变化而调节土壤酶活(Gallo等,2004)。而与此前报道(Frey等,2004)有差异的是,酚氧化酶活性并没有受到氮的抑制,而是对氮做出正响应(P<0.05),说明施氮并没有影响酚氧化酶的主要微生物功能群,其机制需要进一步通过分子生物学等方法探究。土壤可溶性有机碳(dissolved organic carbon, DOC)来源于微生物对凋落物等植物残体及土壤有机物的分解,与微生物参与的代谢过程显著相关(方华军等,2007)。原因可能是两个方面:从来源上来说,较高的纤维素酶活性能够分解有机物成为DOC;而从损失上来说,DOC是土壤微生物的能量来源(Yano等,2000),HN处理下微生物总量降低,对DOC的利用降低,这两方面最终结果表现为DOC总量的增加。
同时,本实验发现土壤有机碳影响土壤微生物群落结构及功能。在不同有机碳水平土壤中,微生物总量变化显著(P<0.01),高有机碳水平桉树林土壤微生物PLFA高于低有机碳水平桉树林,强调了土壤有机碳为微生物提供能量,而调节微生物的生长(Fontaine等,2004;刘来等,2013),而Williams发现土壤有机碳显著影响微生物群落组成(Williams等,2013),与本实验结果一致。不同有机碳水平影响了土壤微生物群落,从而影响土壤中酶活性及 DOC的变化,整体表现为高土壤有机碳水平上2种酶活性及DOC高于低土壤有机碳水平。
此外,本研究发现土壤微生物对施氮的响应受到有机碳的调节。低有机碳水平土壤中,微生物群落受到有机碳的限制,而对氮的添加更为敏感,在低氮(常规氮)水平上表现出群落结构及功能降低的趋势。而在高土壤有机碳水平样地中只有在高氮(施二倍氮素)处理中才显著降低或不变化。在不同有机碳水平上,施氮可能改变了土壤的碳氮比,而表现为不同有机碳水平上微生物群落结构及功能的差异(Allison等,2008;Liu和 Greaver, 2010)。施氮倾向于引起土壤中碳氮比降低,当氮含量较丰富时,微生物可利用的有效氮增加,但是土壤中可利用的碳成为微生物的限制因素(Aber等,1989),所以产生施氮条件下,土壤微生物整体丰度降低。而在高有机碳土壤中,有效碳的含量高,而土壤微生物对氮的响应,所表现出的碳的限制并不明显。
本实验结果表明施氮显著影响了土壤中微生物群落结构及功能,同时,土壤微生物的响应又受到土壤有机碳的调节,而且不同有机碳水平上微生物群落及功能变化对氮的响应并不一致。不同施氮水平对人工林生态系统中土壤微生物的影响,应当考虑土壤中有机碳水平。
4 结论
通过对不同有机碳水平桉树林土壤中微生物实验的研究,我们得出以下结论。
(1)施氮显著影响土壤微生物群落结构及功能,土壤微生物群落PLFA总量随着施氮的增加反而降低。而且随着施氮的增加,土壤微生物中真菌与细菌比例降低;而土壤微生物群落功能——土壤微生物酶活性,在施氮处理的影响下而增加,说明施氮促进部分微生物分解功能增强。
(2)土壤微生物群落结构以及功能的变化同时受到土壤中有机碳水平的调节,在高有机碳水平土壤中,微生物 PLFA量高于低有机碳水平,同时土壤微生物酶活性也表现出不同有机碳水平上的显著差异,在高有机碳水平上酶活要高于低有机碳水平。
(3)施氮和土壤有机碳变化对土壤微生物的影响有交互作用,不同有机碳水平上,土壤微生物群落组成差异显著,尤其是真菌含量,在低土壤有机碳水平中,常规施氮水平下真菌磷脂脂肪酸量显著降低;而在高土壤有机碳水平中,施二倍氮素水平才显著降低真菌磷脂脂肪酸量。而碳氮对不同酶活性的影响表现不同的交互作用,酚氧化酶,纤维素酶在高有机碳高氮条件下活性高于其他处理,施氮在高有机碳的水平条件下促进土壤微生物的分解功能。所以不同施氮水平对人工林生态系统中土壤微生物的影响研究,土壤中有机碳水平不容忽视。
ABER J D, NADELHOFFER K J, STEUDLER P, et al. 1989.Nitrogen saturation in northern forest ecosystems[J]. BioScience, 39(6):378-286.
ALLISON S D, CZIMCZIK C I,TRESEDER K K. 2008.Microbial activity and soil respiration under nitrogen addition in Alaskan boreal forest[J].Global Change Biology, 14(5): 1156-1168.
BI J, ZHANG N, LIANG Y, et al.2012. Interactive effects of water and nitrogen addition on soil microbial communities in a semiarid steppe[J].Journal of Plant Ecology,5(3): 320-329.
BURGER M,JACKSON L E.2003. Microbial immobilization of ammonium and nitrate in relation to ammonification and nitrification rates in organic and conventional cropping systems[J].Soil Biology and Biochemistry, 35(1): 29-36.
BUYER J S,SASSER M. 2012.High throughput phospholipid fatty acid analysis of soils[J].Applied Soil Ecology, 61: 127-130.
CARREIRO M, SINSABAUGH R, REPERT D, et al. 2000. Microbial enzyme shifts explain litter decay responses to simulated nitrogen deposition[J].Ecology, 81(9): 2359-2365.
CUSACK D F, SILVER W L, TORN M S, et al. 2011.Changes in microbial community characteristics and soil organic matter with nitrogen additions in two tropical forests[J].Ecology, 92(3): 621-632.
DEFOREST J L, ZAK D R, PREGITZER K S, et al. 2004.Atmospheric nitrate deposition and the microbial degradation of cellobiose and vanillin in a northern hardwood forest[J].Soil Biology and Biochemistry, 36(6): 965-971.
DEFOREST J L. 2009.The influence of time, storage temperature, and substrate age on potential soil enzyme activity in acidic forest soils using MUB-linked substrates and L-DOPA[J].Soil Biology and Biochemistry, 41(6): 1180-1186.
Fontaine S, Bardoux G, Abbadie L, et al. 2004.Carbon input to soil may decrease soil carbon content[J].Ecology letters, 2004, 7(4): 314-320.
FREY S D, KNORR M, PARRENT J L, et al. Chronic nitrogen enrichment affects the structure and function of the soil microbial community in temperate hardwood and pine forests[J].Forest Ecology and Management, 196(1): 159-171.
FROSTEGÅRD Å,BÅÅTH E.1996. The use of phospholipid fatty acid analysis to estimate bacterial and fungal biomass in soil[J].Biol Fert Soils, 22(1-2): 59-65.
GALLO M, AMONETTE R, LAUBER C, et al. 2004.Microbial community structure and oxidative enzyme activity in nitrogen-amended north temperate forest soils[J].Microbial Ecology, 48(2): 218-229.
GAN H, ZAK D R,HUNTER M D. 2013.Chronic nitrogen deposition alters the structure and function of detrital food webs in a northern hardwood ecosystem[J].Ecological Applications,23(6):1311-1321.
HOBBIE S E. Temperature and plant species control over litter decomposition in Alaskan tundra[J].Ecological Monographs, 1996,66(4): 503-522.
HÖGBERG M N,HÖGBERG P. 2002.Extramatrical ectomycorrhizal mycelium contributes one‐third of microbial biomass and produces,together with associated roots, half the dissolved organic carbon in a forest soil[J].New Phytologist, 154(3): 791-795.
JANSSENS I, DIELEMAN W, LUYSSAERT S, et al. 2010.Reduction of forest soil respiration in response to nitrogen deposition[J].Nature Geoscience, 3(5): 315-322.
JONES D, WILLETT V. 2006. Experimental evaluation of methods to quantify dissolved organic nitrogen (DON) and dissolved organic carbon (DOC) in soil[J].Soil Biology and Biochemistry, 38(5):991-999.
LIU L, GREAVER T L. 2010. A global perspective on belowground carbon dynamics under nitrogen enrichment[J]. Ecol Lett, 13(7): 819-28.
MARX M-C, WOOD M, JARVIS S. 2001. A microplate fluorimetric assay for the study of enzyme diversity in soils[J].Soil Biology and Biochemistry, 33(12): 1633-1640.
NORRIS M D, AVIS P G, REICH P B, et al. 2013. Positive feedbacks between decomposition and soil nitrogen availability along fertility gradients[J]. Plant and Soil, 367(1/2): 347-361.
OLSSON P A, BÅÅTH E, JAKOBSEN I, et al. 1995.The use of phospholipid and neutral lipid fatty acids to estimate biomass of arbuscular mycorrhizal fungi in soil[J].Mycological Research, 99(5):623-629.
OSONO T. 2007.Ecology of ligninolytic fungi associated with leaf litter decomposition[J].Ecological Research, 22(6): 955-974.
SINSABAUGH R L, GALLO M E, LAUBER C, et al. 2005.Extracellular Enzyme Activities and Soil Organic Matter Dynamics for Northern Hardwood Forests receiving Simulated Nitrogen Deposition[J].Biogeochemistry, 75(2): 201-215.
TIETEMA A. 1998.Microbial carbon and nitrogen dynamics in coniferous forest floor material collected along a European nitrogen deposition gradient[J].Forest Ecology and Management, 101(1): 29-36.
WALDROP M P, ZAK D R,SINSABAUGH R L.2004. Microbial community response to nitrogen deposition in northern forest ecosystems[J].Soil Biology and Biochemistry, 36(9): 1443-1451.
WALLENSTEIN M D, McNULTY S, FERNANDEZ I J, et al.2006.Nitrogen fertilization decreases forest soil fungal and bacterial biomass in three long-term experiments[J].Forest Ecology and Management, 222(1): 459-468.
WILLIAMS A, BORJESSON G, HEDLUND K. 2013.The effects of 55 years of different inorganic fertiliser regimes on soil properties and microbial community composition[J]. Soil Biology & Biochemistry, 67:41-46.
YANO Y, McDOWELL W, ABER J. 2000.Biodegradable dissolved organic carbon in forest soil solution and effects of chronic nitrogen deposition[J].Soil Biology and Biochemistry, 32(11): 1743-1751.
ZHONG W, GU T, WANG W, et al. 2010. The effects of mineral fertilizer and organic manure on soil microbial community and diversity[J].Plant and Soil, 326(1-2): 511-522.
鲍士旦, 2000.土壤农化分析[M]. 北京:中国农业出版社.
陈法霖, 郑华, 欧阳志云, 等. 2011. 土壤微生物群落结构对凋落物组成变化的响应[J]. 土壤学报, 48(3): 603-611.
陈少雄. 2009. 桉树人工林土壤养分现状与施肥研究[J].桉树科技, 26(1):52-63.
方华军, 程淑兰,于贵瑞. 2007. 森林土壤碳, 氮淋失过程及其形成机制研究进展[J]. 地理科学进展, 26(3): 29-37.
廖观荣, 李淑仪, 蓝佩玲, 等. 2003. 桉树人工林生态系统养分循环与平衡研究 Ⅰ. 桉树人工林生态系统的养分贮存[J].生态环境, 12(2):150-154.
刘来, 黄保健, 孙锦,等. 2013. 大棚辣椒连作土壤微生物数量、酶活性与土壤肥力的关系[J]. 中国土壤与肥料, (2):5-10.
吴愉萍. 2009.基于磷脂脂肪酸 (PLFA) 分析技术的土壤微生物群落结构多样性的研究[D]. 杭州: 浙江大学.
张秋芳, 刘波, 林营志, 等. 2009.土壤微生物群落磷脂脂肪酸PLFA生物标记多样性[J].生态学报, 29(008): 4127-4137.
