森林表层土壤微生物碳氮库对大气氮沉降增加的响应
2014-05-08罗献宝梁瑞标王亚欣
罗献宝,梁瑞标,王亚欣
广西大学农学院,广西 南宁 530005
森林生态系统在全球碳氮循环中发挥着重要作用,森林土壤碳库约占全球土壤有机碳总量的73%(Sedjo,1993),森林土壤氮库储量超过森林生态系统氮素总量的85%(Cole和Rapp,1981)。土壤碳氮库的动态转化过程是森林生态系统碳氮循环的重要环节,研究森林土壤碳氮循环对于充分认识森林生态系统与全球碳氮变化的关系具有重要意义。20世纪以来,由于人类活动剧烈导致大气中含氮化合物在全球主要生态系统中的沉降量迅速上升,上世纪 90年代全球陆地生态系统氮沉降量已高达63.5 Mt,是工业革命前的3.6倍(Stevens等,2004)。根据大气网络监测数据,我国东北地区长白山森林生态系统的氮沉降已高达 23 kg·hm-2·a-1(胡艳玲等,2009),高于欧洲地区氮沉降量。由于大气氮沉降增加有可能在全球尺度范围内引起森林生态系统碳氮循环特征发生改变,故该问题引起了国际社会的高度关注(Galloway和Cowling,2002;蔡玉婷等,2013)。
土壤微生物是土壤生态系统碳氮转化过程的生物因素,其自身也是土壤活性碳氮库的重要组成部分。虽然土壤微生物量仅占土壤总有机碳的1%~3%(Laurie等,1999),但是土壤微生物在陆地生态系统的碳氮循环过程中发挥着关键作用,在土壤碳氮循环及其对环境干扰的响应中具有表征功能(尉海东和董彬, 2013)。虽然已有不少研究报道大气氮沉降增加对森林土壤生态系统碳氮过程的影响(胡艳玲等,2009),但是森林土壤微生物对氮沉降响应的研究尚不多见。现有的关于氮沉降对土壤碳氮过程影响因素的研究多是偏重于氮素的剂量及其干扰的时效,往往忽略了氮沉降组分中的氮素形态及其伴随离子的影响效应。本研究通过人工模拟氮沉降增加的方式,探讨温带森林土壤及其微生物碳氮库对不同形态氮沉降的响应,有助于更加全面地认识氮沉降干扰对森林土壤碳氮库的影响。
1 材料与方法
1.1 研究地概况
研究地位于中国科学院长白山森林生态系统定位站 1 号标准样地(128°05′ E,42°24′ N),该地区属于季风温带大陆性山地气候,年平均气温3.6 ℃,无霜期约120 d,年平均降雨量是855 mm,约有88%的降雨发生于4月至9月(Zhu等,2009)。研究区域坡度1°~5°,平均海拔高度738 m。植物群落类型为阔叶红松林(属复层异龄原始林),总郁闭度0.8,立木株数约560株·hm-2,优势树种林龄约 180 a左右,以红松(Pinus koraiensis)、紫椴(Tilia amurensis)、水曲柳(Fraxinus mandshurica)、蒙古栎(Quercus mongolica)及色木槭(Acer mono)为主要建群种,其中红松约占林分蓄积量的30%(Zhu等,2007)。研究样地的土壤类型是火山灰母质发育的山地暗棕色森林土,土壤排水良好,土层厚度20~100 cm,有机质层平均厚度约7 cm,土壤剖面的基本性质见Xu等的研究结果(Xu等,2007)。
1.2 研究方法
本研究设计3个试验处理,包括对照处理和两种氮素形态处理(NH4Cl和KNO3),野外试验设置4次重复(随机区组设计),小区规格1.5 m×1.5 m并且保持间距>2 m(小区周边3 m内有高大乔木分布)。试验氮素处理剂量为 40 kg·hm-2·a-1,平均分配于生长季节的各月份(5月至10月)。模拟氮沉降自2008年9月开始实施,于每月上旬将氮肥溶液喷洒于小区(对照处理用水),模拟降雨量是 5 mm。
土壤样品采集时间分别是2009年5月30日、7月30日以及9月29日,分别处于该研究期的春季、夏季和秋季的中间时期。用土钻(长10 cm,直径3 cm)在小区中随机采集土壤样品(由2个土钻样合并而成)。样品带回室内去除枯枝、落叶等可辨杂物,经3 mm孔径土筛后在4 ℃条件下保存待分析。
土壤重量含水量用烘干法测定,土壤pH值(土水比1:2.5)用玻璃复合电极-酸度计(Thermo Orion,868,美国)测定。土壤铵态氮(NH4+-N)和硝态氮(NO3--N)含量用 KCl浸提-比色法测定,土样经 KCl溶液(1 mol·L-1)振荡浸提 1 h(土液比 1:5),浸提液通过滤纸,待测液用靛酚蓝比色法和硫酸铜还原-重氮化偶合比色法分别测定铵态氮和硝态氮(Tan,1995)。土壤微生物量碳(Soil microbial biomass carbon,SMBC)和土壤微生物量氮(Soil microbial biomass nitrogen,SMBN)含量采用氯仿熏蒸-浸提法测定(Vance等,1987),熏蒸与未熏蒸的土壤样品用K2SO4溶液(0.5 mol·L-1)振荡浸提60 min(土液比1:5),浸提液通过滤纸,待测液使用TOC/TN分析仪(Analytik Jena, multi TOC/TN 3000,德国)测定溶解性有机碳(Dissolved organic carbon,DOC)和溶解性总氮(Total dissolved nitrogen,TDN)的浓度,以熏蒸前后DOC和TDN的浓度差分别计算SMBC和SMBN。熏蒸与未熏蒸土壤的K2SO4浸提液还分别测定了铵态氮、硝态氮(上述比色法)和浸提液在 254 nm处的吸光度(Abs254,Shimadzu,UV-mini 1240,日本)。
1.3 数据计算和统计
气象资料由中国科学院长山森林生态系统定位站提供。计算SMBC和SMBN的矫正系数是0.45(Jenkinson,1988;Wu和Joergensen,1990)。熏蒸与未熏蒸土壤的K2SO4浸提液中铵态氮、硝态氮和TDN的含量差值用于估算氯仿熏蒸所释放的土壤微生物氮库,包括氯仿释放的总氮(Chloroform fumigation total nitrogen,CFTN)、铵态氮(Chloroform fumigation ammonium,CFA)、硝态氮(Chloroform fumigation nitrate,CFN)以及有机氮(总氮减去无机氮,Chloroform fumigation DON,CFDON)(Brookes等,1985)。未熏蒸土壤K2SO4浸提液的 Abs254用于计算 DOC的特征吸光系数(Specific ultraviolet absorbance,SUVA)(Jaffrain 等,2007),公式是:SUVA(L·mg-1·m-1)= 100× Abs254(cm-1)/DOC(mg·L-1),式中 Abs254 是土壤 K2SO4盐浸提溶液在254 nm处的吸光度(1 cm光径),系数100是将cm换算为m。
方差分析用于研究氮沉降对土壤和微生物碳氮库的影响及其季节性变化,以多重比较(最小显著差数法,LSD0.05)研究不同检验因素之间的差异显著性。土壤与微生物碳氮库之间的相关关系采用Pearson相关系数进行相关性分析,并对相关系数进行显著性检验(p< 0.05)。
2 结果与分析
2.1 气象条件及氮沉降对土壤主要碳氮属性的影响
研究地区 2009年的气象条件符合温带大陆性季风气候“雨热同季”的典型特征(图1-1)。生长季中春季(5~6月)、夏季(7~8月)和秋季(9~10月)的总体趋势是:春季升温多小雨;夏季高温多大雨;秋季降温而少雨。本研究在5月、7月和9月的月末采集土壤样品,分别处于春季、夏季和秋季的中间时期,可以较好地代表各季节土壤和微生物的属性。观测期5月、7月和9月的平均土温分别是14.7 ℃、20.3 ℃和14.1 ℃,当月降雨量分别是47.4 mm、147.6 mm和42.6 mm。
表1显示,土壤pH值以及主要碳氮库具有显著季节性差异,夏季土壤pH值显著高于春、秋季(p<0.05),可能是夏季多降雨使得土壤保持高湿度的结果。虽然土壤NH4+-N含量在不同季节间变异大,且夏季平均值最高,但是与春季和秋季的差异不显著(p=0.36)。土壤 NO3--N季节差异显著(p<0.05),春季高于夏、秋季。春季NO3--N高可能与此前冻融期土壤氮库的释放且发生硝化作用有关(傅民杰等,2009);由于夏季多降雨而硝态氮淋溶强烈,因此该季节土壤最低。作为表层土壤重要的活性碳库(Kalbitz等,2000),土壤(K2SO4浸提)DOC含量在春、夏季显著高于秋季(表1,p<0.05),春季较高的DOC可能来自于此前冻融交替期土壤碳库的释放,而夏季土壤 DOC主要源于细根活跃分泌的有机物质(Jones等,2004)。SUVA值是土壤DOC相对芳化丰度的指标(Jaffrain等,2007),夏季根系的分泌物多是糖类物质(芳环基团少)(Jones等,2004),因此 SUVA值显著低于春、秋季(表1,p<0.05)。由于氮沉降处理和季节变化无显著交互性,因此氮处理对土壤属性的季节变化没有影响。
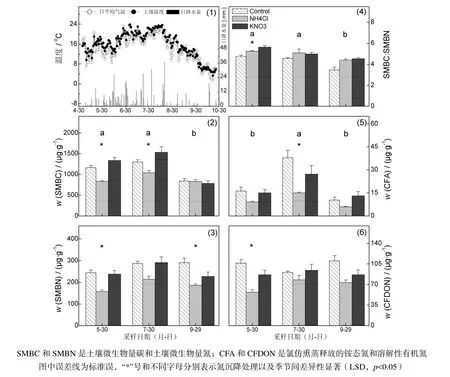
图1 气象条件以及土壤微生物碳、氮库对氮沉降的响应Fig.1 Meteorological Condition and Response of Soil Microbial Biomass Carbon and Nitrogen to N Deposition
氮沉降的研究结果显示(表1),NH4Cl形态的氮沉降处理(简称NH4Cl处理,KNO3处理的意义类同)的土壤 pH值显著低于对照和 KNO3处理(p<0.05),这与硝化致酸以及植物根系选择吸收有关(Marschner,1996)。虽然NH4Cl处理和 KNO3处理对土壤无显著影响(p=0.31),但是KNO3处理的土壤显著高于对照和NH4Cl处理(p<0.05),这可能是输入的直接结果。在本试验研究期间,氮沉降处理对森林表层土壤(K2SO4浸提)DOC含量及其SUVA值均无显著影响(表1)。因此,表层土壤活性碳库的数量和品质对氮沉降未发生可观测的响应。由于研究样地表层土壤有机质含量较高(Xu等,2007),土壤碳素转化过程对短期性氮干扰可能具有较强的缓冲能力。
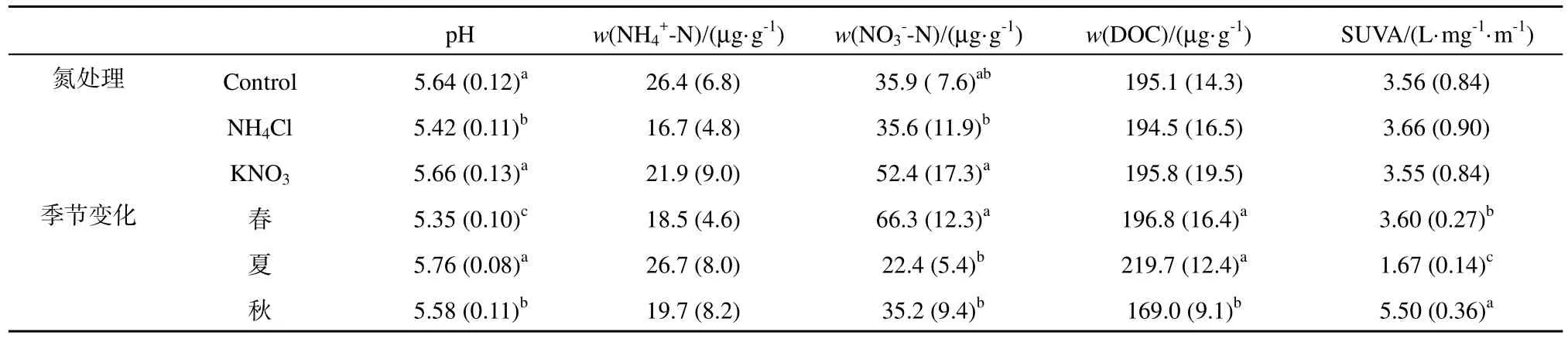
表1 土壤碳氮属性的季节性变化及其对氮沉降的响应Table 1 Seasonal pattern of soil carbon-nitrogen properties and its response to N deposition
2.2 土壤微生物碳氮库对氮沉降的响应
在本研究林地中,SMBC在秋季显著低于春、夏季(图 1-2,p<0.05),该结果与赵玉涛的研究报告一致(赵玉涛等,2009),由于秋季降温快且降雨少,植物根系活动减弱,土壤微生物的活性随之降低。虽然KNO3处理的SMBC与对照无显著差异,但是NH4Cl处理的SMBC含量显著降低(图1-2,p<0.05),原因可能是NH4Cl处理引起的土壤 pH值降低对土壤微生物活动产生不利影响(表 1)。SMBN 无显著性季节差异(图 1-3,p=0.18),KNO3处理的SMBN与对照差异不显著(图1-3),但是NH4Cl处理的SMBN显著低于对照(p<0.05),说明在本研究期间(或者剂量条件),土壤微生物氮库没有因为氮输入增加而增大,而NH4Cl形态的氮沉降甚至出现微生物氮库减小的结果。氮沉降处理的微生物碳氮比(SMBC:SMBN)显著高于对照处理(图 1-4,p<0.05),表明在研究期间土壤微生物碳氮库的构成比例出现变化,即微生物氮库相对减少。
氯仿熏蒸处理土壤过程中,土壤氮的增量主要源于微生物氮素的释放(Brookes等,1985),而且熏蒸期间有机氮的矿化作用弱(Shen等,1984),因此熏蒸与未熏蒸土壤氮的差值可估算土壤微生物氮库的不同形态组成。在氯仿释放氮库中,无机氮几乎全是(熏蒸前后无差异),占 TN的 16%(均值),这与 Brookes的报道一致(Brookes等,1985),可能是因为土壤微生物对的同化或固持作用较弱(Vervaet等,2004)。图1-5显示,夏季土壤CFA(氯仿释放的铵态氮)显著高于春、秋季(p<0.05),而且该季节 NH4Cl处理的 CFA显著低于对照和KNO3处理(p<0.05)。虽然CFDON(氯仿释放的有机氮)季节差异不显著(图 1-6,p=0.82),但是NH4Cl处理的CFDON显著低于对照和KNO3处理(春季,p<0.05)。由于不同氮沉降处理的CFA:CFDON无显著差异(数据未列出,p=0.54),因此,微生物量减少(SMBC低)可能是 NH4Cl处理微生物氮库减少的原因之一。
2.3 土壤碳氮库与微生物碳库的相关性
基于 2009年生长季节的数据,土壤属性与土壤微生物碳氮库的相关系数列于表 2。结果显示SMBC显著正相关于土壤湿度(对照和 KNO3处理),说明土壤微生物受水分制约。由于NH4Cl处理的SMBC显著降低(图1-2),这种效应可能削弱了该处理中SMBC与土壤湿度的相关性。虽然DOC是土壤微生物的重要碳源,但是在氮限制的样地条件下,SMBC与DOC无显著相关(对照处理)。当土壤氮输入增加时,SMBC显著地正相关于 DOC而负相关于SUVA(如KNO3处理),说明氮限制缓解时,SMBC受制于土壤碳库及其品质(SUVA高则DOC芳化度高,难分解利用),类似效应未出现在NH4Cl处理。
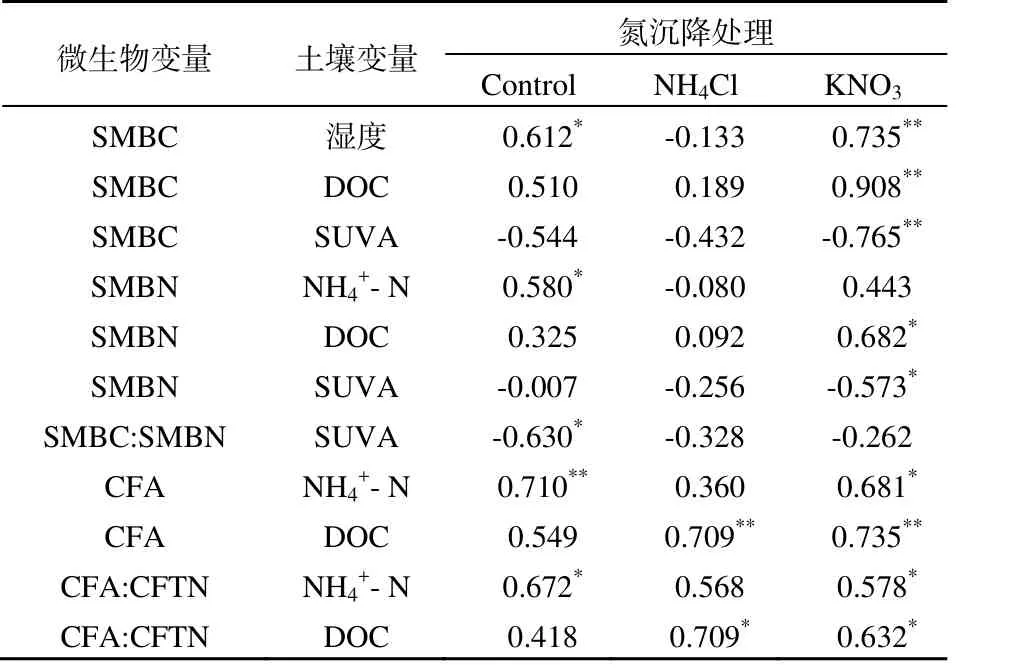
表2 土壤与微生物碳、氮库的相关系数Table 2 Pearson’s Correlation Coefficient between Soil and Microbial Carbon and Nitrogen Pools
土壤微生物碳氮库中C:N与SUVA呈显著负相关关系(表 2对照处理),微生物碳氮比例受到土壤碳库的品质影响,而氮沉降处理削弱了这种关系(如 NH4Cl和 KNO3处理)。虽然对照和KNO3处理CFA与土壤分别呈极显著和显著正相关关系,但是NH4Cl处理却不显著,部分原因可能是土壤氮素转化过程受到 Cl-的影响(Sindhu等,1967)。本研究还发现,氮沉降增加时土壤微生物氮库土壤DOC显著正相关(表2)。
3 讨论
在本研究的试验条件下,虽然氮沉降增加对森林表层土壤主要碳氮库尚未造成显著影响,但是NH4Cl形态的氮沉降增加导致土壤pH值迅速地下降,由此推测表层土壤酸化可能是NH4Cl形态氮沉降影响森林土壤碳氮过程的关键机制,而同期KNO3形态氮沉降对土壤碳氮库的影响尚不明确,这需要更长时间的观测研究。
森林表层土壤微生物碳氮库对KNO3形态的氮沉降输入未表现出明显的响应,但是却敏感地受到NH4Cl形态氮沉降增加的影响,土壤微生物碳、氮库比对照处理总体减少 18%和32%(平均值)。因此,在NH4Cl形态氮沉降增加的作用下,森林表层土壤微生物碳氮库的迅速减少不利于森林土壤氮素的生物固持,这将会加速森林土壤的氮素流失,引起氮沉降增加过程中森林土壤淋溶(“氮饱合”特征)增加的问题。在针对森林生态系统氮沉降的观测研究中,氮素形态是除剂量和观测时限以外的不应忽视的重要研究因素。
BROOKES P C, KRAGT J F, POWLSON D S, et al. 1985. Chloroform fumigation and the release of soil nitroge n: The effects of fumigation time and temperature [J]. Soil Biology and Biochemistry, 17(6): 831-835.
BROOKES P C, LANDMAN A, PRUDEN G, et al. 1985. Chloroform fumigation and the release of soil nitrogen: A rapid direct extraction method to measure microbial biomass nitrogen in soil [J]. Soil Biology and Biochemistry, 17(6): 837- 842.
COLE D W, RAPP M. 1981. Elemental cycling in forest ecosystems [A]. In:Heichle D E(ed) Dynamic Properties of Forest Ecosystems[C].London: Cambridge University Press: 341- 409.
GALLOWAY J N, COWLING E B. 2002. Reactive Nitrogen and The World:200 Years of Change [J]. AMBIO, 31(2):64- 71.
HAO Z Q, ZHANG J, SONG B, et al. 2007. Vertical structure and spatial associations of dominant tree species in an old-growth temperate forest[J]. Forest Ecology and Management, 252(1): 1-11.
JAFFRAIN J, GERARD F, MEYER M, et al. 2007. Assessing the quality of dissolved organic matter in forest soils using ultraviolet absorption spectrophotometry [J]. Soil Science Society of America Journal, 71(6):1851-1858.
JENKINSON D S. 1988. The determination of microbial biomass carbon and nitrogen in soil. In: Advances in nitrogen cycling in agricultural ecosystems (ed Wilson JR). CAB International, Wallingford: 368-386.JONES D L, HODGE A, KUZYAKOV. 2004. Plant and mycorrhizal regulation of rhizodeposition [J]. New Phytologist, 163(3): 459- 480.
KALBITZ K, SOLINGER S, PARK J H, et al. 2000. Controls on the dynamics of dissolved organic matter in soils: a review [J]. Soil Science, 165(3): 277- 304.
LAURIE A T, MARY A A. Ruth D Y. 1999. Forest floor microbial biomass across a northern hardwood successional sequence [J]. Soil Biology and Biochemistry, 31(3): 431- 439.
MARSCHNER H. 1996. Mineral Nutrition of Higher Plants, Academic Press, London: 108-112
SEDJO R A. 1993. The carbon cycle and global forest ecosystem [J]. Water,Air, and Soil Pollution. 70(1): 295- 307.
SHEN S M, PRUDEN G, JENKINSON D S. 1984. Mineralization and immobilization of nitrogen in fumigate d soil and the measurement of microbial biomass nitrogen [J]. Soil Biology and Biochemistry, 16(5):437- 444.
SINDHU M A and CORNFIELD A H. 1967. Comparative effects of varying levels of chlorides and sulphates of sodium, potassium, calcium and magnesium on ammonification and nitrification during incubation of soil [J]. Plant and Soil, 27(3): 468- 472.
STEVENS C J, DISE N B, MOUNTFORD J O. 2004. Impact of Nitrogen Deposition on the Species Richness of Grasslands [J]. Science,303(5665): 1876- 1879.
TAN K H. 1995. Soil sampling, preparation and analysis[M]. New York:Marcel Dekker: 332-336
VANCE E D, BROOKESA P C, JENKINSONA D S. 1987. An extraction method for measuring soil microbial biomass C [J]. Soil Biology and Biochemistry, 19(6): 703- 707.
VERVAET H, BOECKX P, BOKO A M C, et al. 2004. The role of gross and net N transformation processes and NH4+and NO3−immobilization in controlling the mineral N pool of a temperate mixed deciduous forest soil [J]. Plant and Soil, 264(1): 349- 357.
WU J, JOERGENSEN R G, Pommerening B, et al. 1990. Measurement of soil microbial biomass C: an automated procedure [J]. Soil Biology and Biochemistry, 22(8): 1167- 1169.
XU X K, HAN L, WANG, Y S, et al. 2007. Influence of vegetation types and soil properties on microbial biomass carbon and metabolic quotients in temperate volcanic and tropical forest soils [J]. Soil Science and Plant Nutrition, 53(4): 430- 440.
ZHU H F, FANG X Q, SHAO X M, et al. 2009. Tree ring-based February-April temperature reconstruction for Changbai Mountain in Northeast China and its implication for East Asian winter monsoon [J].Climate of The Past, 5(2): 661-666.
蔡玉婷, 黄永芳, 张太平等. 2013. 模拟氮沉降对木荷人工幼林地土壤氮素、碳素和微生物量垂直分布的影响[J]. 生态环境学报, 22(5):755-760.
傅民杰, 王传宽, 王颖等. 2009. 四种温带森林土壤氮矿化与硝化时空格局 [J], 生态学报, 29(7): 3747- 3758.
胡艳玲, 韩士杰, 李雪峰等. 2009. 长白山原始林和次生林土壤有效氮含量对模拟氮沉降的响应 [J]. 东北林业大学学报, 35(7): 36- 42.
尉海东,董彬. 2013. 鲁东南杨树人工林土壤微生物生物量碳的时空动态[J]. 生态环境学报, 22(2): 233-238.
赵玉涛, 韩士杰, 李雪峰等. 2009. 模拟氮沉降增加对土壤微生物量的影响 [J]. 东北林业大学学报, 37(1): 49-51.
