液相色谱-串联质谱法测定食用植物油中的棉酚
2014-05-08张文华黄超群
张文华, 黄超群, 谢 文*, 沈 立
(1.浙江出入境检验检疫局,浙江 杭州310016;2.上海出入境检验检疫局,上海200135)
棉酚(gossypol)是一种存在于棉花的棉籽及棉根皮中的多酚类物质。棉酚在棉籽初榨过程中转移至油中,粗制棉籽油中棉酚含量可达1%~1.3%[1]。长期食用棉酚较多的粗制棉籽油会引起中毒,影响生殖机能,导致不孕及胃肠障碍,甚至引起肺出血、呼吸困难等症状。棉籽油在其做成食用油前,必须经过精炼、漂白和去味3道工序,才能将其中的棉酚去除。由于棉酚毒性较大,国家标准GB2716-2005《食用植物油卫生标准》[2]规定食用植物油中棉酚的限量标准为0.02%(200 mg/kg)。近期台湾地区爆出“黑心油”事件后,台湾地区“卫生福利部”拟将食用油中棉酚的限量规定为1 mg/kg[3]。为了测定食用植物油中游离棉酚的含量是否超标,开展对食用植物油中游离棉酚含量的测定方法研究很有必要。
目前对棉酚的检测主要采用高效液相色谱法(HPLC)[4-6]、薄层色谱法[7]、紫外分光光度法[8,9]等。其中分光光度法测定时选择性不强,与棉酚有相似化学结构的物质均能被同时测定,使检测结果偏高;HPLC虽然得到广泛的应用,但低于1 mg/kg的棉酚含量已超出仪器的灵敏度极限。文献[10,11]采用液相色谱-串联质谱法(LC-MS/MS)分别测定了鲜蛋黄和棉籽中的棉酚,而利用LC-MS/MS对食用植物油中棉酚进行检测的方法未见报道。本工作所建立方法的测定低限达到1 mg/kg,能满足目前市场的检测需求,同时还能用作HPLC确证阳性样品的辅助方法。
1 实验部分
1.1 仪器、材料与试剂
Thermo TSQ Quantum Ultra液相色谱-串联质谱仪,配电喷雾电离源(ESI)(美国Thermo Fisher公司);Surveyor液相色谱系统(美国Finnigan公司);台式离心机(美国Thermo公司);AE260电子天平(瑞士Mettler公司);涡旋混匀器(上海医大仪器厂);超纯水净化系统(英国ELGA公司);微孔过滤膜(0.22μm,有机相)。
棉酚标准品:分子式为C30H30O8,相对分子质量为518.55,CAS No.303-45-7(上海安谱科学仪器有限公司),纯度为90.5%。准确称取经纯度折算后的棉酚10 mg,用丙酮溶解并定容至10 mL,配制成质量浓度为1 g/L的标准储备溶液,进一步采用食用油的空白样品提取液稀释成质量浓度为10、20、40、60、100μg/L 的标准工作溶液(现配现用)。丙酮(色谱纯,美国TEDIA公司);乙腈和甲酸(色谱纯,西班牙Scharlau公司);水为超纯水;无水乙醇为分析纯。甲酸溶液(0.1%):准确量取1 mL甲酸于1 L容量瓶中,加水并定容至刻度,混匀后备用。实验中所用其他试剂除特殊说明外均为分析纯。
1.2 样品前处理
准确称取1 g(精确至0.01 g)试样于50 mL离心管中,加入10 mL无水乙醇,剧烈振摇2 min,置于4℃冰箱中30 min,以4 000 r/min离心5 min后,取约2 mL上清液过滤。准确移取1.0mL,用无水乙醇稀释至10 mL,供LC-MS/MS测定。
1.3 LC-MS/MS检测条件
1.3.1 色谱条件
色谱柱:Agilent C18色谱柱(100 mm×2.1 mm,3.5μm);流动相:乙腈(A)-0.1%甲酸水溶液(B);梯度洗脱程序:0~2.0 min,50%A;2.0~4.0 min,50%A~90%A;4.0~6.0 min,90%A;6.0~7.0 min,90%A~50%A;7.0~10 min,50%A。流速为0.30 mL/min;柱温为室温;进样体积为5 μL。
1.3.2 质谱条件
电离方式:电喷雾离子源(ESI);扫描方式:负离子扫描;扫描模式:多反应监测(MRM);电喷雾电压(IS):3 500 V;离子源温度:300℃;毛细管温度:270℃;碰撞气:高纯氩气,0.2 Pa;鞘气:高纯氮气,6.5 L/min;辅助气:高纯氮气,5.0 L/min。用于定量分析的离子对为 m/z 517.1/230.9(碰撞电压43 V)。
2 结果与讨论
2.1 前处理条件的优化
2.1.1 标准品溶解溶剂的选择及稳定性的考察
棉酚是一种黄色不稳定的多酚羟基联萘醛类化合物,难溶于水、甘油、环己烷和苯,微溶于石油醚,易溶于无水乙醇、丙酮、乙醚、氯仿、甲醇等有机溶剂。为了选择合适的标准品溶解溶剂,本文进行了优化实验。将10 mg/L 的棉酚分别保存在甲醇、丙酮、乙腈和乙醇中,连续测试5天,如图1a所示,发现棉酚溶解在丙酮中比较稳定,棉酚降解的幅度不明显。棉酚储存在乙腈、乙醇和甲醇中则不稳定,棉酚都有一定的降解,在甲醇和乙醇中尤为明显,这与文献报道相符[12,13]。因此选用丙酮作为配制标准品储备液的溶剂。
将棉酚溶解于丙酮中,配成10 mg/L 标准品溶液,于4℃下保存放置。将刚配制时所测得的棉酚峰面积和分别储存0、1、3、5、7、14、30、60天后的结果作图比较(见图1b),RSD为11.5%。从图1b还可以看出,棉酚标准溶液在14天之内比较稳定。
由于试样采用无水乙醇提取,因此用无水乙醇对标准中间液和工作液进行配制,同时对其稳定性进行考察。如图1c所示,10 mg/L标准中间液在24 h内一直处于降解过程,但6 h内降解幅度较小。因此只要保证检测在6 h内完成,对于结果的准确性还是可以得到保证。同时,由图1c可知,标准中间液及工作液需现配现用。
2.1.2 提取溶剂的选择
文献中有用丙酮[14]、无水乙醇[4-6]、70% (v/v)丙酮水溶液[15]、不同体积比的乙腈磷酸水溶液提取的报道。大多数文献都是采用无水乙醇提取。本文重点对上述几种溶剂的提取效率进行了考察比较。实验结果显示,4℃静置30 min后,丙酮与油互溶,70%丙酮水溶液与油形成乳浊液,无法实现对棉酚的有效提取。无水乙醇和乙腈与油有明显的分层,且提取效率在90%以上。相比乙腈而言,无水乙醇的毒性更小。因此,本实验采用无水乙醇进行提取。
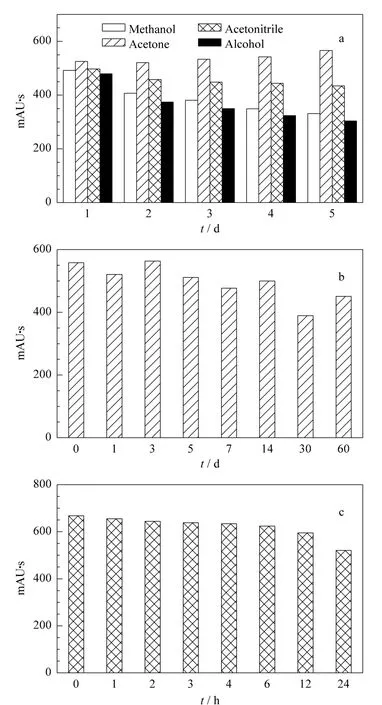
图1 棉酚标准品溶液在(a)不同溶剂中5天内、(b)丙酮中60天内和(c)无水乙醇中24 h内的稳定性考察Fig.1 Stability test of gossypol standard in(a)different reagents during 5 d,(b)acetone during 60 d,and(c)alcohol during24 h
为获得最佳提取效率,本文同时考察了提取次数对提取效率的影响。结果显示,提取一次,棉酚的提取率为80.1%;提取两次,棉酚的提取率为83.3%;说明随着提取次数的增加,棉酚的提取率没有明显增加。为了简化实验步骤,本文采用单次提取方式。
2.2 质谱条件的优化
将棉酚标准溶液(10μg/L)在ESI源负离子模式下进行母离子全扫描,确定准分子离子峰;通过调节离子化温度、喷雾电压等参数后进行子离子扫描,同时对碰撞能量进行优化,得到两个干扰较小的子离子m/z 230.9和471.1。其中 m/z 230.9离子的响应更高,被选作定量离子,471.1为辅助定性离子。图2分别为棉酚的碎片离子质谱图和样品的色谱图。
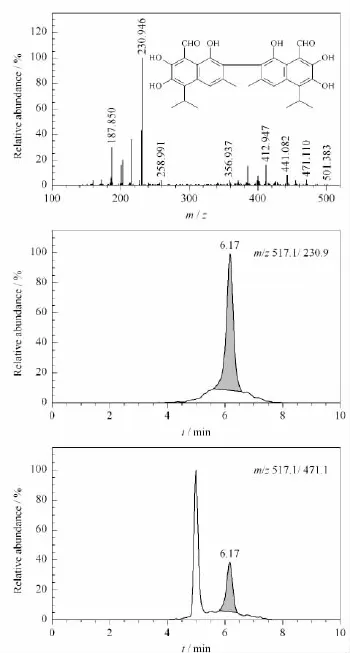
图2 棉酚标准品的碎片离子质谱图和样品的多反应监测(MRM)色谱图Fig.2 Product ion mass spectrum of gossypol standard and MRM chromatograms of sample
2.3 方法的线性关系、准确度、精密度和灵敏度
2.3.1 线性关系
由于质谱在电离和扫描过程中存在基质效应的影响[16],通常需采用内标法校正或基质匹配曲线[17]来消除或减弱基质效应。本实验测试了橄榄油、菜籽油、花生油和大豆油等不同种类植物油的基质效应,结果发现这些植物油的基质对棉酚离子化有很强的增强效应,而且差别不大。采用橄榄油空白样品溶液配制的标准工作液,其 m/z 517.1/230.9定量离子对响应为采用无水乙醇配制标准溶液的211%。因此,为消除样品基质效应,提高定量准确性,以食用油的空白样品提取溶液作为标准溶液的稀释溶液,可使标准溶液和样品溶液具有同样的离子化条件,从而补偿样品的基质效应。结果表明棉酚在10~100μg/L浓度范围均呈良好的线性关系,相关系数为0.999。如果样品中棉酚含量较高,处理后最终样液中浓度超过标准曲线范围,应用无水乙醇对其进行稀释。同时标准工作溶液应用稀释相同倍数的空白溶液进行配制。
2.3.2 回收率、精密度和测定低限
本方法对植物油中棉酚的测定低限为1 mg/kg,同时台湾地区和祖国大陆对植物油中棉酚的最低限量分别为1 mg/kg和200 mg/kg。因此在空白植物油中添加1、2、200 mg/kg 3个水平的棉酚标准溶液进行方法学考察(200 mg/kg添加水平下,样品稀释倍数适当加大),按优化条件提取并分析,每个添加水平平行测定6次。如表1所示,方法的平均回收率在87.4%~100%范围内,实验室内测定的精密度(以相对标准偏差(RSD)表示)小于10%。同时当空白植物油中添加1 mg/kg的棉酚时,方法的平均回收率为100%,RSD为9.8%,信噪比大于10,因此方法的测定低限被定为1 mg/kg。可见,该方法完全能满足植物油中棉酚的测定。

表1 植物油中棉酚的添加回收率与精密度(n=6)Table 1 Spiked recoveries and precisions of gossypolin edible oil(n=6)
3 结论
通过对影响液相色谱-串联质谱分离分析的主要因素进行优化和考察,建立了液相色谱-串联质谱法检测植物油中棉酚的分析方法。该方法测定低限为1 mg/kg,相比目前已见报道的分析方法,提高了灵敏度,也缩短了分析检测的时间。该方法快速简单,结果准确,重现性好。
[1] Baidu Encyclopedia(百度百科).(2007-05-29)[2014-01-20].http:/baike. baidu. com/link? url = cYITcw-NkA8nhF6RAY6U71ToagC04IxOoCrNqBC8PNzGZb8_AxxP-bIAhxPCWlqfh
[2] GB2716-2005
[3] Food Mate Net(食品伙伴网).(2013-10-29)[2014-01-20].http:/news.foodmate.net/2013/10/246990.html
[4] Yu J Q.Science and Technology of Cereals,Oils and Foods(于加乾.粮油食品科技),2013,21(4):78
[5] Zhang Q Z.Guangzhou Chemical Industry(张庆珍.广州化工),2012,40(15):159
[6] Wen J,Miao H,Wang X J,et al.Chinese Journal of Health Laboratory Technology(文君,缪红,王鲜俊,等.中国卫生检验杂志),2006,16(8):1017
[7] Shen J,Yang S,Yu H,et al.Chinese Journal of Spectroscopy Laboratory(沈静,阳胜,于红,等.光谱实验室),2011,28(1):235
[8] Zhao H X.Food Engineering(赵海霞.食品工程),2012(4):47
[9] Tian X Y,Yi J G,Xu S J,et al.Endemic Diseases Bulletin(田秀芸,易建国,徐世江,等.地方病通报),2003,18(4):91
[10] Shi Q Y.Modern Food Science and Technology(施琦贻.现代食品科技),2012,28(5):598
[11] Yao J,He X W,Li X X,et al.Science and Technology of Food Industry(姚军,何晓文,李新霞,等.食品工业科技),(2013-05-02)[2014-01-20].http:/www.cnki.net/kcms/detail/11.1759.TS.20130502.1348.010.html
[12] Nomeir A A,Abou-Donia M B.J Am Oil Chem Soc,1982,59:546
[13] Wu W W,Xu G R.Journal of Agricultural University of Hebei(吴伟伟,许赣荣.河北农业大学学报),2009,32(5):106
[14] Shen Y,Xue Y L,Jin Q Z,et al.China Oils and Fats(沈媛,薛雅琳,金青哲,等.中国油脂),2012,37(10):71
[15] Ma Y J,Shi G Y,Chen B.Journal of Hygiene Research(马勇健,石根勇,陈蓓.卫生研究),1993,22(5):302
[16] Xiang P,Shen M,Zhuo X Y.Journal of Instrumental Analysis(向平,沈敏,卓先义.分析测试学报),2009,28(6):753
[17] Perello A E,Moreno M V,Monaco C,et al.Biocontrol,2009,54(1):113
