血管内超声在兔主动脉血管成形术后再狭窄诊断中的应用
2014-05-08郑昌柱任雨笙贾国良李兰荪
郑昌柱,任雨笙,贾国良,李兰荪
(1上海市浦东新区周浦医院,上海201318;2第二军医大学长征医院;3第四军医大学西京医院)
动脉粥样硬化(AS)是一种由多种因素共同作用导致的严重危害人类健康的疾病,炎症、脂质浸润、血管内皮细胞受损、平滑肌细胞增生等在AS发病过程中起着关键作用[1,2]。近30年来,在评价冠心病的诊断和介入治疗的适应证和疗效方面,血管造影被公认为“金标准”。血管内超声(IVUS)是近年来应用于临床诊断血管病变的一种新的手段[3,4],IVUS不仅能提供血管腔的形态,而且能够显示血管壁的形态、结构和功能状态,分辨管腔斑块的大小、组成成分、分布以及观察斑块处血管的重构情况[5]。2010年6月~2012年6月,本实验采用高脂喂养及球囊损伤的新西兰兔胸腹主动脉建立AS及经皮腔内血管成形术(PTA)后再狭窄模型,在慢性实验过程中以血管病理学变化为基础,研究IVUS和血管造影对血管AS及PTA后血管再狭窄的诊断价值。
1 材料与方法
1.1 实验动物 纯种新西兰兔,雄性,7月龄,体质量2.5~3.5 kg,第四军医大学实验动物中心提供。
1.2 主要试剂与仪器 胆固醇(天津市东方卫生材料厂进口分装);单C臂心脏介入X线系统(Philips Lab,Holland);造影导管及经皮冠状动脉腔内血管成形术(PTCA)球囊导管(Cordis,US);HP SONS-100血管内超声诊断仪(HP,US);4.5 F超声导管探头(HP,US),频率20 MHz,转速1 500 r/min;超声图像记录仪(SONY,Japan),Shandon AS352R型切片机(Life Sci.Inter.Limited,England)。
1.3 方法
1.3.1 高脂动物模型的制备 30只纯种新西兰兔高脂饮食(1%胆固醇、5%蛋黄粉、1.5%猪油)喂养4周。3%戊巴比妥钠30 mg/kg麻醉动物后,常规穿刺右侧股动脉,经右股动脉送入4 F球囊导管至胸主动脉,分别以6、8、12个大气压充盈球囊后回拉至髂总动脉,反复回拉3次以造成腹主动脉内膜损伤。术后动物继续高脂饮食喂养。
1.3.2 主动脉血管造影 常规穿刺左侧股动脉,按100 U/kg给予肝素静注抗凝,分别于PTA前及PTA后1、3、6个月行主动脉血管造影,观察血管腔形态,以直径法测量血管腔狭窄程度。
1.3.3 IVUS检查 每次行主动脉血管造影后,在导引钢丝及扩张管辅助下,沿导引钢丝插入4.5 F的IVUS探头导管,自动匀速回拉超声导管,由胸主动脉依次向腹主动脉、髂总动脉观察血管腔、血管壁结构及斑块情况,对血管病变进行定量及定性诊断,包括血管外弹力膜面积、斑块性状(钙化斑块、软斑块、硬斑块和混合斑块)、纤维帽厚度、斑块偏心程度、脂质池的有无及血管重构情况等。实时记录图像、录像供脱机分析和存档。钙化斑块为斑块的回声比血管管壁外膜强且伴有声影;软斑块为斑块80%的组织回声弱于血管壁外膜;硬斑块为斑块的回声与血管壁外膜回声大致相同,但后方不伴声影;混合斑块为两种或两种以上斑块同时存在;斑块破裂表现为在斑块表面边缘局限的随血管搏动的回声区域突然中断。偏心性斑块为部分血管周长或整个血管的管周被斑块占据,但是斑块的最厚处同最薄处的比值 >2∶1。
1.3.4 血脂检查 分别于实验前、PTA前和PTA后6个月行血液生化检查,检测TC、TG、HDL-C水平,LDL-C水平按Friedewald公式计算。
1.3.5 统计学方法 采用SPSS10.0统计软件。计量资料以±s表示,采用t检验、方差分析;计数资料比较采用 χ2检测。P≤0.05为差异有统计学意义。
2 结果
2.1 高脂喂养前后血脂的变化 30只新西兰兔中3只因感染死亡,剩余27只顺利完成实验。PTA前以及PTA后6个月与实验前比较,TC、TG、LDL-C较基础水平显著增高(P均<0.01),HDL-C略有降低(P <0.05)。见表1。
表1 新西兰兔高脂喂养前后血脂的变化(mmol/L,±s)

表1 新西兰兔高脂喂养前后血脂的变化(mmol/L,±s)
注:与实验前比较,*P <0.05,△P <0.01;与 PTA 前比较,#P <0.01
观察时间 n TC TG LDL-C HDL-C实验前30 3.62 ± 0.92 0.89 ±0.37 1.45 ±0.52 0.89 ±0.18 PTA前 27 15.30± 8.45△ 3.27 ±0.75* 4.87±1.02△ 0.69±0.24*PTA 后6 个月 27 39.52 ±15.92△# 8.91 ±1.49△# 10.23 ±2.45△# 0.62 ±0.22*
2.2 两种方法检查主动脉血管内径的变化 血管造影结果显示,PTA前兔胸腹主动脉血管壁僵硬,造影剂分布无明显异常,管腔无明显狭窄。PTA后1个月胸腹主动脉及右髂总动脉均有不规则狭窄;PTA后3个月,血管腔形态表现为间断性狭窄,造影剂分布不均匀;PTA后6个月,血管腔呈明显的弥漫性狭窄,造影剂分布极不均匀。IVUS显示,PTA前兔胸腹主动脉及右髂总动脉血管壁结构层次基本完整,个别部位欠清晰;PTA后1个月时血管内膜增厚,6个月时内膜增厚更加明显;IVUS检查分布不均匀的强回声区明显多于PTA前,同时较血管造影组狭窄度明显,P<0.01。PTA前及PTA后6个月不同水平血管管腔内径变化见表2。
表2 两种方法检查不同水平主动脉PTA前及PTA后6个月血管内径的变化(mm,±s)
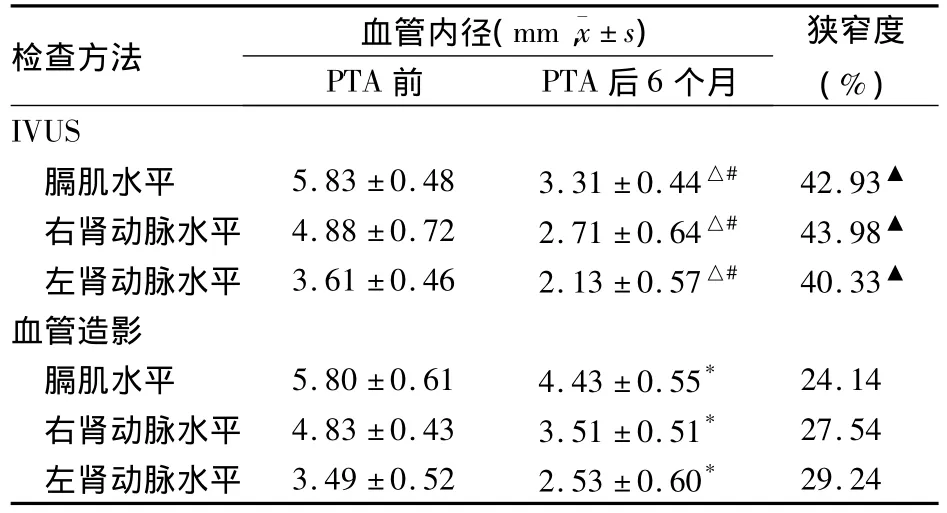
表2 两种方法检查不同水平主动脉PTA前及PTA后6个月血管内径的变化(mm,±s)
注:与同种方法PTA 前比较,*P <0.05,△P <0.01;与血管造影PTA 后6个月比较,#P <0.05,▲P <0.01
检查方法 血管内径(mm,±s)PTA前 PTA后6个月狭窄度(%)29.24 IVUS膈肌水平 5.83 ±0.48 3.31 ±0.44△# 42.93▲右肾动脉水平 4.88 ±0.72 2.71 ±0.64△# 43.98▲左肾动脉水平 3.61 ±0.46 2.13 ±0.57△# 40.33▲血管造影膈肌水平 5.80 ±0.61 4.43 ±0.55* 24.14右肾动脉水平 4.83 ±0.43 3.51 ±0.51* 27.54左肾动脉水平 3.49 ±0.52 2.53 ±0.60*
2.3 两种方法对PTA后6个月同病变血管性状检出率的比较 PTA后6个月内膜增厚广泛、明显,管腔呈不规则型狭窄,斑块突向管腔,致使管腔呈同心、偏心及不规则型狭窄,不同超声切面上可见2个或2个以上的斑块存在,斑块内呈不规则超声反射,PTA后6个月时IVUS检查分布不均匀的强回声区明显多于PTA前。IVUS对钙化斑块、偏心性斑块的检出率明显高于血管造影,差异有统计学意义(P均<0.05)。血管造影检测无法判定斑块硬斑块、软斑块以及斑块破裂。见表3。

表3 两种方法对PTA后6个月同病变血管性状检出率的比较[例(%)]
3 讨论
AS的形成与发展是一个缓慢的过程,血管组织的生长、损伤及修复过程对组织细胞本身是一种刺激。本实验采用高脂状态下的新西兰兔动脉血管损伤模型,应用球囊导管的机械作用模拟PTA导致兔动脉血管壁的损伤,观察AS过程中动脉血管组织的病理形态及影像学改变。血管造影一直作为冠状动脉病变诊断的“金标准”,能显示出血液流动的状况和管腔在动脉血管狭窄程度,但仅显示被造影剂填充后的轮廓,容易受重叠血管、投照角度的影响而存在盲区,同时可能因为斑块的形态、位置、性质、血管重构等因素的影响而低估其狭窄程度[6]。血管造影只能显示管腔的轮廓,如果没有广泛的钙化,无法确定病变成分,不能判断冠状动脉病变的性状特征[7]。在AS病变占据了管腔相当大的范围时,近端造影正常的血管节段也有某些程度的AS病变,“近端血管”病变问题,也影响血管造影的准确性;血管造影在诊断管腔狭窄方面也有局限性,如不规则狭窄、偏心性狭窄、同心圆性狭窄等;在推注造影剂过程中产生的液压有时可掩盖血管内膜的夹层。IVUS可在血管不同水平、不同角度测量血管的狭窄程度、血管壁的形态、管腔面积及管壁内膜、中膜增生的程度,同时观察血管内斑块的形态及性质[8~10]。
本实验结果显示,IVUS在反映血管腔内狭窄程度方面优于血管造影;在检测直径狭窄率方面,血管造影低于IVUS,差异有统计学意义。研究中还发现,早期AS的新西兰兔血管无明显狭窄时,IVUS检查可发现血管壁欠光滑,有低回声区,占据管腔某一象限的星月型的内膜增厚,此时血管造影往往显现为正常[11]。在PTA后不同时间段血管壁出现不规则型、星月型或同心圆型狭窄等,管壁排列结构欠清晰,病理结果证实为管壁组织细胞和基质成分包括血管平滑肌细胞和胶原的增生、迁移以及脂质的沉积、钙化等,同时IVUS较常规造影具有更强的评估斑块特性的能力,可确定血管病变属于软斑块、硬斑块或混合性斑块,并能提示血管造影不能发现的偏心性及表面不光滑斑块[12,13]。IVUS 结果显示,在脂质沉积的液化坏死区表现为低回声或无回声,坏死区血栓表现为低回声,在有纤维化时表现为回声增强,钙化时回声更强可伴有声影。本研究结果显示,IVUS对钙化斑块、偏心性斑块的检出率明显高于血管造影。血管造影检测手段无法判定硬斑块、软斑块以及斑块破裂。我们认为,IVUS可准确测量血管壁的厚度、血管腔的狭窄程度,以便了解血管全层的病理改变[14]。
总之,IVUS技术能为了解血管的内径、形态、内膜厚度及斑块的性质提供较为准确的定量信息,为心脏介入性治疗提供了较好的影像学技术,对冠状动脉及其他血管病变的治疗作出选择和决策具有指导意义。但IVUS在临床使用上仍有其局限性,其为一种有创检查,存在一定的并发症,如血管内膜撕裂、剥脱等,检查费用较为昂贵,目前的超声导管管径较粗且较僵硬等,在临床使用中尚需进一步积累经验。
[1]Dzau VJ,Braun-Dullaeus RC,Sedding DG.Vascular proliferation and atherosclerosis:new perspectives and therapeutic strategies[J].Nat Med,2002,8(11):1249-1256.
[2]Herder C,Baumert J,Thorand B,et al.Chemokines and incident coronary heart disease:results from the MONICA/KORA Augsburg case.Cohort study,1984-2002[J].Arterioscler Thromb Vase Boil,2006,26(9):2147-2152.
[3]Mauriee RL,Fromageau J,Cardinal MH,et al.Characterization of atheroaclerotie plaquesand muralthmmbiwith intravaacular u1trasound elastography:a potential method evaluated in an aortic rabbit model and ahuman coronary artery[J].IEEE Trans Inf Technol Biomed,2008,12(3):290-298.
[4]Cheng JM,Oemrawsingh R,Akkerhuis KM,et al.Association of serum cytokines with intravascular ultrasound-derived measures of coronary plaque burden and clinical outcome in patients undergoing coronary catheterization[J].J Am Coll Cardiol,2013,61(10):60184-60189.
[5]Mintz GS,Nissen SE,Anderson WD,et al.American College of Cardiology clinical expert consensus document on standards for acquisition,measurement and reporting of intravascular ultrasound studies(ivus).A report of the American Colege of Cardiology Task Force on Clinical Expert Consensus Documents[J].J Am Coil Cardiol,2001,37(5):1478-1492.
[6]Fernandes MR,Silva GV,Caixeta A,et al.Assessing intermediate coronary lesions:angiegraphie prediction of lesion severity on intravascular ultrasound[J].J Invssive Cardiol,2007,19(10):412-416.
[7]Hoffmann KR,Wahle A,Pellot Barakat C,et al.Biplane X-ray angiograms,intravascular ultrasound,and 3D visualization of coronary vessels[J].Int J Card Imaging,1999,15(6):495-512.
[8]Nair A,Kuban BD,Tuzcu EM,et al.Coronary plaque classification with intravascular ultrasound radiofrequency data analysis[J].Circulation,2002,106(17):2200-2206.
[9]Kotani J,Mintz GS,Rai PB,et al.Intravascular ultrasound assessment of angiographic filling defects in native coronary arteries:do they always contain thrombi[J].J Am Coll Cardiol,2004,44(10):2087-2089.
[10]李俊峡,郭洁,韩莎莎,等.血管内超声评价兔腹主动脉易损斑块模型[J].中国循证心血管医学杂志,2012,4(4):366-367.
[11] Von Birgelen C,Mintz GS,de Very EA,et al.Atherosclerotic coronary lesions with inadequate compensatory enlargement have smaller plaque and vessel volumes:observations with three dimensional intravascular ultrasound in vivo[J].Heart,1998,79(2):137-142.
[12]姜婕,虞华鹏,赵成军,等.冠状动脉造影和血管内超声诊断冠心病的对比研究[J].山东医药,2008,40(20):82.
[13]Hong MK,Mintz GS,Lee CW,et al.Intravascular ultrasound assessment of patterns of arterial remodeling in the absence of significant reference segment plaque burden in patients with coronary artery disease[J].J Am Coll Cardiol,2003,42(5):806-810.
[14]李俊峡,鹰津良树,宫本忠司,等.急性冠脉综合症与稳定型心绞痛患者冠脉病变的血管内超声比较研究[J].中华超声影像学杂志,2004,13(4):256.
