脑白质疏松轻度认知功能障碍静息态默认网络研究
2014-05-08石庆丽毕延超陈伟康陈红燕杨志杰陈宏宝张玉梅
石庆丽,毕延超,陈伟康,陈红燕,杨志杰,陈宏宝,张玉梅
·临床研究·
脑白质疏松轻度认知功能障碍静息态默认网络研究
石庆丽1,2,毕延超3,陈伟康4,陈红燕5,杨志杰6,陈宏宝6,张玉梅1
目的通过静息态功能磁共振成像(rs-fMRI)技术对脑白质疏松(LA)轻度认知障碍(MCI)患者脑默认网络进行分析。方法LA患者31例,临床痴呆评分(CDR)0.5;年龄、性别和受教育程度匹配的正常对照组27人,CDR为0。对入组人群进行rs-fMRI数据采集。使用SPM5软件进行分析处理,使用fMRI工具盒对预处理后的数据进行独立成分分析(ICA),组间差异进行双样本t检验。结果静息状态下,对照组默认网络包括扣带回后部/楔前叶,双侧额叶内侧,双侧颞中回,双侧顶下回、角回,双侧海马。MCI组默认网络激活区域同对照组一致;同对照组相比,MCI患者扣带回前部/左侧额叶内侧、右侧海马旁回/钩回、右侧颞下回、左侧额叶深部白质/尾状核头部激活减低,左侧尾状核/扣带回前部、左侧额叶、左侧颞上回/顶下回的激活升高。结论LA患者静息状态默认网络活动异常,可能与认知障碍的发生有关。
脑白质疏松;轻度认知障碍;静息态功能磁共振;默认网络
[本文著录格式]石庆丽,毕延超,陈伟康,等.脑白质疏松轻度认知功能障碍静息态默认网络研究[J].中国康复理论与实践, 2014,20(12):1133-1139.
脑白质疏松(leukoaraiosis,LA)是1987年由Hachinski等提出的一个影像学诊断术语[1],指脑室周围或皮质下脑白质的斑点状或斑片状改变。LA可见于阿尔茨海默病(Alzheimer's disease,AD)、皮质下动脉硬化性脑病(Binswanger's disease,BD)、血管性认知障碍、一氧化碳中毒及部分正常老年人。对于LA的发病率,各文献报道不一,老年人LA的发病率约50%~98%[2]。随着人口老龄化及影像学技术的进展,发病率越来越高,逐渐成为一个重要的全球性健康问题。
LA患者最常见的临床表现是认知障碍,它可以解释一些老年人出现的智力障碍,如不同程度的记忆力下降、注意功能低下、思维过程减慢、执行功能障碍等[3-5]。影像学研究表明,正常老年人出现LA表明有进一步发生认知障碍的风险[6]。LA级别和认知障碍程度正相关,随着LA级别增加,认知障碍程度加重[7-10]。
功能磁共振成像(functional magnetic resonance imaging,fMRI)是通过测定磁共振信号变化,反映血氧饱和度及血流量。血氧水平依赖(blood oxygen level-dependent,BOLD)-fMRI是目前应用最广泛的方法。静态-fMRI(resting-state,rs-fMRI)指受试者在闭眼、放松、静止不动,并避免任何有结构的思维活动状态的BOLD-fMRI[11]。研究表明,人在静息状态下,仍存在BOLD信号波动,且在这些自发振荡的信号中,存在某种特定的功能连接,主要存在于运动系统、听觉系统、视觉系统,反映了静息状态下人脑的活动[12]。一项基于正电子发射体层摄影(positron emission tomography,PET)的研究证实,人脑在静息状态下存在一种“默认网络(default-mode network,DMN)”[13],它负责人们在基础状态下的内省、环境警觉等内向思维活动。较早期的研究表明,这种默认网络区域包括内侧额叶/扣带回前部、颞叶下方、扣带回后部/楔前叶及后顶叶[13-14];后来发现,内侧颞叶区域也和这一网络相关[15-16]。
关于默认网络的功能,目前仍存在争议。基于认知任务的fMRI研究发现,在AD和遗忘型轻度认知障碍(amnestic mild cognitive impairment,aMCI)患者,这种默认网络在执行认知任务时出现活性降低,而在静息状态下会更加活跃[17-18],故有专家将其定义为一种和认知相关的基础活动[19-20]。fMRI研究表明,MCI患者默认网络的完整性破坏[21-25];和正常人相比,aMCI患者在内侧额叶、扣带回后部及顶叶区域的静息态活动减低,扣带回中部、内侧前额叶皮质、左侧下顶叶皮质默认网络活性增加[26]。以上研究提示,大脑某些区域在静息状态下激活程度的改变,可以作为区分MCI和正常人的一个有意义的功能性标志,fMRI可以用来区分正常人和认知障碍[27]。
本研究基于rs-fMRI探讨LA后MCI患者静息态默认网络的差异。
1 资料与方法
1.1 一般资料
来自北京天坛医院门诊及住院患者。所有LA患者均由同一名影像科专业人员根据患者颅脑MRI,使用Fazekas量表[28]进行筛选;对符合标准的LA患者,使用汉密尔顿抑郁量表(Hamilton Depression Scale, HAMD)进行抑郁测评[29],使用临床痴呆评定(Clinical Dementia Rating,CDR)[30]、简易精神状态检查(Mini-Mental State Exam,MMSE)及蒙特利尔认知评估(Montreal CognitiveAssessment,MoCA)进行认知测评。
另选择年龄、性别及受教育程度与患者组相匹配,颅脑MRI正常,CDR=0,MMSE≥24(初中及以上)/20(小学)/17(文盲)分,MoCA≥26分为对照组。
1.2 入组标准
1.2.1 纳入标准
患者组:①年龄45~80岁,有确切LA的MRI表现,即MRI T2WI脑室周围、皮质下明显白质高信号;②CDR为0.5,MMSE<24(初中及以上)/20(小学)/ 17(文盲),MoCA<26分(若受教育年限≤12年加1分);③未服用影响认知功能的药物;④无影响神经心理检查的疾病,包括听力、视力严重障碍,失语,优势侧偏瘫等;⑤无精神病史,如抑郁、焦虑、精神分裂症等,HAMD<7分;⑥体内无金属物品,能够配合完成常规及fMRI成像检查。
对照组:①年龄45~80岁,颅脑MRI正常,无脑梗死、脑白质病变、颅内占位等;②CDR为0,MMSE≥24(初中及以上)/20(小学)/17(文盲)分,Mo-CA≥26分(若受教育年限≤12年加1分);③未服用影响认知功能的药物;④无影响神经心理检查的疾病,包括听力、视力严重障碍、失语、优势侧偏瘫等;⑤无精神病史,如抑郁、精神分裂症等,HAMD<7分;⑥体内无金属物品,能够配合完成常规及fMRI成像检查。
1.2.2 排除标准
①精神病史;②符合帕金森病、额颞叶痴呆或亨廷顿病等可引起脑功能障碍的神经系统疾病的诊断标准,CT/MRI检查提示陈旧性脑梗死、神经系统退行性病变或者其他病变;③由其他病因导致的痴呆,如中枢神经系统创伤、肿瘤、感染、代谢性疾病,正常压力脑积水,叶酸、维生素B12缺乏,甲状腺功能低下等;④有头部外伤、癫痫或特殊药物服用史,或过去6个月内确定为酒精或药物依赖者;⑤有意识障碍、失语等其他影响认知评测的疾病;⑥并发严重心、肺、肝、肾功能障碍,重度内分泌、感染性、中毒性脑病,严重胃肠道疾病,肿瘤等。
1.3 研究方法
1.3.1 基本资料采集
实验前,对所有研究人群简单介绍研究的目的。每位入组者均签署知情同意书。
了解患者颅脑MRI LA情况,采集患者一般情况,包括年龄、性别、受教育程度、职业、现住址、联系方式等;了解患者既往病史(高血压、糖尿病、冠状动脉粥样硬化性心脏病、脂蛋白代谢紊乱、吸烟史、饮酒史等)。由经过中国康复研究中心神经心理测试培训班专业培训并取得资格证书的专业人员,在安静、无外界干扰的房间对患者行HAMD、CDR、MMSE及MoCA测评。
1.3.2 影像学数据采集
由北京天坛医院同一名影像科专业人员完成。采用3.0 T Trio磁共振成像系统(西门子)。数据采集过程中,患者清醒,闭目,平静呼吸,嘱患者尽量避免思维活动。头部固定,最大限度减少头部和身体其他部位的运动。
常规床位校正、匀场后,先行自旋回波(SE)序列矢状面、横断面T1WI扫描,T2WI轴位、T2FLAIR轴位扫描。扫描范围包括全脑,所有层面均与前后联合连线(AC-PC)平行。
1.4 统计学分析
1.4.1 临床资料
计量资料如年龄、MMSE评分、MoCA评分、受教育程度,经正态性检验,均符合正态分布,应用独立样本t检验进行组间比较;计数资料如性别组成,应用χ2检验;既往病史,如高血压病、糖尿病、脂代谢紊乱、吸烟、饮酒等,采用Fisher精确概率算法比较。显著性水平α=0.05。
1.4.2 影像学数据
对于采集得到的rs-fMRI数据,请北京师范大学信号与信息处理专业人员进行数据处理。
使用SPM(Statistical Parametric Mapping)5软件进行数据预处理。
所有像素都被设成参数统计模型。对于实验数据和混杂因素,采用一般线性模型(general linear model, GLM)进行描述。对GLM得到的参数采用统计参数图进行统计推断,最终得到该组被试的静息态激活区(P<0.05)。
采用fMRI工具盒对两组预处理后的数据进行空间独立成分分析(independent component analysis, ICA),组间比较采用独立样本t检验。
2 结果
2.1 一般资料
两组均为右利手。两组间在年龄、性别组成、受教育程度、高血压病、糖尿病、脂代谢紊乱、吸烟及饮酒史方面均无显著性差异(P>0.05),MMSE及Mo-CA评分有显著性差异(P<0.05)。见表1。
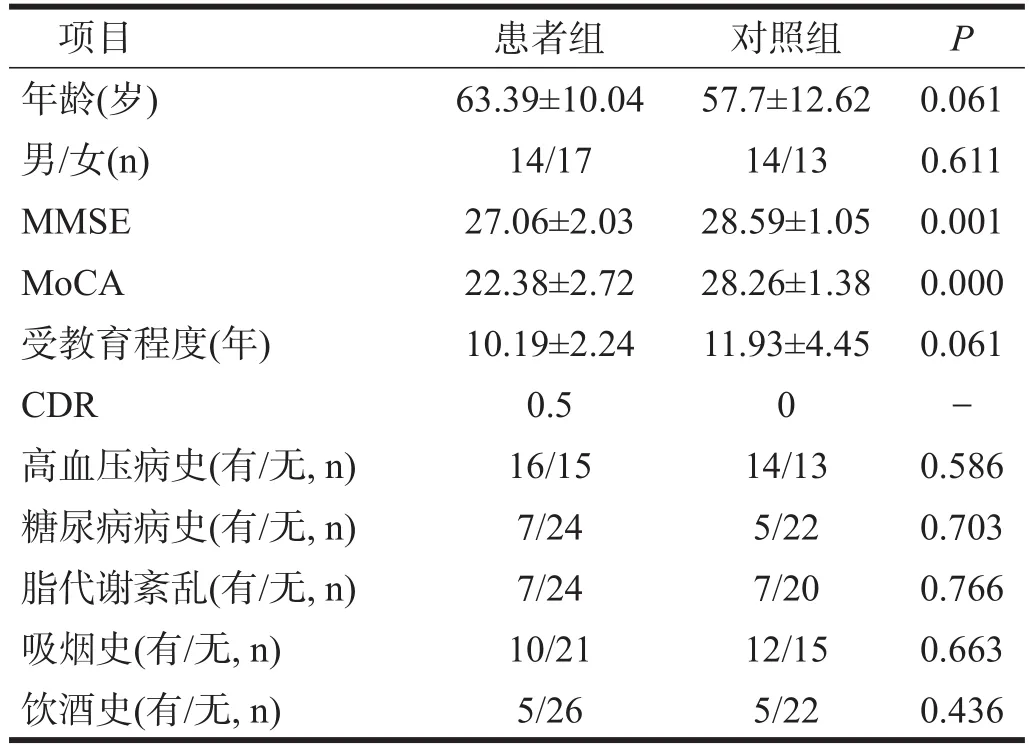
表1 两组一般资料比较
2.2 默认网络
脑静息状态下激活区域有双侧额叶内侧、双侧颞中回、双侧顶上小叶、双侧角回、双侧枕叶、扣带回后部/楔前叶。见图1。
患者组脑静息态激活区有双侧额叶内侧、双侧颞中回、双侧顶上小叶、双侧角回、双侧枕叶、扣带回后部/楔前叶,与对照组基本一致。见图2。
2.3 静息态激活区域间的差异
与对照组相比,患者组静息状态下有多个激活区的BOLD信号强度更低(图3)或更高(图4)。
患者组较对照组激活降低的区域有扣带回前部/左侧额叶内侧、右侧海马旁回/钩回、右侧颞下回、左侧额中回深部白质/尾状核头部(P<0.05);右侧枕叶、右侧底节区、左侧扣带回后部无显著性差异(P>0.05)。见表2。激活增强的区域有左侧尾状核、右侧额叶、颞上回/顶下回(P<0.05),扣带回后部/楔前叶无显著性差异(P>0.05)。见表3。
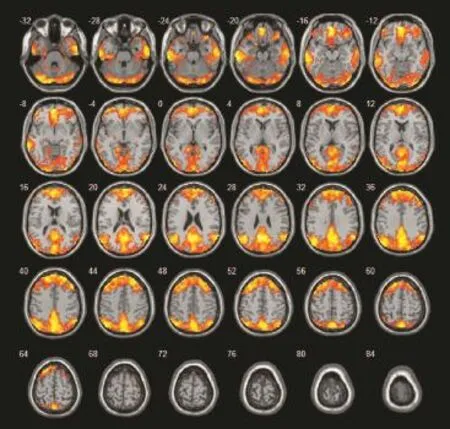
图1 对照组静息态脑激活区

图2 患者组静息态脑激活区
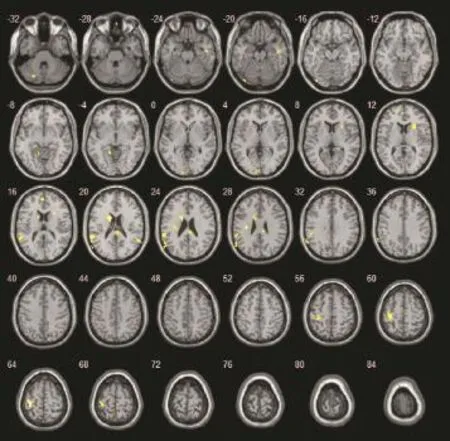
图3 对照组较患者组激活增强的区域(NC-MCI)
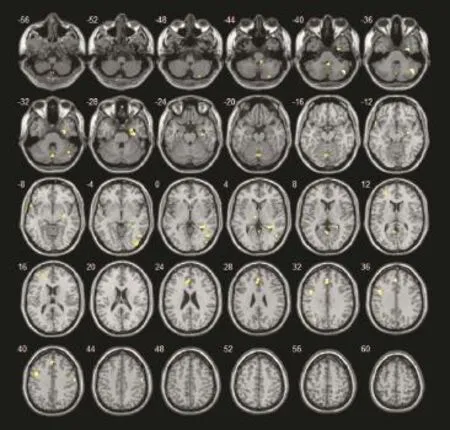
图4 患者组较对照组激活增强的区域(MCI-NC)

表2 对照组较患者组激活增强的区域(NC-MCI)
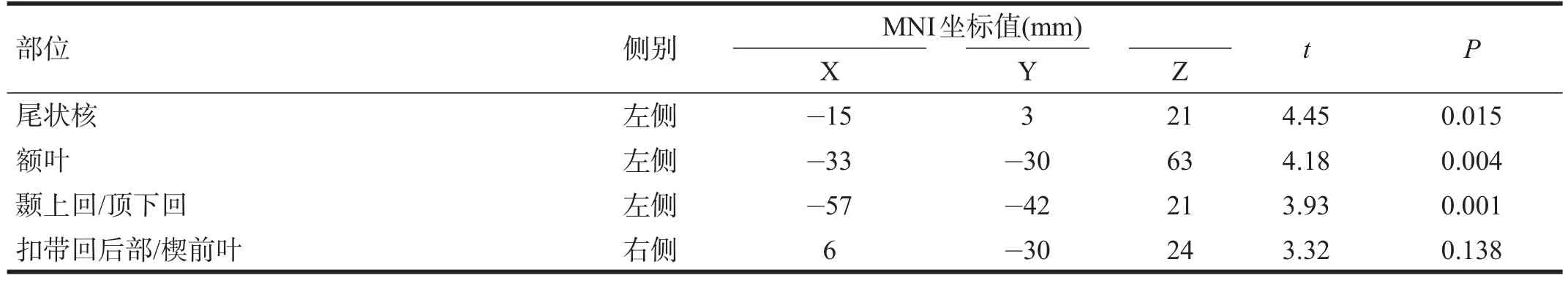
表3 患者组较对照组激活增强的区域(MCI-NC)
3 讨论
3.1 fMRI及其在默认网络中的应用
研究显示,大脑在没有执行任务,即清醒、休息状态时,在一些特定脑区存在着功能活动[31-34]。Raichle提出了静息态脑活动假说,认为大脑在无任务的清醒、静息状态下就存在有组织的脑区功能活动,这些脑区主要包括前额叶中内侧、扣带回前部、扣带回后部及两侧顶下小叶等[13]。利用fMRI和PET等的研究已经一致发现,大脑在静息状态存在高活动、高代谢的空间模式[35],这些区域包括内侧前额叶皮质、扣带回后部/楔前叶、海马[13];后来又有研究发现内侧颞叶[15-16]也属于默认网络的一部分。这些区域成为多数默认模式功能研究观察的主要区域。
关于默认网络活性的功能影像学研究有两种基本方法。传统的方式是将静息态(闭眼、安静睁眼放松)和基于认知任务的两种状态进行比较。使用这种方法的结果表明,默认网络区域表现出基于任务状态下的激活减低[18,35]。另一种检测方法涉及单纯静息状态下孤立网络的大脑活动。
本项研究采集两组在安静、闭眼、无任何思维活动下的静息态fMRI图像,使用ICA法对数据进行后处理,得出正常人脑静息状态下的激活区域。结果显示,正常人脑在静息态下的激活区域有双侧前额叶内侧、双侧颞中回、双侧顶上小叶、角回、双侧枕叶、扣带回后部/楔前叶,这同既往研究基本一致[13,15-16,31]。同时我们得到LA MCI患者的脑静息态激活区域,和对照组基本一致。
3.2 认知障碍与默认网络
鉴于默认网络包含的区域和记忆相关(尤其是海马),并且多项研究表明,默认网络相关区域在执行认知任务时出现激活程度的减低[17-18],因此认为默认网络和认知相关[19-20],从而更多的被用于认知功能障碍的研究,尤其是对aMCI和AD的研究最多。
MCI是AD的一个前驱阶段。研究表明,与正常同年龄阶段人群相比,aMCI患者每年转化为AD或痴呆的比例为6%~25%[36]。临床随访研究表明,约一半aMCI患者在3~5年内会转化为AD[37-39]。关于aMCI的研究发现,默认网络中激活程度减低的区域主要在内外侧顶叶皮层区域[40-41]。有研究将rs-fMRI和认知任务相结合,发现同正常人相比,除了外侧前额叶皮质外,aMCI患者在左侧内侧颞叶、左侧内侧颞回、扣带回后部/扣带回压部皮质/楔前叶及右侧角回的默认网络活性也有降低,而左侧外侧前额叶皮质、左侧内侧颞回及右侧角回部位的默认网络活性和记忆得分呈正相关[27]。最近一项关于aMCI的静息态默认网络各区域之间连接关系的多变量Granger因果关系分析研究表明,aMCI患者颞中回、海马及梭状回之间,及楔前叶/扣带回后部与海马之间的功能连接下降,并且这种连接的损害同患者的语义记忆学习能力相关,从而强调了默认网络功能连接的改变在aMCI病理生理学机制中的重要性[42]。
Rombouts等使用视觉编码任务及非空间工作记忆任务观察正常人、aMCI和AD患者的默认网络区的激活减低情况,发现aMCI激活减低程度较正常人高,较AD患者低[24]。后来的一项rs-fMRI研究发现,同正常人相比,aMCI患者在扣带回后部和楔前叶的激活降低,而右侧下顶叶、右侧梭状回及双侧壳核激活升高[43]。近期有研究发现,同正常对照组相比,aMCI患者在默认网络区域表现出激活减低,包括楔前叶/扣带回后部、右侧下顶叶及左侧梭状回,右侧内侧颞叶激活也有降低的趋势;aMCI患者左侧前额叶皮质、左侧下顶叶及左侧颞中回活性升高[44]。Wang等发现,在静息状态下,aMCI组右侧海马存在连接的缺失[45]。
本项研究入组的患者为LA相关MCI患者,研究结果表明,相对于对照组,患者各区域的激活普遍降低,其中在扣带回前部/左侧额叶内侧、右侧海马旁回/钩回、右侧颞下回、左侧额叶深部白质/尾状核头部区域激活强度的差异有统计学意义。
本研究结果中得出患者激活减低区域同既往研究结果不一致。有差异的激活减低区域,多数为认知相关区域(额叶内侧面、海马、颞下回),LA患者认知障碍的发生可能与上述区域激活减低有一定关系,而不仅仅限于既往研究所证实的由于与记忆、情绪、行为等智力有关的边缘环路(内侧边缘环路、基底外侧边缘环路和防御环路)被中断所致[46],有待进一步研究证实。同时,患者在左侧尾状核、右侧额叶、左侧颞上回/顶下回的激活较正常人升高。
我们的研究结果同既往研究的差异,考虑与下列因素有关。
①入组患者类型不同:既往多项研究是关于aMCI患者,尚无LA相关MCI患者的rs-fMRI研究;而本研究入组的患者为LA所致的MCI,而非单纯aMCI。②入组人群的年龄构成不同:关于静息态默认网络的研究表明,同年轻者的大脑相比,老年人的默认网络区域更大;在静息状态下,老年患者在额叶下方、中间及眶部皮层,内侧及外侧颞叶皮层区域静息态活动较年轻人明显[22],说明人脑rs-fMRI静息态默认网络具有年龄相关性;本研究人群限于中老年人,而既往关于正常人静息态默认网络的相关研究多数是中青年人;研究人群的年龄组成不同会影响默认网络的激活区域,从而造成研究之间的差异。
本研究采用3.0 T磁共振仪进行fMRI研究,这在国内外对LA MCI患者rs-fMRI研究中应用极少。3.0 T MR设备的信噪比1.5 T更高,因此,对fMRI信号的检测更敏感、准确;所得的分析结果使用相关软件获得,避免了操作者的主观误差,从而使所得到的脑功能连接更加准确、全面,更加客观;采用rs-fMRI方法对LA所致MCI患者的默认网络进行评估,这相对于基于任务的fMRI来说,患者更容易配合检查,减少因不能配合检查所致的数据丢失。
我们的研究样本量不够大,因此,没有对认知障碍的类型与静息状态下脑激活区的关系进行相关性分析;研究仅限于MCI的患者,对于认知障碍严重程度与静息态下脑默认网络之间的关系未进行相关性分析。今后可考虑增加分组及样本量,针对不同原因所致认知障碍患者的脑默认网络特点进行探讨。
[1]Hachinski VC,Potter P,Merskey H.Leukoaraiosis[J].Arch Neurol,1987,44(1):21-23.
[2]Wen W,Sachdev PS,Li JJ,et al.White matter hyperintensities in the forties:their prevalence and topography in an epidemiological sample aged 44-48[J].Human Brain Mapping,2009,30(4): 1155-1167.
[3]Burns JM,Church JA,Johnson DK,et al.White matter lesions are prevalent but differentially related with cognition in aging and earlyAlzheimer disease[J].Arch Neurol,2005,62(12):1870-1876.
[4]Price CC,Jefferson AL,Merino JG,et al.Subcortical vascular dementia:Integrating neuropsychological and neuroradiologic data[J].Neurology,2005,65(3):376-382.
[5]Lamar M,Dannhauser TM,Walker Z,et al.Memory complaints with and without memory impairment:the impact of lerkoaraiosis on cognition[J].J Int Neuropsychol Soc,2011,17(6):1104-1112.
[6]Ross ED,Hansel SL,Orbelo DM,et al.Relationship of leukoaraiosis to cognitive decline and cognitive aging[J].Cogn Behav Neurol,2005,18(2):89-97.
[7]Longstreth WT Jr,Arnold AM,Beauchamp NJ Jr,et al.Incidence-manifestations and predictors of worsening white matter on serial cranial magnetic resonance imaging in the elderly:the cardiovascular health study[J].Stroke,2005,36(1):56-61.
[8]van Straaten EC,Fazekas F,Rostrup E,et al.Impact of white matter hyperintensities scoring method on correlations with clinical data:the LADIS study[J].Stroke,2006,37(3):836-840.
[9]Adam MB,Karen LS,Jordan M,et al.White matter hyperintensities and cognition:Testing the reserve hypothes[J].Neurobiol Aging,2011,32(9):1588-1598.
[10]潘婕,罗本燕.小血管病性脑白质病变与认知功能障碍关系研究[J].中国卒中杂志,2012,7(10):762-768.
[11]Mazoyer B,Zago L,Mellet E,et al.Cortical network for working memory and executive function sustain the conscious resting state in man brain[J].Res Bull,2001,54(3):287-298.
[12]Biswal B,Yetkin FZ,Haughton VM,et al.Functional connectivity in the motor cortex of resting human brain using echo-planar MRI[J].Magn Reson Med,1995,34(4):537-541.
[13]Raichle ME,MacLeod AM,Snyder AZ,et al.A default mode of brain function[J].Proc Natl Acad Sci U S A,2001,98(2): 676-682.
[14]Shulman G,Fiez J,Corbetta M,et al.Common blood flow changes across visual tasks:II.Decreases in cerebral cortex[J].J Cogn Neurosci,1997,9(5):648-663.
[15]Esposito F,Bertolino A,Scarabino T,et al.Independent component model of the default-mode brain function:Assessing the impact of active thinking[J].Brain Res Bull,2006,70(4-6):263-269.
[16]Greicius MD,Menon V.Default-mode activity during a passive sensory task:uncoupled from deactivation but impacting activation[J].J Cogn Neurosci,2004,16(9):1484-1492.
[17]Buckner RL,Andrews-Hanna JR,Schacter D.The brain's default network[J].Annu N YAcad Sci,2008,1124:11-38.
[18]Buckner RL,Snyder AZ,Shannon BJ,et al.Molecular structural, and functional characterization of Alzheimer's disease:evidence for a relationship between default activity,amyloid,and memory[J].J Neurosci,2005,25(34):7709-7717.
[19]Morcom AM,Fletcher PC.Does the brain have a baseline?Why we should be resisting a rest[J].Neuroimage,2007,37(4): 1073-1082.
[20]Morcom AM,Fletcher PC.Cognitive neuroscience:the case for designratherthatdefault[J].Neuroimage,2007,37(4): 1097-1099.
[21]Bai F,Watson DR,Yu H,et al.Abnormal resting-state functional connectivity of posterior cingulate cortex in amnestic type mild cognitive impairment[J].Brain Res,2009,1302:167-174.
[22]Greicius MD,Srivastava G,Reiss AL,et al.Default-mode network activity distinguishes Alzheimer's disease from healthy aging:evidence from functional MRI[J].Proc Natl Acad Sci U S A, 2004,101(13):4637-4642.
[23]Hedden T,Van Dijk KR,Becker JA,et al.Disruption of functional connectivity in clinically normal older adults harboring amyloid burden[J].J Neurosci,2009,29(40):12686-12694.
[24]Rombouts SA,Barkhof F,Goekoop R,et al.Altered resting state networks in mild cognitive impairment and mild Alzheimer's disease:an fMRI study[J].Hum Brain Mapp,2005,26(4):231-239.
[25]Sorg C,Riedl V,Muhlau M,et al.Selective changes of resting-state networks in individual sat risk for Alzheimer's disease[J].Proc NatlAcad Sci U SA,2007,104(47):18760-18765.
[26]Jin MW,Pelak VS,Cordes D.Aberrant default mode network in subjects with amnestic mild cognitive impairment using resting-state functional MRI[J].Magn Reson Imaging,2012,30(1): 48-61.
[27]Mohammad Ali Oghabiana,Seyed Amir Hossein Batouli,Maryam Norouzian,et al.Using functional magnetic resonance imaging to differentiate between healthy aging subjects,mild cognitive impairment,and Alzheimer's patients[J].J Res Med Sci,2010,15 (2):84-93.
[28]Fazekas F,Chawluk JB,Alavi A,et al.MR signal abnormalities at 1.5 T in Alzheimer's dementia and normal aging[J].Am J Roentgenol,1987,149(2):351-356.
[29]Hamilton M.A rating scale for depression[J].J Neurol Neurosurg Psychiatry,1960,23:56-62.
[30]Morris JC.The Clinical Dementia Rating(CDR):Current version and scoring rules[J].Neurology,1993,43(11):2412-2414.
[31]Damoiseaux JS,Rombouts SA,Barkhof F,et al.Consistent resting-state networks across healthy subjects[J].Proc Natl Acad Sci U SA,2006,103(37):13848-13853.
[32]Bressler SL,Menon V.Large-scale brain networks in cognition: Emerging methods and principles[J].Trends Cogn Sci,2010,14 (6):277-290.
[33]Christoff K,Gordon AM,Smallwood J,et al.Experience sampling during fMRI reveals default network and executive system contributions tomind wandering[J].Proc Natl Acad Sci U S A, 2009,106(21):8719-8724.
[34]Ralchle ME,Mintun MA.Brain work and brain imaging[J].Annu Rev Neurosci,2006,29:449-476.
[35]Mesulam M.Defining neurocognitive networks in the BOLD new world of computed connectivity[J].Neuron,2009,62(1): 1-3.
[36]Petersen RC,Doody R,Kurz A,et al.Current concepts in mild cognitive impairment[J].Arch Neurol,2001,58(12):1985-1992.
[37]Jicha GA,Parisi JE,Dickson DW,et al.Neuropathologic outcome of mild cognitive impairment following progression to clinical dementia[J].Arch Neurol,2006,63(5):674-681.
[38]Markesbery WR,Schmitt FA,Kryscio RJ,et al.Neuropathologic substrate of mild cognitive impairment[J].Arch Neurol,2006,63 (1):38-46.
[39]Morris JC,Storandt M,Miller JP,et al.Mild cognitive impairment represents early-stage Alzheimer disease[J].Arch Neurol, 2001,58(3):397-405.
[40]Celone KA,Calhoun VD,Dickerson BC,et al.Alterations in memory networks in mild cognitive impairment and Alzheimer's disease:an independent component analysis[J].J Neurosci,2006, 26(40):10222-10231.
[41]Petrella JR,Wang L,Krishnan S,et al.Cortical deactivation in mild cognitive impairment:high-field-strength functional MR imaging[J].Radiology,2007,245(1):224-235.
[42]Yan H,Zhang Y,Chen H,et al.Altered effective connectivity of the default mode network in resting-state amnestic type mild cognitive impairment[J].J Int Neuropsychol Soc,2013,19(4): 400-409.
[43]Bai F,Zhang Z,Yu H,et al.Default-mode network activity distinguishes amnestic type mild cognitive impairment from healthy aging:A combined structural and resting-state functional MRI study[J].Neurosci Lett,2008,438(1):111-115.
[44]Qi Z,Wu X,Wang Z,et al.Impairment and compensation coexist in amnestic MCI default mode network[J].NeuroImage,2010, 50(1):48-55.
[45]Wang Y,Risacher SL,West JD,et al.Altered default mode network connectivity in older adults with cognitive complaints and amnestic mild cognitive impairment[J].J Alzheimers Dis,2013, 35(4):751-760.
[46]Barber R,Gholkar A,Sheltens P,et al.MRI volurnetric correlates of white matter lesions in dementia with Lewy bodies and Alzheimer's disease[J].Int J Geriatr Psychiatry,2000,15(10): 911-916.
Resting-state Default Mode Network of Leukoaraiosis Patients with Mild Cognitive Impairment
S HI Qing-li,BI Yan-chao,CHEN Wei-kang,CHEN Hong-yan,YANG Zhi-jie,CHEN Hong-bao,ZHANG Yu-mei.Department of Neurology,Beijing Tiantan Hospital,Capital Medical University,Beijing 100050,China
ObjectiveTo study the default mode network(DMN)of mild cognitive impairment(MCI)related to leukoaraiosis(LA) with resting-state functional magnetic resonance imaging(rs-fMRI).Methods31 LA patients(Clinical Dementia Rating of 0.5)and 27 normal controls(Clinical Dementia Rating of 0,and matched in age,gender and lever of education)were scanned with the rs-fMRI.The data was analyzed with SPM5 software,using independent component analysis.The differences between the both groups were compared with two-sample t-test.ResultsThe DMN during resting-state of normal controls was posterior cingulate cortex/precuneus,bilateral medial frontal cortex,bilateral middle temporal gyrus,bilateral inferior parietal gyrus,angular gyrus,bilateral hippocampus.The DMN of MCI group was consistent with the normal controls,but the activation decreased in anterior cingulate cortex/left medial frontal lobe,right parahippcampus/uncus,right inferior temporal gyrus,left deep frontal white matter/head of caudate nucleus;and increased in the left caudate nucleus/anterior cingulate cortex,left frontal lobe,and left superior temporal gyrus/inferior parietal gyrus.ConclusionActivation of resting-state functional network is disorder in LA,which may relate to cognitive impairment.
leukoaraiosis;mild cognitive impairment;resting-state functional magnetic resonance imaging;default mode network
10.3969/j.issn.1006-9771.2014.12.009
R742
A
1006-9771(2014)12-1133-07
2013-11-12
2013-12-04)
1.北京师范大学认知神经科学与学习国家重点实验室办公室开放课题;2.国家自然科学基金项目(No.81371201、No.31171073);3.国家社科基金重大项目(No.11&ZD186);4.国家科技支撑计划项目(No.2013BAI09B03);5.北京市卫生局高层次人才基金(No.11420076);6.北京市教委课题(No.KM20130025019);7.“973”青年科学家项目(No.2013CB837300);8.北京脑重大疾病研究院项目(No.BIBD-PXM2013_014226_07_ 000084)。
1.首都医科大学附属北京天坛医院神经内科,国家神经系统疾病临床医学研究中心,北京脑重大疾病研究院脑卒中研究所,脑血管病转化医学北京市重点实验室,北京市100050;2.北京市平谷区医院神经内科,北京市101200;3.北京师范大学认知与学习国家重点实验室,北京市100875;4.温州医科大学附属丽水市人民医院神经内科,浙江丽水市323000;5.首都医科大学附属北京天坛医院影像中心,北京市100050;6.河北省香河县人民医院脑血管科,河北廊坊市065400。作者简介:石庆丽(1987-),女,汉族,山东菏泽市人,硕士,医师,主要研究方向:脑血管病、认知功能障碍。通讯作者:张玉梅,硕士研究生导师,主要研究方向:脑血管病、认知功能障碍。E-mail:meini96@sohu.com。
