Snail和SRF在人恶性脑胶质瘤中的表达及其与微血管密度的关系
2014-05-06华海侠董玉宝王晓华付占昭
华海侠,董玉宝,王晓华,姚 薇,王 玲,付占昭*,顾 涛,赵 敏
(秦皇岛市第一医院1.肿瘤内科;3.老年病科;4.急诊科;5.病理科,河北秦皇岛066000;2.抚宁县人民医院肿瘤科,河北秦皇岛066300)
Snail和SRF在人恶性脑胶质瘤中的表达及其与微血管密度的关系
华海侠1,董玉宝2,王晓华3,姚 薇1,王 玲4,付占昭1*,顾 涛1,赵 敏5
(秦皇岛市第一医院1.肿瘤内科;3.老年病科;4.急诊科;5.病理科,河北秦皇岛066000;2.抚宁县人民医院肿瘤科,河北秦皇岛066300)
胶质瘤是神经系统常见肿瘤,手术和传统放化疗手段效果不佳[1]。胶质瘤的发生机制尚未完全阐明,但是目前认为肿瘤细胞获得侵袭和转移的能力,以及产生放化疗耐药能力是肿瘤复发和生存率低的分子基础[2]。本研究通过检测锌指蛋白转录因子Snail和血清反应因子(SRF),观察二者与微血管密度(MVD)之间的关系,为探讨胶质瘤发生机制提供一定的实验依据。
1 材料与方法
1.1 临床标本 收集秦皇岛市第一医院2010年6月至2012年6月间手术切除,经病理确诊的脑胶质瘤石蜡标本80例,并按照2007年WHO中枢神经系统肿瘤分类及分级标准复诊并进行病理组织学分级,其中Ⅰ级5例,Ⅱ级32例,Ⅲ级25例,Ⅳ级18例。对照组脑组织15例,均来自癌旁正常脑组织。
1.2 方法 所有石蜡切片均常规行HE染色,均由2名病理科医师分别进行组织学观察,5μm连续切片,分别行Snail、SRF和CD34免疫组织化学染色,抗体浓度均为1∶100,采用枸盐酸热修复,实验中分别设立阴性对照和阳性对照。
1.3 结果判定 由2名病理科医师独立阅片,在400倍视野下观察10个视野,每视野计数100个细胞,计算阳性细胞百分比,按照以下4级进行计分:0分:阳性细胞数<10%;1分:10%-25%;2分:26%-50%;3分:51%-75%;4分:>75%。染色强度评分标准:无色0分;淡黄色1分;棕黄色2分;棕色或棕褐色3分。以两者乘积作为阳性评判标准,其中4分以上定义为阳性。CD34表达以血管内皮细胞胞浆棕黄色着色,计数标准为:棕黄色的单个、数个内皮细胞可计数为1个血管,计数5个不连续高倍视野内的微血管数,取其平均值作为该病例的微血管密度值。
1.4 统计学处理 用SPSS13.0进行统计,不同组别间比较采用χ2检验,MVD两组间采用t检验,相关性分析采用spearman相关系数法,以P<0.05表示差异具有统计学意义。
2 结果
2.1 Snail、SRF在两组中的表达 Snail、SRF在胶质瘤中阳性表达率分别为70.00%、45.00%,显著高于对照组的26.67%、13.33%,两组间比较差异均具有统计学意义(P<0.05)。
2.2 CD34染色结果及MVD测定 胶质瘤组织中血管壁CD34免疫组织化学染色呈棕黄色,微血管形态呈芽状、管状、条索状。脑胶质瘤组中MVD值为42.12±12.18,显著高于对照组的13.14±3.26,差异具有统计学意义(P<0.05)。
2.3 Snail、SRF、MVD在脑胶质瘤中表达的临床意义 如表2所示,Snail、SRF、MVD在脑胶质瘤中的差异表达,与性别、年龄、肿瘤大小均无关(P>0.05);而与肿瘤级别和1年复发率密切相关,差异均具有统计学意义(P<0.05)。

表1 Snail、SRF在对照组及脑胶质瘤组中的表达
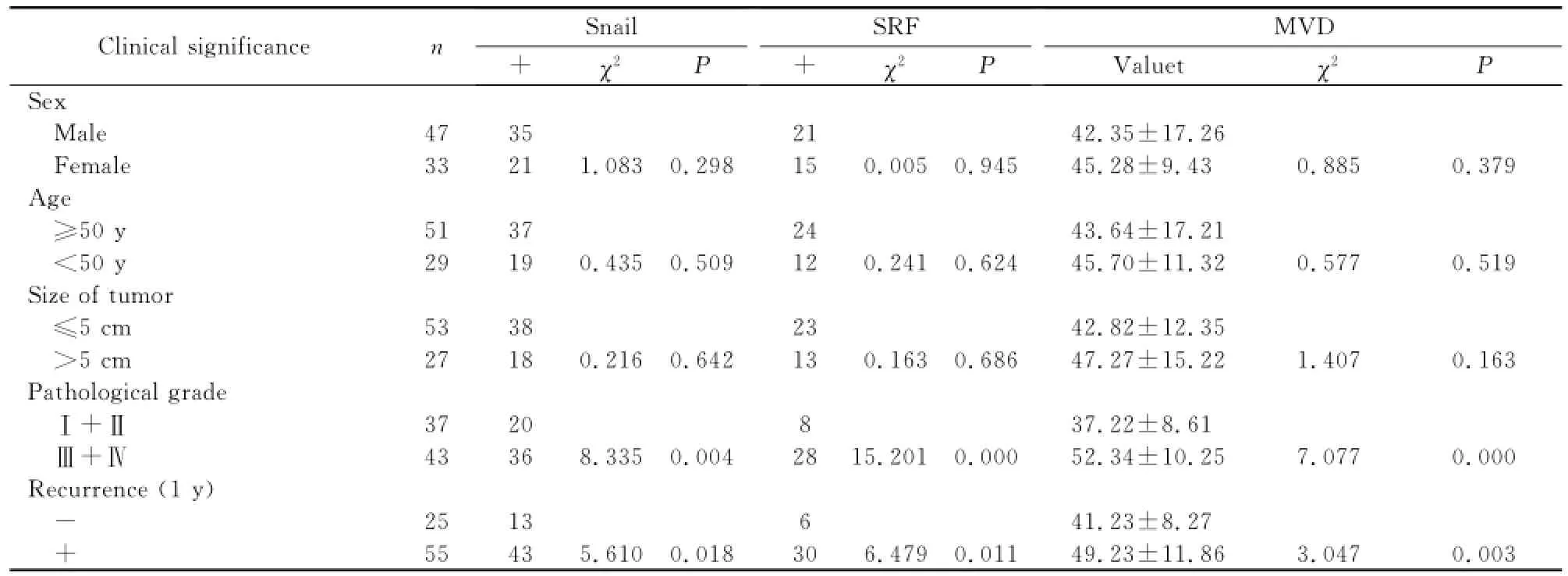
表2 Snail、SRF和MVD在脑胶质瘤组织中表达的临床意义
2.4 Snail、SRF与MVD在脑胶质瘤组织中表达的相关性分析 Snail阳性组MVD值为48.24± 14.73,显著高于阴性组的38.12±7.45,差异具有统计学意义(t=3.187,P=0.002);SRF阳性组MVD值为47.28±10.34,显著高于阴性组的36.38± 9.25,差异具有统计学意义(t=4.972,P=0.000)。
3 讨论
研究表明,脑胶质瘤的复发和放化疗耐性与上皮-间质转化(EMT)关系密切[5]。在脑胶质瘤SHG-44细胞中过表达整连素相关蛋白激酶能够诱导Snail蛋白表达上调,细胞获得更强的迁移和侵袭能力。在本研究中发现Snail在胶质瘤组织中高表达,并与肿瘤级别和复发关系密切,提示Snail在胶质瘤中的高表达多提示预后不良。而转录因子SRF在EMT中发挥重要调控作用,能够调控恶性肿瘤的进行性进展,破坏细胞连接,使肿瘤细胞松散获得迁移可能,并能够促进肿瘤细胞增殖,上调基质金属蛋白酶(MMP)-2、-9的表达,使肿瘤细胞更易浸润和侵袭;SRF的转录能够诱导肿瘤细胞获得间质细胞表型,促进迁移和侵袭的能力提高,提示SRF在肿瘤的发生、发展进程中起到了较为重要的调控作用,其对胶质瘤细胞的迁移亦具有重要的调控作用[6]。
[1]Chang L,Su J,Jia X,et al.Treating malignant glioma in Chinese patients:update on temozolomide[J].Onco Targets Ther,2014,7:235.
[2]Miyazono K,Ehata S,Koinuma D.Tumor-promoting functions of transforming growth factor-βin progression of cancer[J].Ups J Med Sci,2012,117(2):143.
[3]Chiang C,Ayyanathan K.Snail/Gfi-1(SANG)family zinc finger proteins in transcription regulation,chromatin dynamics,cell signaling,development,and disease[J].Cytokine Growth Factor Rev,2013,24(2):123.
[4]Zhao M,Xu H,He X,et al.Expression of serum response factor in gastric carcinoma and its molecular mechanisms involved in the regulation of the invasion and migration of SGC-7901cells[J].Cancer Biother Radiopharm,2013,28(2):146.
[5]Xi H,Hong X,Min Z,et al.Serum response factor is overexpressed in esophageal squamous cell carcinoma and promotes Eca-109cell proliferation and invasion[J].Oncol Let,2012,5(3):819.
[6]Ziv-Av A,Taller D,Attia M,et al.RTVP-1expression is regulated by SRF downstream of protein kinase C and contributes to the effect of SRF on glioma cell migration[J].Cell Signal,2011,23(12):1936.
2013-07-19)
1007-4287(2014)07-1092-02
*通讯作者
