遮荫处理对臭柏幼苗光合特性的影响
2014-05-05黄秋娴李玉灵李晓莹
赵 顺,黄秋娴,李玉灵,李晓莹,李 雯,程 达,尹 坤
(河北农业大学,保定 071000)
臭柏(Juniperus sabina Ant.)是毛乌素沙地植物群落中唯一的天然常绿针叶灌木,盖度达90%以上,常形成纯片灌木林,臭柏能在干旱半干旱的沙质化土地上生长良好,并且也能在营养匮乏的铁尾矿砂中正常生长,常作为荒漠化土地造林和矿山废弃地生态恢复与重建的关键树种之一,受到众多学者的关注,并针对其自然分布、生长发育、生理特性、种群结构、群落动态、防风固沙、栽培抚育、开发利用等方面进行了深入的研究[1-9]。然而,天然臭柏种群正面临着退化与破坏,其现存面积在不断的减少,因此臭柏群落的保护迫在眉睫。通过种子繁殖实现臭柏有性更新是保护天然臭柏种群的根本途径。臭柏实生苗萌发于乌柳(Salix cheilophila Schneid)等植物下,因此在其幼龄时处于遮阴状态,光强较弱,随其生长,臭柏逐渐摆脱乌柳的荫蔽直至完全暴露于强光之下,形成纯片灌木林。在此过程中,臭柏幼苗经历了由遮阴到强光的光照及其温度、土壤水分条件变化,据王林和[10]等研究,在毛乌素沙地臭柏天然更新只发生在水分条件较好的乌柳灌丛下,虽能形成独立的灌丛,但由于水分环境的变化,更新区面积不断缩小。那么,臭柏幼苗是因为光照还是因为水分条件选择在乌柳灌丛下萌生?有关水分胁迫条件下臭柏苗期、成熟期的光合、水分生理生态响应研究已取得大量研究成果[5,7-8],而不同光照条件下臭柏幼苗的生理生态响应研究未见报道。为了分析光照对臭柏幼苗的影响,本研究通过臭柏实生苗充足水分供应和不同遮荫处理,对其幼苗的光合生理特性、叶绿素含量、光照因子进行比较分析,旨在揭示臭柏幼苗在天然更新过程中对光照环境变化的适应特性。通过水分利用效率的分析,间接分析臭柏幼苗光合与水分生理的关系。为天然臭柏种质资源的保护及其臭柏在荒漠化土地和矿山废弃地等退化土地人工造林技术提供理论依据。
1 材料和方法
1.1 实验材料
试验于2012年4月份在河北农业大学植物园进行。实验材料选取毛乌素沙地乌审旗苗圃生长良好、大小一致的同源同质的30株2年生臭柏幼苗,选择规格大小(180mm×190mm)一致的塑料花盆25个,鉴于毛乌素沙地和铁尾矿沙基质粒径组成相似,同时为了试验臭柏实生苗在尾矿沙基质下生长适应性,本文以唐山迁安马兰庄镇的铁尾矿作为基质,将盆栽幼苗置于自然条件下生长1个月,期间只进行定期的浇水管理。由于自然状态下臭柏实生苗萌发于乌柳灌丛下,依据乌柳灌丛枝叶繁茂程度及其实生苗萌发位置不同,其实际遮荫率个体间差异不同。为了模拟自然状态下多变的遮荫环境,同时为了考察臭柏幼苗对不同光照条件的响应,本文将30株盆栽臭柏幼苗分成5组,依次置于0%(自然光)、25%、50%、75%和90%的遮荫率条件下培养,购买遮荫率依次为25%、50%、75%和90%的4种耐老化的塑料丝编织而成的黑色遮阳网进行遮荫处理。遮荫处理2个月之后,测定臭柏幼苗的光合指标。
1.2 研究方法
1.2.1 光合特性的测定
选择晴朗无云稳定天气,利用LI-6400便携式光合仪测定不同遮光处理的臭柏幼苗的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2浓度(Ci)、气孔限制值(Ls,Ls=1-Ci/Ca,Ca为空气 CO2浓度),计算水分利用效率(WUE,WUE=Pn/Tr[11])等日变化,选择7:00—18:00,每小时测定1次,每个处理选定4盆进行测定,每盆测定3次。
1.2.2 叶绿素含量测定
色素提取和测定:在测定光合特性时,分别在8:00、12:00和5:00用剪刀快速剪取叶片,用锡箔纸包住放在液氮里保存,带回到实验室进行色素提取;取鲜重0.25g的叶片,用液氮研磨成粉,用2.5mL 100%丙酮提取;再在4℃,12000r/min下离心10min,提取上清液到10mL棕色容量瓶中,定容;再用0.22μm有机相微孔滤膜过滤,用2mL离心管分装,于-80℃保存;再用HPLC法[12]进行色素测定。
1.2.3 数据分析
所有数据统计分析均在Excel 2003和SPSS 13.0软件上完成,运用单因子方差分析法分析,多重比较用Duncan新复极差法。
3 结果与分析
3.1 不同遮荫处理对臭柏光合特性的影响
3.1.1 臭柏净光合速率(Pn)日变化
图1和图2分别是不同遮荫处理净光合速率(Pn)和对应各时段光照强度(PAR)日变化。从图中可以看出,随遮荫率的增加,净光合速率(Pn)减小,所有处理组的Pn日变化和PAR日变化变化趋势相同,Pn和PAR的大小顺序都为:0%﹥25%﹥50%﹥75%﹥90%。90%遮荫处理由于光照强度不足,从10:00以后光合速率下降为负值,光合速率受到抑制。其他处理都在中午时段有“午休”现象,但是当光照达到全光照条件时,虽然有“午休”迹象,但仍然处于所有遮荫处理中的最大值。可见光照越强,臭柏幼苗净光合速率越大,说明在一定程度上臭柏也是喜光树种。计算 Pn的日平均值依次为:7.071μmolCO2m-2s-1(0%)、4.080μmolCO2m-2s-1(25%)、 2. 144μmolCO2m-2s-1(50%)、 1.300μmolCO2m-2s-1(75%)和 - 0.651μmolCO2m-2s-1(90%)。各处理都出现显著差异或极显著差异(表1)。
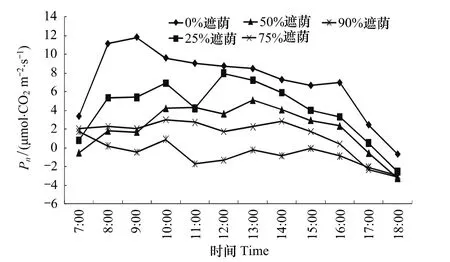
图1 不同遮荫处理臭柏净光合速率(Pn)的日变化Fig.1 Diurnal changes of net photosynthetic rate of Juniperus sabina under different shading treatments

图2 光照强度(PAR)日变化Fig.2 Diurnal changes of PAR under shading treatments
3.1.2 臭柏气孔导度(Gs)和蒸腾速率(Tr)日变化
气孔是植物与外界进行气体交换的重要通道,气孔导度(Gs)的变化直接影响植物的光合作用和蒸腾作用。从图3可以明显地看出,气孔导度和净光合速率一样,随遮荫率的增加而减小。各处理组Gs日变化几乎呈现相同变化趋势,在7:00之后Gs值变化不大,在0.032—0.366mol H2O m-2s-1之间,但都在12:00出现谷值,说明臭柏幼苗不管遮荫与否在12:00都会出现不同程度大小的关闭气孔的现象,这或许也是光合速率出现午休的原因之一。气孔关闭势必会影响臭柏的蒸腾速率(Tr),从图3、图4可以看出,各处理组Gs日变化波动与Tr的变化波动是一致的,虽然各处理从8:00开始Gs值变化不是很大,但是Gs轻微的变化也会引起Tr的剧烈波动,所有处理臭柏的Tr在12:00都出现不同程度的谷值,特别是全光照处理下,Tr在12:00下降最大。说明气孔导度直接影响蒸腾速率,臭柏幼苗对水分散失更为敏感。由于Gs可以直接影响Tr,所以Gs与Tr大小顺序均为:0%﹥25%﹥50%﹥75%﹥90%,Gs日平均依次为:0.346 mol H2O m-2s-1,0.258 mol H2O m-2s-1,0.203 mol H2O m-2s-1,0.172 mol H2O m-2s-1和 0.096 mol H2O m-2s-1,其中0% 与75% 、90% 之间存在极显著差异(P﹤0.01),25%与90%存在显著差异(P﹤ 0.05);Tr日平均依次为:5.243 mmol H2O m-2s-1,4.876 mmol H2O m-2s-1,4.229 mmol H2O m-2s-1,3.736 mmol H2O m-2s-1和 2.328 mmol H2O m-2s-1,0% 与 75%、90% 之间,90% 与 75%、50%、25%之间差异都极显著(P﹤0.01),25%与75%差异显著(P﹤0.05)(表1)。

表1 不同遮荫处理光合参数日平均值Table 1 Daily mean of photosynthetic parameters of Juniperus sabina under different treatments

图3 不同遮荫处理臭柏气孔导度(Gs)的日变化Fig.3 Diurnal changes of stomatal conductance of Juniperus sabina under different shading treatments

图4 不同遮荫处理臭柏蒸腾速率(Tr)的日变化Fig.4 Diurnal changes of transpiration rate of Juniperus sabina under different shading treatments
3.1.3 臭柏胞间CO2浓度(Ci)和气孔限制值(Ls)日变化
胞间CO2浓度(Ci),影响植物光合作用提供直接合成碳源的多少,Ci下降,说明植物的光合速率大于呼吸速率,植物在同化利用CO2,反之,Ci上升,呼吸速率大于光合速率。胞间CO2浓度(Ci)日变化如图5所示,结合Pn日变化(图1)可以看出,各处理组Ci的变化趋势与Pn的变化趋势是相反的,随着光照增强,Ci呈现减小趋势,大致为:90%﹥75%﹥50%﹥25%﹥0%。其中0%与90%差异极显著(P﹤0.01),25%与90%存在显著差异(P﹤0.05)(表1)。
通常植物光合作用的限制可分为气孔限制和非气孔限制,前者是由于气孔导度(Gs)下降导致CO2进入叶片受阻,后者是因光合机构和功能受到损害而导致光合速率下降[13]。为此本文以气孔限制值(Ls)分析光合作用的限制因素。Farquhar和许大全[13-14]等认为,当 Pn和 Gs下降时,若 Ls增大和 Ci降低,才可认为光合速率下降主要是由气孔导度引起的,即气孔限制,若Ls减小和Ci增大或不变,则为非气孔限制,光合速率下降应归因于叶肉细胞羧化能力的降低。从图1、图3、图5、图6可以得出,全光照处理下臭柏Pn在10:00—12:00下降为气孔限制;25%遮荫处理下15:00—16:00的Pn下降为气孔限制;50%处理Pn下降为气孔限制的时间段为:8:00—9:00和11:00—12:00;75%处理 Pn下降在8:00—9:00为气孔限制因素;除上述处理组时间段之外,其余各处理组时间段Pn下降均是非气孔限制;90%处理Pn下降完全是由非气孔限制因素引起的,可见,随遮荫率的增加,气孔制限减少,所以总体趋势是随着遮荫率增大,Ls减小。

图5 不同遮荫处理臭柏胞间CO2浓度(Ci)的日变化Fig.5 Diurnal changes of stomatal CO2concentration of Juniperus sabina under different shading treatments

图6 不同遮荫处理臭柏气孔限制值(Ls)的日变化Fig.6 Diurnal changes of stomatal limting value of Juniperus sabina under different shading treatments
3.1.4 臭柏水分利用效率(WUE)日变化
从图7可知,各处理臭柏水分利用效率随遮荫率增加而减小。其中全光照和25%遮荫处理日变化趋势相似,都在12:00出现最大峰值,50%和75%处理日变化趋势较平缓,而90%遮荫处理的WUE基本都是负值。各处理 WUE日均值依次为:1.413μmolCO2/mmol H2O(0%),0.788μmolCO2/mol H2O(25%),0.429μmolCO2/mol H2O(50%),0.299 μmolCO2/mmol H2O(75%)和-0.366μmolCO2/mol H2O(90%),其中0%与50%、75%、90%之间,25%与90%之间存在极显著差异(P﹤0.01),90%与50%、75%之间差异显著(P﹤0.05)(表1)。

图7 不同遮荫处理臭柏水分利用效率(WUE)的日变化Fig.7 Diurnal changes of water use efficiency of Juniperus sabina under different treatments
3.2 不同遮荫处理对臭柏叶绿素含量的影响
虽然捕光天线复合体(LHC)是由叶绿素a(Chl a)和叶绿素b(Chl b)组成的,但Chl b是构成LHC的重要组成部分,它不仅具有吸收和传递光能的作用,而且在调控光合机构天线的大小,维持LHCII的稳定性及对各种环境的适应等过程都起作用[15]。从表2中得知,全光照条件下,臭柏Chl a、Chl b和Chl总量均在12:00最小,而其余遮荫组在12:00最大;由表3可见:随遮荫率增加,Chl a、Chl b和Chl总量基本呈现增加趋势。这和多数学者的研究结果是一致的[16-17]。而Chl a/b则随着遮荫率的增大呈下降趋势,各处理组之间均没有显著性差异。全光照条件下,叶绿素含量最小,有可能是因为光照强度太高导致了叶绿素分解。遮荫可以有效地提高臭柏幼苗叶绿素的含量,当植物生长在弱光下,Chl b的合成加快,天线大小也随之增大[18]。遮荫率变高,Chl a/b比值会减小,说明遮荫环境中臭柏幼苗的Chl b合成幅度大于Chl a的合成幅度,有利于光能的捕捉,有利于对短波蓝紫光的吸收[19]。
3.3 臭柏光合参数之间的相关分析
气孔是植物光合和蒸腾的主要通道,植物气孔导度与光合速率和蒸腾速率的相关性从来都是有关学者关注的焦点[20-22]。本文为了进一步明确臭柏实生苗叶片气孔对光和水分的敏感性,分析了Gs、Pn、Tr三者的相关性。从表4中得知,除了75%的遮荫处理,所有遮荫组Gs均与Tr表现出不同程度的相关性,而Gs与Pn的相关性较差,只有75%遮荫处理有相关性。说明臭柏气孔导度受蒸腾速率影响更大,或者说臭柏实生苗气孔开闭是以控制水分散失为核心的。水分利用效率(WUE)是由净光合速率(Pn)与蒸腾速率(Tr)比值得出,表4中,各处理组Pn与WUE均呈极显著相关(P﹤0.01),而与蒸腾速率相关性不显著。说明臭柏幼苗是通过较高的光合速率而非较低的水分蒸腾散失提高水分利用效率。WUE和Ci也表现出不同程度的相关性,较低的遮荫处理相关性高,这可能和臭柏幼苗实现较高光合速率有关。

表2 不同遮荫处理下在3个时间点各叶绿素含量及比值Table 2 Chlorophyll content and proportion of Juniperus sabina in three times points under shading treatments

表3 不同遮荫处理下各叶绿素含量及比值Table 3 Chlorophyll content and proportion of Juniperus sabina under different shading treatments

表4 不同遮荫处理臭柏光合参数之间的相关分析Table 4 Correlation analysis on photosynthetic parameters of Juniperus sabina under different shading treatments

续表
4 结论与讨论
光是植物必需的资源之一,对植物的生长发育、生理生化和形态结构等方面有重要的作用。光照强度是影响植物光合作用的主导生态因子。而在自然环境中,光环境随着时间和空间发生变化。如光照强度的改变,将对植物产生深刻的影响。遮荫处理能改变光强、温度和湿度等,进而影响植物的光合特性参数。本文结果表明臭柏幼苗随着遮荫率的增加,净光合速率(Pn)气孔导度(Gs)及蒸腾速率(Tr)随之减小,而胞间CO2浓度(Ci)随之增大,且90%最大遮荫会影响臭柏幼苗的正常生长,也就是说随光照增强臭柏幼苗净光合速率提高,虽然处于幼苗期,但并未受到光强抑制。说明臭柏是喜光树种。虽然全光照条件下净光合速率在中午时段也出现了一定的“午休”迹象,但由于全光照条件下净光合速率在10:00—12:00为气孔制限,可见其午休是由于气孔关闭造成的。本文分析已表明,气孔导度和蒸腾速率关系更为密切。所以导致光合午休的出现是臭柏幼苗对水分散失的响应,而不是因为光强作出的午休响应。光合速率、蒸腾速率、气孔导度相关性分析表明,蒸腾失水是控制气孔导度的主要因素,李玉灵、严昌荣[8,23]等研究表明,臭柏具有比多数沙生灌木很小的蒸腾速率,高的水分利用效率是其在干旱生境中生长的途径。成熟林臭柏为了维持较高的地上生物量不得不保持较高的光合速率,而在干旱生境条件下如果只是通过气孔开张实现较高的光合速率,就必须以散失大量水分为代价,这显然不是臭柏在干旱生境下所选择的生存机制。臭柏在其长期进化、适应环境过程中必定形成了较高光合速率和较低蒸腾速率的内在适应机制。在幼苗期,臭柏似乎并非能够像成熟林臭柏那样游刃有余的适应干旱环境。王哲[24]等认为天然条件下臭柏幼苗生长微生境第1因子是温度条件,第2因子为水分条件,而光照并非限制其生长的主要环境因子。本文WUE与Pn和Tr相关性分析结果表明,臭柏幼苗并不是通过降低蒸腾速率实现其较高的水分利用效率的,而是通过较高的的光合速率实现较高的水分利用效率的。而臭柏的光合速率在多数时段是非气孔制限(图6),低光照条件下,气孔限制减小,Ci是影响植物光合速率非气孔制限的主要因子,不同遮荫处理的Pn以及WUE均和Ci有较高的相关性(表4),结合Ls值分析结果都表明,臭柏实生苗具有气孔开闭机制以外的保持较高光合速率的内在机制。也就是说,臭柏的光合速率更多的是受其内部光合因素所控制,并非气孔制限,所以气孔开张虽然有利于臭柏光合速率的提高,但是臭柏还是通过内部光合机制提高光合速率,这就减小了水分胁迫对臭柏光合效率的威胁。对于喜光植物来说,荫蔽一般会影响其生长发育。叶是植物重要的光合器官,对光照的变化也比较敏感[25]。遮荫环境下的植物通过增加单位面积色素密度来利于吸收更多的光能[26]。叶绿素测定结果表明,遮荫处理下,臭柏幼苗Chl a、Chl b和Chl a+b含量均随着遮荫率增加而呈上升趋势,Chl a/b比值随着遮荫率增加呈减小趋势,说明遮荫处理会提高臭柏的Chl含量,尤其是Chl b含量,以便臭柏能在低光照环境下捕获更多的光能,增强对弱光的利用率,以适应弱光生境生长。如表2所示,全光照条件下臭柏幼苗在12:00所接收的光照辐射强度最大,而其Chl含量最小,而其它遮荫组臭柏在光照强度最大时,Chl含量最高。红雨[27]等对天然臭柏群落在不同演替阶段的叶绿素含量变化进行了研究,结果表明由于在演替过程中,臭柏群落的郁闭度会改变,臭柏群落内的光照强度也随之改变。所以演替进行中,臭柏的Chl a、Chl b和Chl a+b含量均呈现先上升后下降的趋势。但Chl a/b却随着光量子密度的降低而减小,这是植物对弱光环境的生理适应[28]。说明臭柏从实生苗到成熟林都具备通过改变叶绿素含量应对不同光照条件的内在机制。在弱光对植物体内有机物质的积累和分配的影响方面,植物遮荫下倾向于将同化产物碳和氮分配到捕光系统的组分中,即将生物量的分配优先分配到吸收器官叶中[29]。低的光照条件下叶绿素含量上升,一方面是由于弱光减少了色素的光氧化伤害,另一方面是由于叶绿体内的基粒变大,基粒片层垛叠程度变高[30]。且在低光照条件下臭柏具有较高的Ci,胞间CO2可作为植物光合作用的直接碳源,以便臭柏幼苗在低光照条件下进行光合生产维持正常生理生长需要,这也是90%遮荫处理能够维持生存的光合生理适应机制之一。以上分析综合表明,臭柏实生苗通过其叶绿素含量的变化,光合速率的内在机制调控具有适应不同光照的能力。由此可以判断,臭柏幼苗在乌柳下萌发并非完全是为了避光,可能更多的原因是为了乌柳灌丛下暖湿的环境,例如温度、水分条件等。所以,像乌柳这样的"保姆"植物在天然臭柏种质资源保护方面有其特殊意义。荒漠化土地和矿山废弃地等退化土地臭柏人工造林能否成功,土壤水分条件可能比光照更为关键,对此还需进行深入研究。
[1] Zhang G S,Li Y L,Wang L H,Dong Z,Qi Q J.The preliminary study on Sabina vulgaris afforested in the semiarid region.Journal of Neimengg Forestry College,1999,1:21-25.
[2] Li C Y,Wang L H,Ci Z L.Induction of callus of Sabina vulgaris.Journal of Inner Mongola Institute of Agriculture and Animal Husbandry,2000,21(2):58-62.
[3] Zhang G S,Gao R H,Wang L H,Liu M Z,Ji R G L.Study on community structure and biodiversity ofSabina vulgarisof Maowushu.Journal of Inner Mongola Institute of Agriculture and Animal Husbandry,2001,22(4):88-91.
[4] Wen G S.Dynamics of Sabina vulgaris phytocoenosis landscape in Maowushu sandland.Journal of Zhejiang Forestry College,2005,22(2):129-132.
[5] Wen G S,Zhang G S,Yoshikawa K.Effect of drought stress on water characteristics of Sabina vulgaris.Scientia Silvae Sinicae,2004,40(5):84-87.
[6] Wen G S,Yoshikawa K,Zhang G S,Zhang M R,Yu S Q.Growth of Sabina vulgaris Ant.under drought stress.Journal of Inner Mongola Institute of Agriculture and Animal Husbandry,2004,25(1):5-10.
[7] Li Y L,Wang Y K,Wang J G,Miki,Sakamoto K,Yoshikawa K.Transpiration and water uptake of Sabina vulgaris stolon under water stress.Scientia Silvae Sinicae,2009,45(9):48-52.
[8] Li Y L,Zhu F,Wang J G,Miki,Sakamoto K,Yoshikawa K.Seasonal changes of photosynthetic characteristics and pigment composition of Sabia vulgaris Ant under water stress.Acta Ecologica Sinica,2009,29(8):4346-4352.
[9] Zhang H J,Wu B.Influences of biological soil crusts on physicochemical propertices of soil in Artemisia ordosica and Sabina vulgariscommunities.JournalofNortheastForestry University,2012,40(3):58-61.
[10] Wang L H,Zhang G S,Dong Z.A preliminary study on the seed yield and regenera tion of Sabina vulgaris in Maowusu sand.Scientia Silvae Sinicae,1998,34(6):105-112.
[11] Bierhuizen J F,Slatyer R O.Effect of atmospheric concentration of water vapor and CO2in determing transpiration of cotton leaves.Agric.Meteorol.,1965,2:259-270.
[12] Wei C L,Jiang C J,Tao H Z,Hu Y H.Analysis of the xanthophyll cycle component in fresh leaves oh tea plant by high performanceliquid chromatographyand itsphoto-protection.Journal of Tea Science,2004,24(1):60-64.
[13] Farquhar G D, SharkeyT D. Stomatalconductanceand photosynthesis.Annual Review of Plant Physiology,1982,33:317-345.
[14] Xu D Q.Photosynthesis Efficiency.Shanghai:Shanghai Science and Technology Publishing House,2002,39-96.
[15] Yamasato A,Nagata N,Tanaka R.The Nterminal domain of chlorophyllide a oxygenase confers protein instability in response to chlorophyll B accumulation in Arabidopsis.Plant Cell,2005,17(5):1585-1597.
[16] Zhang Z S,Zhang Q F,Xia L,Zheng S J.Effects of shades on photosynthetic characteristics and growth of several species of afforestation plants. Journal of Northeast Foresty University,2010,38(3):47-49.
[17] Ye Z P,Zhao Z H.Effects of shading on the photosynthesis and chlorophyll content of Bidens pilosa.Chinese Journal of Ecology,2009,28(1):19-22.
[18] Bailey S,Walter RG,Jansson S,Horton P.Acclimation of Arabidopsis thaliana to the light environment:the existence of separate low light and high light responses.Planta,2001,213(5):794-801.
[19] Boardman N K.Comparative photosynthesis of sun and shade plants.Annual Review of Plant Physiology,1977,28:355-377.
[20] Huang J,Xia H P,Cai X A.Effects of shading on growth and photosynthesis of three species of the genus Stenotaphrum.Chinese Journal of Ecology,2006,25(7):759-764.
[21] Xu J J,Zhang J J,Wang Q Y,Li H M,Ru H,Guo B N,Huang M.Photosynthesis and transpiration characteristics ofPinus tabulaeformis and Platycladus orientalis and their relationship with environmental factors.Journal of Northeast Forestry University,2011,39(7):15-18.
[22] Cen J Y,Yang Y Q,Sun Q Z.Effect of different light trestment on photosynthetic diurnal changes of Sarcococca ruscifolia stapf.Chinese Agricultural Science Bulletin,2010,26(21):243-249.
[23] Yang G C,Hang G X,Chen L Z.Water use efficiency of six woody speciesin relation to micro-environmentalfactorsof different habitats. Acta Ecologica Sinica,2001,21(11):1952-1956.
[24] Wang Z,Zhang G S,Wang L H,Hao Y L,Wang M.Microhabitat characteristics of natural regeneration of Sabina vulgaris community in Mu Us Sandland.Joural of Arid Land Resources and Environment,2007,21(4):156-163.
[25] Yang M,Mao K,Ma J X.Study of morphological change and energy distribution of Centipede Grass under shade condition.Grassland of China,2004,26(2):44-48.
[26] Wittmann C,Aschan G.Leaf and twig photosynthesis of young beech(Fagus sylvatica)and aspen trees(Populus tremula)grown under different light regime.Basic and Applied Ecology,2001,2(2):145-154.
[27] Hong Y,Wang L H.Study on the change of leaf water content and chlorophyll content of Sabina vulgaris community at different successional stages.Journal of Inner Mogolia Normal University,2008,37(1):94-96.
[28] Chi W,Wang R F,Zhang C L.Changes of photosynthetic characteristics of strawberry lesf under shading.Chinese Journal of Applied Ecology,2001,12(4):566-568.
[29] Wang B L,Xu M,Qian Q Q,Shi Q H,Cao J S.Effect of shadingon curd growth and antioxidantsystem in early cauliflower. Journal of Zhejiang University,2005,31(5):535-540.
[30] Atanasova L,Stefanov D,Yordanov I,Kornova K,Kavardzikov L.Comparative characteristics of growth and photosynthesis of sun and shade leaves from normal and pendulum walnut(Juglans regia L.)trees.Photosynthetica,2003,41:289-292.
参考文献:
[1] 张国盛,李玉灵,王林和,董智,齐秋锦.半干旱地区臭柏造林初步研究.内蒙古林学院学报,1999,1:21-25.
[2] 李春艳,王林和,慈忠玲.臭柏愈伤组织的诱导.内蒙古农业大学学报,2000,21(2):58-62.
[3] 张国盛,高润宏,王林和,刘美珍,吉日格勒.毛乌素沙地臭柏群落结构和生物多样性组成研究.内蒙古农业大学学报,2001,22(4):88-91.
[4] 温国胜.毛乌素沙地臭柏群落景观动态.浙江林学院学报,2005,22(2):129-132.
[5] 温国胜,张国盛,吉川贤.干旱胁迫对臭柏水分特性的影响.林业科学,2004,40(5):84-87.
[6] 温国胜,吉川贤,张国盛,张明如,余树全.干旱胁迫条件下臭柏的生长.内蒙古农业大学学报,2004,25(1):5-10.
[7] 李玉灵,王玉魁,王俊刚,三木直子,坂本圭児,吉川賢.水分胁迫条件下臭柏匍匐茎的蒸腾和吸水特性.林业科学,2009,45(9):48-52.
[8] 李玉灵,朱帆,王俊刚,三木直子,坂本圭児,吉川賢.水分胁迫下臭柏(Sabina vulgarist Ant.)光合特性和色素组成的季节变化.生态学报,2009,29(8):4346-4352.
[9] 张军红,吴波.油蒿与臭柏沙地生物结皮对土壤理化性质的影响.东北林业大学学报,2012,40(3):58-61.
[10] 王林和,张国盛,董智.毛乌素沙地臭柏种子产量及更新的初步研究.林业科学,1998,34(6):105-112.
[12] 韦朝领,江昌俊,陶汉之,胡颖蕙.茶树鲜叶中叶黄素循环组分的高效液相色谱法测定研究及其光保护功能鉴定.茶叶科学,2004,24(1):60-64.
[14] 许大全.光合作用效率.上海:上海科学技术出版社,2002,39-96.
[16] 张智顺,张庆费,夏檑,郑思俊.遮阴对几种绿化植物光合特性和生长的影响.东北林业大学学报,2010,38(3):47-49.
[17] 叶子飘,赵则海.遮光对三叶鬼针草光合作用和叶绿素含量的影响.生态学杂志,2009,28(1):19-22.
[20] 黄娟,夏汉平,蔡锡安.遮光处理对三种钝叶草的生长习性与光合特性的影响.生态学杂志,2006,25(7):759-764.
[21] 徐佳佳,张建军,王清玉,李慧敏,茹豪,郭宝妮,黄明.油松和侧柏的光合蒸腾特性及其与环境因子的关系.东北林业大学学报,2011,39(7):15-18.
[22] 陈菊艳,杨远庆,孙泉忠.不同光照处理对野扇花光合日变化的影响.中国农学通报,2010,26(21):243-249.
[23] 严昌荣,韩兴国,陈灵芝.六种木本植物水分利用效率和其小生境关系研究.生态学报,2001,21(11):1952-1956.
[24] 王哲,张国盛,王林和,郝云龙,王敏.毛乌素沙地天然臭柏群落有性更新的微生境特征.干旱区资源与环境,2007,21(4):156-163.
[25] 杨渺,毛凯,马金星.遮阴生境下假俭草的形态变化与能量分配研究.中国草地,2004,26(2):44-48.
[27] 红雨,王林和.臭柏群落在不同演替阶段叶片含水量、叶绿素含量变化的研究.内蒙古师范大学学报,2008,37(1):94-96.
[28] 迟伟,王荣富,张成林.遮荫条件下草莓的光合特性变化.应用生态学报,2001,12(4):566-568.
[29] 汪炳良,徐敏,钱琼秋,史庆华,曹家树.遮荫处理对早熟花椰菜花球的生长和抗氧化系统的影响.浙江大学学报,2005,31(5):535-540.
