辛伐他汀对大鼠成骨细胞经典Wnt信 号通路相关因子表达的影响
2014-05-05傅坤发陆冰刘晔胡健孔繁荣
傅坤发,陆冰,刘晔,胡健,孔繁荣
(江苏省老年医院老年科,江苏南京 210024)
·论著·
辛伐他汀对大鼠成骨细胞经典Wnt信 号通路相关因子表达的影响
傅坤发,陆冰,刘晔,胡健,孔繁荣
(江苏省老年医院老年科,江苏南京 210024)
目的观察不同浓度、不同时间辛伐他汀对体外培养的大鼠成骨细胞经典Wnt通路Wnt3a、LRP5和β-catenin的mRNA表达的影响,探讨辛伐他汀抗骨质疏松的可能机制。方法用酶消化法培养大鼠颅骨成骨细胞,采用倒置相差显微镜及碱性磷酸酶染色和茜素红染色观察和鉴定成骨细胞。用浓度分别为10-8mol/L、10-7mol/L、10-6mol/L和10-5mol/L的辛伐他汀干预大鼠成骨细胞24 h、48 h和72 h,并设无辛伐他汀为对照组,采用RT-PCR检测经典Wnt信号通路Wnt3a、LRP5和β-catenin的mRNA表达情况。结果镜下观察及染色结果均显示具有成骨细胞典型特征。RT-PCR结果显示:10-5mol/L辛伐他汀组干预24 h后较对照组Wnt3a[(2.09±0.12)vs (1.82±0.09)]、LRP5[(1.42±0.07)vs(1.29±0.07)]和β-catenin[(1.10±0.06)vs(0.95±0.06)]的mRNA表达显著增加;干预48 h和72 h后各组Wnt3a(F=37.78和96.52,P=0.000)、LRP5(F=10.32,P=0.001和F=22.02,P=0.000)的mRNA表达随着辛伐他汀浓度的增大而显著增加,β-catenin的mRNA表达较对照组显著增加(F=6.67和21.90,P<0.05);10-8~10-5mol/L辛伐他汀各组中分别干预24 h、48 h和72 h,随着干预时间延长Wnt3a和LRP5的mRNA表达均增加;干预48 h与24 h比较,β-catenin的mRNA表达差异无统计学意义[(1.08±0.09)vs(1.02±0.06),P>0.05],而干预72 h较24 h显著增加[(1.23±0.10)vs(1.02±0.06),P<0.05],且辛伐他汀浓度为10-6mol/L和10-5mol/L干预72 h较48 h显著增加[(1.32±0.07)vs(1.11±0.05)和(1.47±0.08)vs(1.19±0.04),P<0.05]。结论辛伐他汀可促进体外培养大鼠成骨细胞经典Wnt信号通路Wnt3a、LRP5和β-catenin的mRNA表达。
辛伐他汀;成骨细胞;经典Wnt信号通路;骨质疏松
骨质疏松症(Osteoporosis,OP)已经成为严重威胁老年人健康的一种疾病,迄今为止OP的发病机制尚未完全阐明。近年来发现经典Wnt信号通路在成骨细胞的发育及分化过程中扮演重要角色,已成为骨质疏松领域的研究热点。目前治疗OP的药物大部分集中在靶向破骨细胞,以抑制骨吸收为主,促进成骨有限。研究表明他汀类药物可通过多种途径刺激体外培养的成骨细胞增殖和分化,促进骨合成代谢作用,但其机制仍在研究中。本研究通过观察不同浓度辛伐他汀对体外培养大鼠颅骨成骨细胞经典Wnt信号通路的主要因子Wnt3a、LRP5和β-catenin的mRNA表达的影响,探讨他汀类药物影响骨代谢的可能机制。
1 材料与方法
1.1 实验动物及主要试剂 出生24 h内的SD大鼠6只,购自东南大学实验动物中心,辛伐他汀(Simvastatin,SIM,杭州默沙东公司),低糖DMEM培养基(Gibco公司),胎牛血清(杭州四季青生物公司),0.25%胰酶(加EDTA)(Sigma公司),Ⅱ型胶原酶(Gibco公司),Trizol RNA提取试剂盒(Gibco公司),PCR试剂盒(大连宝生物),碱性磷酸酶染色试剂盒(南京建成生物工程研究所),其他试剂均为国产分析纯。
1.2 成骨细胞的分离与培养 将新生24 h内的SD大鼠放入75%酒精中浸泡消毒10 min,无菌操作取出颅盖骨,置于4℃磷酸盐缓冲液(PBS)的培养皿中,清除骨膜、血管及结缔组织,并用PBS液洗涤。将洗净的颅盖骨剪成1 mm×1 mm大小的骨片,用0.25%胰酶37℃消化20 min,1 000 r/min离心5 min,弃上清液,再加入0.1%Ⅱ型胶原酶37℃消化1 h,1 000 r/min离心5 min,弃上清液,加入5 ml含10%新生小牛血清的DMEN培养液,吹打均匀,接种于培养瓶中,培养瓶置于37℃、5%CO2的细胞培养箱中培养,24 h后观察细胞并换液,以后每3 d换液1次,细胞融合后,用0.25%胰蛋白酶消化,以1:1的方式将细胞传代,接种于另一培养瓶继续培养,取第3代细胞进行实验。
1.3 成骨细胞的鉴定 采用倒置相差显微镜(Olympus公司)观察培养细胞的一般形态及生长情况;采用Gomori钙钴法行碱性磷酸酶染色,严格按试剂盒说明书操作;细胞培养3周,采用茜素红染色观察矿化结节。
1.4 不同浓度辛伐他汀干预成骨细胞 细胞以2×104个/cm2密度加入25 cm2培养瓶中,24 h后换含浓度分别为10-8mol/L、10-7mol/L、10-6mol/L和10-5mol/L的辛伐他汀培养基,并设不含辛伐他汀的培养基为对照组,分别于24 h、48 h和72 h后采用Trizol法分别提取总RNA。
1.5 经典Wnt信号通路相关因子mRNA检测 培养结束后采用Trizol一步法提取各组细胞总RNA,按试剂盒说明操作。总RNA经电泳显示28S、18S和5S三个条带,RNA的完整性通过28S:18S判断,于紫外分光光度计下读取OD260/OD280的比值作为RNA的纯度。定量后取2 μg,M-MLV逆转录试剂盒进行逆转录,参照说明书进行操作。取逆转录产物1 μl为模板进行PCR扩增,反应体系20 μl。根据目的基因在Gene Bank中的已知序列,设计引物(上海捷倍思基因技术有限公司)。经典Wnt信号通路相关基因Wnt3a:上游引物5'-CATCGCCAGTCACATGCACC-3',下游引物5'-CGTCTATGCCATGCGAGCTCA-3';LRP5:上游引物5'-GACATTTACTGGCCCAATGG-3',下游引物5'-CTGCCCTCCACCACCTTCT-3';β-catenin:上游引物5'-GATTTGATGGAGTTGGACATGG-3',下游引物5'-TGTTCTTGAGTGAAGGACTGAG-3';内参照β-actin:上游引物5'-GGCATCGTGATGGACTCCG-3',下游引物5'-CGTGGAAGGTGGACAGCGA-3'。反应条件:95℃预变性5 min,94℃变性30 s,54℃退火30 s,共35个循环。最后一个循环72℃延伸8 min。扩增产物经1.5%琼脂糖凝胶电泳,用ImageMaster VDS图像分析仪进行扫描,用Total Lab图像分析软件分析所得图谱。
1.6 统计学方法 所有实验结果均重复3次,数据以均数±标准差()表示。采用SPSS15.0软件进行统计学处理,各组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠颅骨成骨细胞的鉴定结果 倒置相差显微镜下见培养的大鼠颅骨细胞有典型的成骨细胞特征,细胞贴壁生长,形状多为三角形、多边形、长梭形,以单核为主,有较多突起(见图1A);经Gomori钙钴法染色后见胞质中呈现灰黑色颗粒或块状沉淀(见图1B);钙化结节染色后可见橘红色的矿化结节形成(见图1C)。

图1 体外培养的大鼠成骨细胞形态及染色结果
2.2 辛伐他汀干预对大鼠成骨细胞经典Wnt相关因子mRNA的影响 本研究所提取得总的RNA其吸光度值OD260/OD280在1.8~2.0之间,提示纯度较好;其荧光强度比RNA 28S:18S=2:1,且条带无弥散现象,提示RNA完整、无降解。
2.2.1 不同浓度辛伐他汀对于大鼠成骨细胞经典Wnt信号通路的影响 不同浓度辛伐他汀干预体外培养的大鼠成骨细胞24 h后,与对照组比较,10-5mol/L组Wnt3a[(2.09±0.12)vs(1.82±0.09)]、LRP5 [(1.42±0.07)vs(1.29±0.07)]和β-catenin[(1.10±0.06) vs(0.95±0.06)]的mRNA表达显著增加(P值分别为0.007、0.04和0.006),其余浓度辛伐他汀组Wnt3a、LRP5和β-catenin的mRNA表达差异无统计学意义(P>0.05),见表1。不同浓度辛伐他汀干预体外培养的大鼠成骨细胞48 h和72 h后,与对照组比较,10-8~10-5mol/L各组Wnt3a、LRP5和β-catenin的mRNA表达均显著增加,且随着辛伐他汀浓度增大mRNA表达增多,除了β-catenin外(P<0.05),见表2、表3。
表1 不同浓度辛伐他汀干预24 h对大鼠成骨细胞经典Wnt信号通路的影响(,n=3)
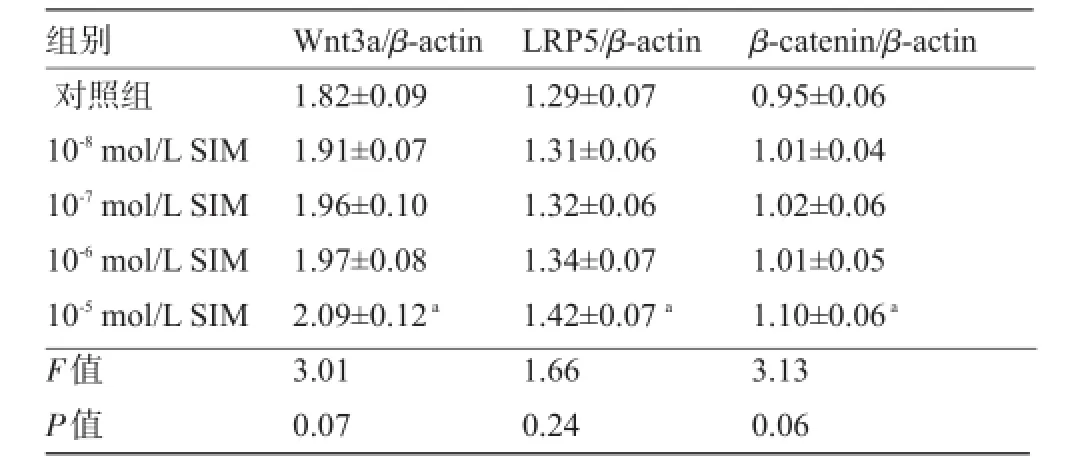
表1 不同浓度辛伐他汀干预24 h对大鼠成骨细胞经典Wnt信号通路的影响(,n=3)
注:与对照组比较,aP<0.05
2.2.2 辛伐他汀干预时间不同对于大鼠成骨细胞经典Wnt信号通路的影响 辛伐他汀浓度为10-8~10-5mol/L各组中分别干预24 h、48 h和72 h,随着干预时间延长Wnt3a和LRP5的mRNA表达增加(各浓度组Wnt3a和LRP5统计结果分别为F=24.73,P=0.01和F=10.45,P=0.01;F=38.95,P=0.000和P=18.75,P= 0.003;F=83.06,P=0.000和F=28.41,P=0.001;F= 85.42,P=0.000和P=29.15,P=0.001);干预48 h与24 h比较,β-catenin的mRNA表达差异无统计学意义[(1.08±0.09)vs(1.02±0.06),P>0.05],而干预72 h较24 h均显著增加[(1.23±0.10)vs(1.02±0.06),P<0.05],且辛伐他汀浓度为10-6mol/L和10-5mol/L干预72 h较48 h显著增加[(1.32±0.07)vs(1.11±0.05)和(1.47±0.08)vs(1.19±0.04),P<0.05],见图2。
表2 不同浓度辛伐他汀干预48 h对大鼠成骨细胞经典Wnt信号通路的影响(,n=3)

表2 不同浓度辛伐他汀干预48 h对大鼠成骨细胞经典Wnt信号通路的影响(,n=3)
表3 不同浓度辛伐他汀干预72 h对大鼠成骨细胞经典Wnt信号通路的影响(,n=3)

表3 不同浓度辛伐他汀干预72 h对大鼠成骨细胞经典Wnt信号通路的影响(,n=3)
注:与对照组比较,aP<0.05;与相邻低浓度组比较,bP<0.05
组别对照组10-8mol/L SIM 10-7mol/L SIM 10-6mol/L SIM 10-5mol/L SIM F值P值Wnt3a/β-actin 1.98±0.07 2.36±0.09a2.53±0.06ab2.68±0.06ab3.05±0.06ab96.52 0.000 LRP5/β-actin 1.38±0.06 1.55±0.08a1.69±0.07ab1.76±0.08a1.93±0.08ab22.02 0.000 β-catenin/β-actin 1.00±0.05 1.14±0.06a1.22±0.07a1.32±0.07a1.47±0.08ab21.90 0.000

图2 不同浓度辛伐他汀不同的干预时间对大鼠成骨细胞经典Wnt信号通路的影响
3 讨论
骨质疏松(OP)的发生是成骨细胞和破骨细胞平衡失调引起的,即骨吸收超过了骨形成,涉及激素、细胞因子、机械应力等多方面因素,迄今为止OP的发病机制尚未完全阐明,近年来,研究发现经典Wnt信号通路在骨代谢过程中具有重要意义。经典Wnt信号通路是Wnt蛋白与其受体卷曲蛋白(Frz)和辅助受体LRP5/6结合形成复合物,然后Frz作用于胞质内的蓬松蛋白(Dvl-1),Dvl-1使糖原合成GSK-3β,抑制β-catenin的降解,使胞质内β-catenin累积并转入细胞核,与T细胞因子(TCF/LEF)相互作用激活靶基因转录,调节成骨细胞活性[1-2]。Shahnazari等[3]研究表明,在骨形成和骨代谢过程中Wnt/β-catenin信号通路发挥着极其重要的调控作用。Day等[4]发现经典Wnt信号通路激活可以促进成骨细胞的形成,并且在软骨形成过程中促进成骨细胞的分化。Hill等[5]发现阻断间质中Wnt/β-catenin信号通路后,会减少成骨细胞的分化和影响骨骼的发育。
他汀类调脂药(Statins)是3-羟基3-甲基戊二酰辅酶A还原酶(HMG-CoA)抑制剂,除了具有降低胆固醇、保护内皮功能、抗炎、抗氧化等多效性外,近年来发现他汀还具有激活成骨细胞、促进成骨细胞增殖、增加骨形成的作用,他汀在骨质疏松方面的研究成为了当前的热点。最早发现他汀具有促进成骨作用是在1999年,Mundy等[6]通过体外实验首先发现他汀类药物可以增加骨形态发生蛋白2(BMP-2)mRNA的表达,说明其具有激活成骨细胞,促进骨合成代谢的作用。后来的临床研究也证实他汀类药物可降低骨折风险[7],增加骨密度[8]。但是其作用机制目前尚未完全阐明。有两项研究显示辛伐他汀在增加大鼠骨髓间充质干细胞(BMSCs)[9]和胚胎干细胞(ESCs)[10]向成骨细胞分化过程中,会出现Wnt信号通路相关因子水平增高。本研究表明辛伐他汀干预体外培养的大鼠成骨细胞可促进其经典Wnt信号通路中Wnt3a、LRP5和 β-catenin的mRNA表达,并且总体趋势是呈浓度和时间依赖的,即辛伐他汀浓度越大,干预时间越长,促进上述基因表达越明显,尤其是Wnt3a和LRP5。由于激活经典Wnt信号通路可以促进成骨细胞活性和骨形成,本研究发现辛伐他汀可以促进成骨细胞经典Wnt信号通路主要因子的基因表达,其机制可能与他汀类药物激活成骨细胞经典Wnt信号通路有关,但由于本研究仅为mRNA水平检测,尚待进一步研究。
[1]Verkaar F,Zaman GJ.New avenues to target Wnt/β-catenin signaling[J].Drug Discov Today,2011,16(1-2):35-41.
[2]贾忠宝,张柳,田发明.Wnt/β-catenin信号通路主要因子与成骨细胞研究进展[J].中国骨质疏松杂志,2012,18(1):90-91.
[3]Shahnazari M,Yao W,Corr M,et al.Targeting the Wnt signaling pathway to augment bone formation[J].Curr Osteoporos Rep, 2008,6(4):142-148.
[4]Day TF,Guo X,Garrett-Beal L,et al.Wnt/beta-catenin signaling in mesenchymal progenitors controls osteoblast and chondrocyte differentiation during vertebrate skeletogenesis[J].Dev Cell,2005,8 (5):739-750.
[5]Hill TP,Spater D,Taketo MM,et al.Canonical Wnt/beta-catenin signaling prevents osteoblasts from differentiating into chondrocytes[J].Dev Cell,2005,8(5):727-738.
[6]Mundy G,Garrett R,Harris S,et al.Stimulation of bone formation in vitro and in rodents by statins[J].Science,1999,286(5446): 1946-1949.
[7]Hatzigeorgiou C,Jackson JL.Hydroxymethylglutaryl-coenzyme A reductase inhibitors and osteoporosis:a meta-analysis[J].Osteoporos Int,2005,16(8):990-998.
[8]Gotoh M,Mizuno K,Ono Y,et al.Fluvastatin increases bone mineral density in postmenopausal women[J].Fukushima J Med Sci, 2011,57(1):19-27.
[9]张磊,张柳,田发明,等.辛伐他汀对大鼠BMSCs成骨诱导Wnt信号传导通路相关因子mRNA表达的影响[J].中国修复重建外科杂志,2009,11(23):1371-1375.
[10]Qiao LJ,Kang KL,Heo JS.Simvastatin promotes osteogenic differentiation of mouse embryonic stem cells via canonical Wnt/ β-catenin signaling[J].Mol Cells,2011,32(5):437-444.
Effect of simvastatin on the related factors in expression of canonical Wnt signaling pathway in osteoblasts of rats.
FU Kun-fa,LU Bing,LIU Ye,HU Jian,KONG Fan-rong.
Department of Geriatrics,Jiangsu Province Geriatric Hospital,Nanjing 210024,Jiangsu,CHINA
ObjectiveTo investigate the effect of different concentrations,multi-treatment course of simvastatin on the mRNA expression of Wnt3a,LRP5 and β-catenin in osteoblasts of rats and the potential mechanism. MethodsOsteoblasts were obtained from calvaria.Morphology of osteoblasts was observed under phase contrast microscope after ALP staining and Alizarin red staining.Rat osteoblasts were treated by different concentrations of simvastatin(10-8mol/L,10-7mol/L,10-6mol/L and 10-5mol/L),and Wnt3a,LRP5 and β-catenin mRNAexpression were detected using RT-PCR after 24 h,48 h and 72 h.ResultsThe cultured cells had the typical features of osteoblasts.Comparedwith that in control group,the result of RT-PCR showed that the expression of Wnt3a[(2.09±0.12)vs(1.82±0.09)],LRP5 [(1.42±0.07)vs(1.29±0.07)]and β-catenin[(1.10±0.06)vs(0.95±0.06)]mRNA in 10-5mol/L simvastatin group treated after 24 h,and those of Wnt3a(F=37.78 and 96.52,P=0.000)and LRP5(F=10.32,P=0.001 and F=22.02,P=0.000) increased significantly with the increase of concentration of simvastatin in each group treated after 48 h and 72 h(P<0.05).After 24 h,48 h and 72 h intervention,the expression of Wnt3a and LRP5 mRNA increased significantly in each group as the intervention time got longer.In group 10-6mol/L and 10-5mol/L,compared with that after simvastatin intervention 48 h,β-catenin mRNA expression increased significantly after 72 h[(1.32±0.07)vs(1.11±0.05)and (1.47±0.08)vs(1.19±0.04),P<0.05].ConclusionSimvastatin could promote Wnt3a,LRP5 and β-catenin mRNA gene's expression of canonical Wnt signaling pathway in osteoblast of rats.
Simvastatin;Osteoblasts;Canonical Wnt signaling pathway;Osteoporosis
R-332
A
1003—6350(2014)22—3286—04
10.3969/j.issn.1003-6350.2014.22.1290
2014-06-12)
傅坤发。E-mail:fukunfa@hotmail.com
