兔颈总动脉破裂粥样硬化斑块模型的建立
2014-05-05刘新叶杨东伟
刘新叶 杨东伟 程 勇 刘 敏 池 豪
郑州大学附属郑州中心医院心内科,郑州 450007
兔颈总动脉破裂粥样硬化斑块模型的建立
刘新叶 杨东伟▲程 勇 刘 敏 池 豪
郑州大学附属郑州中心医院心内科,郑州 450007
目的 建立负压吸引激发兔颈总动脉粥样硬化斑块破裂,建立破裂斑块模型。 方法 将30只健康雄性新西兰白兔随机分为3组,分别为对照组(n=10)、高脂饲养组(n=10)和球囊损伤+高脂饲养组(n=10)。饲养8周后,彩色多普勒超声测量颈总动脉内径、内-中膜厚度(IMT)及颈动脉血流速度等,评估动脉IMT与动脉粥样硬化程度的关系。采用“腔外负压”法诱导斑块破裂并处死动物,观察诱发斑块破裂成功率,在肉眼及光镜下观察颈动脉内膜形态特征。 结果 球囊损伤+高脂饲养组、高脂饲养组的颈总动脉血流速度显著快于对照组,IMT显著厚于对照组,颈总动脉内径显著短于对照组;球囊损伤+高脂饲养组的颈总动脉内径显著短于高脂饲养组,IMT显著厚于高脂饲养组,颈总动脉血流速度显著快于高脂饲养组(P<0.05)。球囊损伤+高脂饲养组可见平滑肌细胞增生,脂质、炎症细胞、泡沫细胞浸润,符合不稳定性斑块特征,有8例诱发斑块破裂,1例死亡;高脂饲养组可见内膜下脂质沉积,炎症细胞浸润,但内皮细胞完整,内弹力板排列整齐,1例诱发斑块破裂,无动物死亡;对照组内皮细胞完整,中层平滑肌细胞排列整齐,无一例诱发斑块破裂,无动物死亡。 结论 本实验建立动脉粥样硬化斑块破裂模型成功率高,动物死亡率低,实验操作简便易行,为冠心病的生理、病理及药物学效应方面研究提供了可靠的实验平台。
兔;动物模型;颈动脉粥样硬化斑块;负压吸引法;激发
随着社会的进步和人民生活水平的提高,冠状动脉粥样硬化性心脏病(冠心病)已成为人类的“第一杀手”,其中导致患者致残或致死的原因是急性冠脉综合征 (ACS),ACS是由于冠状动脉斑块表面糜烂、裂纹或破裂导致血小板黏附,聚集,活化;同时激活凝血系统导致冠状动脉内的急性血栓形成,造成心肌细胞的损伤及坏死。研究破裂斑块的特性及干预斑块破裂导致的一系列病理生理过程成为当前的研究热点。与人体其他组织不同,动脉是不可能取活检的,因此,有关ACS的组织学研究基本依赖动物模型,建立动脉粥样硬化破裂斑块动物模型对研究ACS的发病机制、病理变化、诊断、治疗及预防均有重要意义。
1 材料与方法
1.1 实验材料
雄性新西兰大白兔30只,体重2.0~2.5 kg,购自郑州大学动物实验中心,随机分为3组,分别为对照组(n=10),高脂饲养组(n=10),球囊损伤+高脂饲养组(n=10),均喂养8周。对照组饮食为普通颗粒基础饲料,高脂饮食为基础饲料+4%胆固醇+4%猪油,由郑州大学动物实验中心提供。
1.2 仪器与方法
1.2.1 彩色多普勒超声检查 应用美国惠普 Sonos 5500彩色多普勒超声诊断仪,探头频率为7.0~11.0 MHz。所有实验对象分别于术前1天和动物处死前1天空腹状态下行彩色多普勒超声检查,测量兔左侧颈总动脉内径、内-中膜厚度(IMT)及颈动脉血流速度。将新西兰大白兔放置于检查台,头偏向检查对侧,充分暴露颈部,在胸锁乳突肌前或后缘作横切检查,超声探头沿动脉走行向头侧轻轻移动,跨过颈动脉分叉处,仔细观察血管内膜情况及有无斑块和钙化,所有操作均由同一位超声科高年资医师完成。
1.2.2 动物模型的建立 颈总动脉球囊损伤术:所有兔术前普通饲料适应性喂养3 d,术前禁食水6 h,腹腔注射氯胺酮(35 mg/kg),固定于手术台,常规消毒,静脉给予肝素钠100 U/kg体重,沿颈部正中切开皮肤约5.0 cm,暴露并游离左侧颈总动脉,分离左侧颈内、外动脉,临时夹闭颈总动脉近心端及颈内动脉,颈外动脉远端结扎,球囊损伤组在距左颈总动脉分叉处约0.5 cm剪开一斜形切口,逆行插入直径2.5 mm×10 mm球囊,连接压力泵,膨至3个大气压,由近心端缓慢回拉并旋转球囊,反复3次后撤出导管,结扎颈外动脉起始部,恢复颈总及颈内动脉血流,缝合皮肤。所有动物放置于同一动物房进行饲养。饲养8周后采用血栓抽吸装置对颈动脉斑块进行腔外负压吸引,负压容量置于30 ml处、持续时间10 s负压吸引,激发斑块破裂,所有操作由同一实验人员完成(图1)。
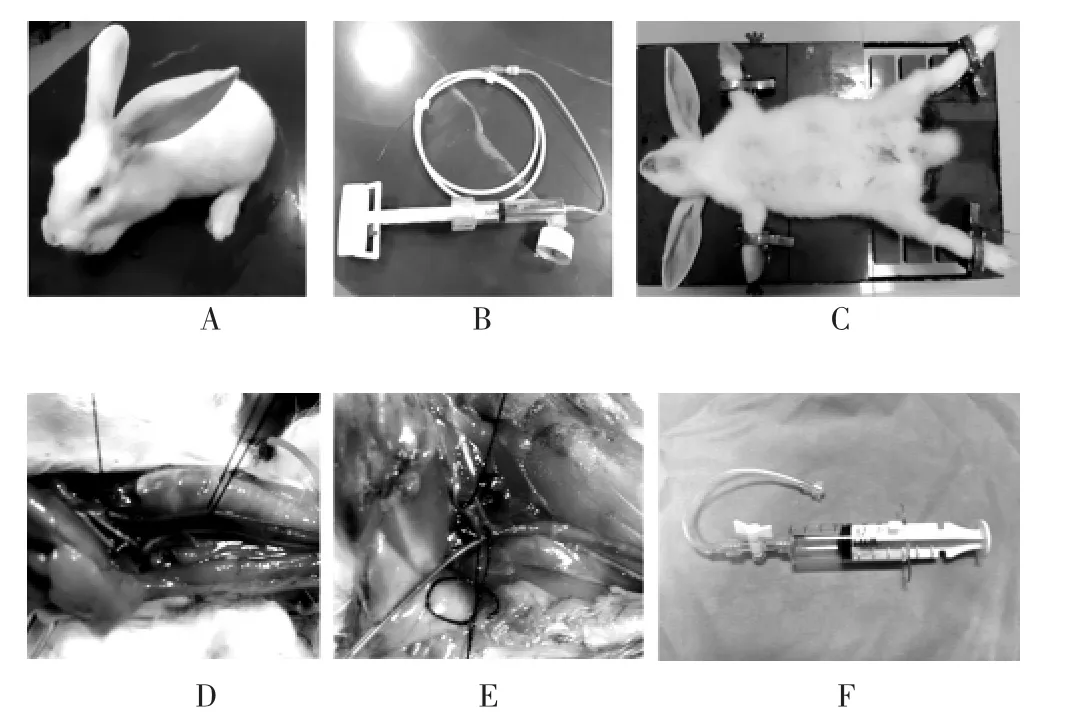
图1 兔颈动脉粥样硬化模型的建立
1.2.3 形态学分析 常规消毒,麻醉,活体状态下切开颈部皮肤及皮下组织,迅速取出左侧颈总动脉,用冰生理盐水洗净残血,滤纸吸干血管,剪掉血管周围残余组织,放入10%中性甲醛(磷酸盐缓冲液配制)固定>24 h,流水冲洗,梯度酒精脱水,常规石蜡包埋,冠状面连续切片,厚度4 μm,HE染色,中性树脂封固,光学显微镜下观察。
1.3 统计学处理
采用SPSS 16.0统计软件对数据进行分析和处理,计量资料以±s表示,采用方差分析,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 3组激发斑块破裂情况的比较
对照组10例,0例(0%)激发粥样斑块破裂;高脂饲养组10例,1例 (10%)激发粥样硬化斑块破裂成功;球囊损伤+高脂饲养组10例,1例术后死于出血,存活9例中8例(80%)激发斑块破裂成功,3组比较差异有统计学意义(P<0.05)。
2.2 3组颈总动脉内径、IMT和颈总动脉血流速度的比较
球囊损伤+高脂饲养组、高脂饲养组的颈总动脉内径显著短于对照组,IMT显著厚于对照组,颈总动脉血流速度显著快于对照组;球囊损伤+高脂饲养组的颈总动脉内径显著短于高脂饲养组,IMT显著厚于高脂饲养组,颈总动脉血流速度显著快于高脂饲养组(P<0.05)(表1)。
表1 3组颈总动脉内径、IMT和颈总动脉血流速度的比较(±s)

表1 3组颈总动脉内径、IMT和颈总动脉血流速度的比较(±s)
与对照组实验后比较,*P<0.05;与高脂饲养组实验后比较,#P<0.05
组别 总动脉内径(mm)IMT (mm)颈总动脉血流速度(m/s)对照组(n=10)实验前实验后高脂饲养组(n=10)实验前实验后球囊损伤+高脂饲养组(n=10)实验前实验后1.90±0.08 1.90±0.17 0.52±0.07 0.58±0.05 0.57±0.09 0.64±0.08 1.87±0.18 1.66±0.10*0.56±0.11 0.70±0.07*0.62±0.09 0.82±0.10*1.90±0.14 1.59±0.13*#0.57±0.09 0.81±0.05*#0.57±0.08 0.90±0.13*#
2.3 3组左侧颈总动脉超声检查结果
对照组颈动脉管腔结构清晰、壁光滑、血流稳定;高脂饲养组与球囊损伤+高脂饲养组管腔结构紊乱,血流速度增快(图2)。
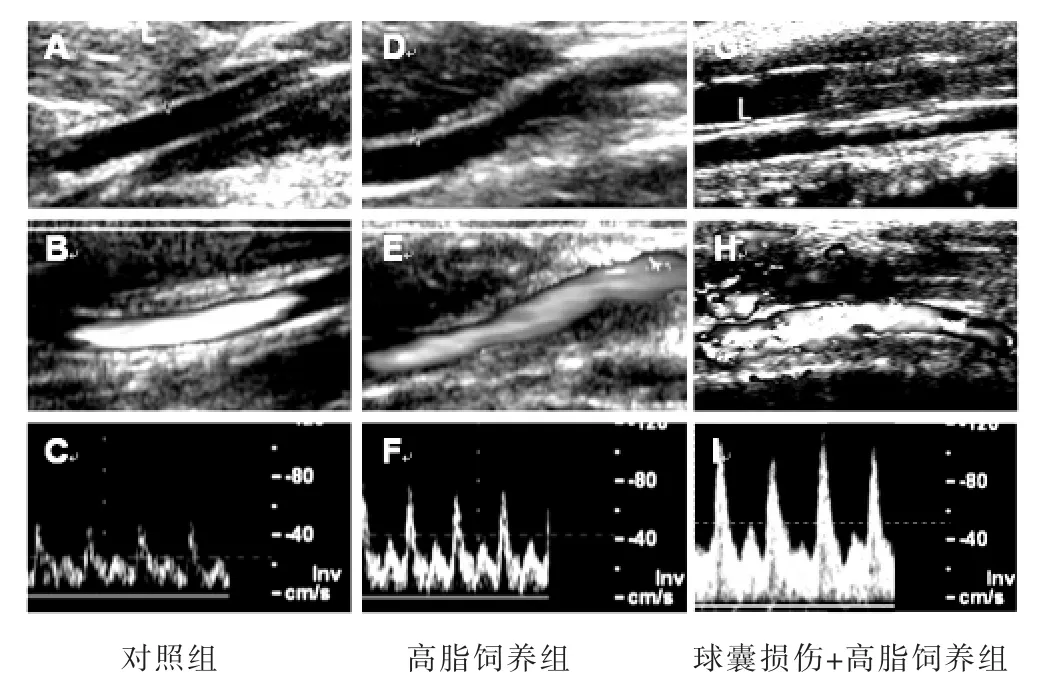
图2 3组左侧颈总动脉超声检查结果
2.4 3组兔的形态学观察
①肉眼观察:对照组的左颈总动脉柔软而有弹性,取材后可见管腔内膜光滑,未见粥样斑块;高脂饲养组的颈部皮下可见大量脂肪组织;球囊损伤+高脂饲养组的左颈总动脉管壁粗细不均,内膜可见多个黄白色斑块隆起,大小不等,成点片状。②光镜下观察:对照组的颈动脉内皮细胞完整,中层平滑肌细胞排列整齐,呈长形或椭圆形,胞质呈嗜酸性红染;高脂饲养组可见内膜下脂质沉积,炎症细胞浸润,但内皮细胞完整,内弹力板排列整齐;球囊损伤+高脂饲养组可见颈动脉内皮细胞脱落,多数血管可见粥样斑块或纤维斑块,部分斑块中可见新生血管,并有大量的炎症细胞浸润,内膜下脂质泡沫细胞、平滑肌细胞增生明显,中层平滑肌细胞排列紊乱,胞质嗜酸性平滑肌细胞减少,代之以大量胞质淡染和充满脂质空泡的泡沫细胞,并经内弹力膜向斑块部位游走,弹力纤维崩解、断裂、溶解,均可见胶原增生,“腔外负压”法激发斑块破裂,血栓形成(图3)。
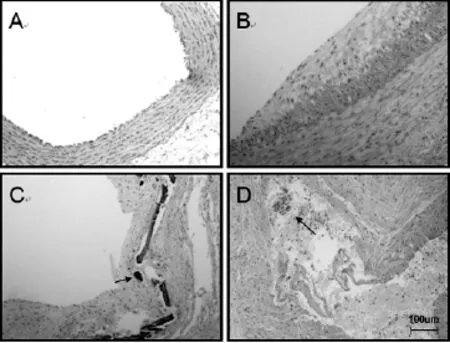
图3 3组兔光镜下形态学变化
3 讨论
动脉粥样硬化是一种慢性炎症反应性疾病,常累及大中动脉,动脉粥样硬化斑块破裂与急性血栓形成可导致急性心肌梗死、猝死等[1]。研究显示,高胆固醇血症能够激活体内炎症免疫反应,致使血管内皮功能异常,是动脉粥样硬化的始动因素[2-4]。建立合适的动脉粥样硬化及斑块破裂动物模型有助于更好地了解动脉粥样硬化斑块破裂发生的确切机制。近些年,动物实验研究得到长足发展,各种动物模型如兔、小鼠、大鼠、猪及灵长类动物等均被用于动脉粥样硬化的实验研究[5]。由于兔对外源性胆固醇吸收率高,对高血脂清除力低,体内低密度脂蛋白含量高,血浆中富含胆固醇酯转移蛋白,肝脏只能合成ApoB-100,给高脂饲料经8~12周即可形成明显的动脉粥样硬化,目前仍是动脉粥样硬化研究中最常用的模型之一[6]。小动物模型存在以下限制性:①动脉粥样硬化斑块主要出现在主动脉及其分支,冠状动脉和颈动脉内不出现斑块;②兔子的动脉粥样硬化斑块主要为纤维增生性病变,不同于人类的脂质性斑块;③兔子和小鼠的动脉粥样硬化斑块均为稳定性斑块,几乎不发生斑块自发性易损和破裂[7]。动脉粥样硬化斑块破裂与动脉血栓形成模型的制备既往多采用球囊损伤、药物及氧化剂激发等方式,但成功率低、不易控制[8-11]。早在1961年,Constantinides等[12]在高脂喂养的家兔中,经腹腔注射蝰蛇毒(内皮毒素和促凝剂)和组胺(血管加压药)以促使斑块破裂,但发生率很低。1995年Abela等[13]对上述动物模型进行了改良,采用球囊拉伤腹主动脉内皮后给予高胆固醇饲料喂养的方法,在新西兰家兔中建立稳定斑块模型,然后给予鲁塞尔蝰蛇毒、组胺药物触发,成功地建立了药物诱发斑块破裂和血栓形成的动物模型,但因为全身用药导致动物死亡率高,且不符合自然病理生理过程,影响观察结果。1998年Rekhter等[14]在兔动脉粥样斑块中埋置可控制性气囊,以充盈气囊的压力代表诱发斑块破裂的机械牵张力,可复制出斑块破裂的动物模型。2002年,von der Thüsen等[15]在ApoE-/-小鼠的斑块部位注入携带野生型p53基因的重组型腺病毒载体的悬液,发现斑块破裂数有所增加,但这一方法的缺点是操作复杂、动物死亡率高、模型复制较为困难。遗传性高脂血症Watanabe兔和人ApoA转基因兔等虽可形成动脉粥样硬化,但无斑块破裂及血栓形成证据,且其成本高,制模耗费时间长,故在动脉粥样硬化的专项研究中应用极少。Ni等[7,16-17]应用高脂喂养、内皮损伤、基因转染、精神应激、药物触发等方法,成功地在新西兰兔和ApoE-/-小鼠中建立了斑块易损、出血和破裂的动物模型,获得了国际学术界的认可,为易损斑块的基础研究提供了适宜的研究对象,但也受到以上因素影响,存在一定的不足。在动物模型中,猪、兔、大鼠的冠状动脉及腹主动脉经物理方法损伤后、高脂喂养后可形成动脉粥样斑块,但是由于斑块部位的特殊性,目前还没有成熟可靠的激发斑块破裂的方法。目前国内外都在探索一种易操作的实验动物,可靠形成动脉硬化斑块、容易监测的血管及高效安全的激发斑块破裂的方法。由于兔颈动脉位于体表,球囊损伤及负压吸引操作方便,不易造成动物死亡,且超声便于观察血管形态及斑块特征。本实验通过球囊损伤加高脂饮食成功诱发兔颈动脉粥样硬化斑块形成,且在光学显微镜下观察发现颈动脉内皮细胞脱落,血管可见粥样斑块或纤维斑块形成,炎症细胞、润泡沫细胞浸润,平滑肌细胞增生明显,弹力纤维崩解、断裂、溶解,符合不稳定性斑块特征。采用的“腔外负压吸引”法可诱发粥样硬化斑块破裂,血栓形成,经彩色多普勒超声及病理学检查进一步验证,为深入研究动脉粥样硬化斑块破裂发生的内在机制提供了可靠的动物模型。
综上所述,本实验成功建立了动脉粥样硬化及斑块破裂模型,为动脉粥样硬化与冠心病的临床研究提供了实验基础,此模型简便、快速、成本低、可重复性强及成功率高,在生理、病理及药物学效应方面为冠心病的研究提供了可靠的实验平台。
[1]Spagnoli LG,Mauriello A,Sangiorgi G,et al.Extracranial thrombotically active carotid plaque as a risk factor for ischemic stroke[J].JAMA,2004,292(15):1845-1852.
[2]Ross R.Atherosclerosis:an inflammatory disease[J].N Engl J Med,1999,340(14):115-126.
[3]Glass CK,Witztum JL.Atherosclerosis.the road ahead[J]. Cell,2001,104(4):503-516.
[4]Andersson J,Libby P,Hansson GK.Adaptive immunity and atherosclerosis[J].Clin Immunol,2010,134(1):33-46.
[5]Xiangdong L,Yuanwu L,Hua Z,et al.Animal models for the atherosclerosis research:a review[J].Protein Cell,2011,2(3):189-201.
[6]Dornas WC,Oliveira T,Augusto LE,et al.Experimental athe rosclerosis in rabbits[J].Arg Bras Cardiol,2010,95(2):272-278.
[7]NiM,ChenWQ,ZhangY.Animalmodelsandpotentialmechanisms of plaque destabilisation and disruption[J].Heart,2009,95(17):1393-1398.
[8]Mehrad H,Mokhtari-Dizaji M,Ghanaati H,et al.Developing a rabbit model of neointimal stenosis and atherosclerotic fibrous plaque rupture[J].J Tehran Heart Cent,2011,6(3):117-125.
[9]Xian X,Ding Y,Zhang L,et al.Enhanced atherothrombotic formation after oxidative injury by FeCl3to the common carotid artery in severe combined hyperlipidemic mice[J]. Biochem Biophys Res Commun,2009,385(4):563-569.
[10]Evans DJ,Jackman LE,Chamberlain J,et al.Platelet P2Y(12)receptor influences the vessel wall response to arterial injury and thrombosis[J].Circulation,2009,119(1):116-122.
[11]Fang SM,Zhang QH,Jiang ZX.Developing a novel rabbit model of atherosclerotic plaque rupture and thrombosis by cold-induced endothelial injury[J].J Biomed Sci,2009,16:39.
[12]Constantinides P,Chakravarti RN.Rabbit arterial thrombosis production by systemic procedures[J].Arch Pathol,1961,72:197-208.
[13]Abela GS,Picon PD,Friedl SE,et al.Triggering of plaque disruption and arterial thrombosis in an athersclerotic rabbit model[J].Circulation,1995,91(3):776-784.
[14]Rekhter MD,Hicks GW,Brammer DW,et al.Animal model that mimics atherosclerotic plaque rupture[J].Circ Res,1998,83(7):705-713.
[15]von der Thüsen JH,van Vlijmen BJ,Hoeben RC,et al.Induction of atherosclerotic plaque rupture in apolipoprotein E-/-mice after adenovirus-mediated transfer of p53 [J].Circulation,2002,105(17):2064-2070.
[16]Zhang L,Liu Y,Lu XT,et al.Intraplaque injection of Ad5-CMV.p53 aggravates local inflammation and leads to plaqueinstabilityinrabbits[J].JCellMolMed,2009,13(8B):2713-2723.
[17]Ni M,Wang Y,Zhang M,et al.Atherosclerotic plaque disruption induced by stress and lipopolysaccharide in apol ipoprotein E knockout mice[J].Am J Physiol Heart Circ Physiol,2009,296(5):H1598-H1606.
Establishment of model of carotid atherosclerosis plaque rupture in rabbits
LIU Xin-ye YANG Dong-wei▲CHENG Yong LIU Min CHI Hao
Department of Cardiology,Zhengzhou Central Hospital of Zhengzhou University,Zhengzhou 450007,China
ObjectiveTo establish an animal model of plaque rupture by negative barometric pressure triggering carotid atherosclerosis plaque.Methods30 healthy New Zealand white male rabbits were randomly divided into 3 groups,including control group(n=10),high fat-diet group(n=10)and carotid lesion with balloon dilation and high fat-diet group(n=10).After 8 weeks,carotid artery diameterthe,intima-media thickness(IMT)and blood flow rate of carotids was measured respectively by color Doppler ultrasound,the relationship between IMT and the severity of atherosclerosis was evaluated.Plaque ruptures were triggered by negative pressures of extra-cavity,all rabbits were sacrificed.The success rate of plaque rupturethe was observed and carotid intima morphology was observed in the naked eye and the light microscope.ResultsCarotid artery blood flow velocity in high fat-diet group and carotid lesion with balloon dilation and high fat-diet group was significantly faster than that in control group respectively,IMT in high fat-diet group and carotid lesion with balloon dilation and high fat-diet group was significantly thicker than that in control group respectively,carotid artery diameterthe in high fat-diet group and carotid lesion with balloon dilation and high fat-diet group was significantly shorter than that in control group respectively(P<0.05).Carotid artery blood flow velocity in carotid lesion with balloon dilation and high fat-diet group was significantly faster than that in high fat-diet group,IMT in carotid lesion with balloon dilation and high fat-diet group was significantly thicker than that in high fat-diet group,carotid artery diameterthe in carotid lesion with balloon dilation and high fat-diet group was significantly shorter than that in high fat-diet group(P<0.05).The typical pathological changes of atherosclerosis,such as thickening of the carotid endomembrane,transmigration and proliferation of smooth muscle cells,lipidosis,inflammatory cell and foam cells infiltration,carotid arteries inner elastic force layer fracture,formations of atherosclerosis plaque were found in rabbits of carotid lesion with balloon dilation and high fat-diet group,and 8 rabbits were triggered by negativebarometric pressure,only one rabbit dead.Deposition of lipid membrane,inflammatory cell infiltration,but the endothelial cells,internal elastic plate arranged in neat rows were seen in the high fat-diet group,1 case of induced plaque rupture, no animal death.Endothelial cell integrity,smooth muscle cells arranged in neat rows in control group,1 case without inducing plaque rupture,no animal death.ConclusionThis study has been established a new method of atherosclerosis and plaque rupture of carotid atherosclerotic in rabbit of which would be setting a reliable research platform of coronary heart disease such as physiology,pathology and effects of drug.
Rabbits;Animal model;Carotid atherosclerosis plaque;Negative barometric pressure;Trigger
R743
A
1674-4721(2014)03(c)-0019-05
2014-02-19本文编辑:李亚聪)
河南省郑州市科技攻关计划;郑州市博士基金项目资助(2010-010021)
刘新叶(1971-),女,硕士,主要研究方向为冠心病的诊断及治疗
▲通讯作者:杨东伟(1971-),男,博士,副主任医师,主要研究方向为冠心病的介入治疗
