小球藻联产油脂和虾青素的基元模式分析
2014-05-04赵权宇于水燕张保国史吉平
赵权宇,于水燕,张保国,史吉平
(中国科学院 上海高等研究院,上海 201210)
CO2减排是世界范围内的一个重要课题,微藻可以通过光合作用固定CO2,再将CO2转化成生物质。部分微藻在缺氮等胁迫条件下能富集油脂,可以进一步开发成生物柴油,是非常有潜力的生物燃料[1]。微藻生物炼制的产业链上包括多个技术难点。其中,藻种选育、大规模培养和藻水分离等都有了大量研究积累。目前,降低生产成本,提高经济效益仍是微藻生物柴油产业化的关键,和乙醇发酵过程耦联[2]或联产高附加值产品[3]都是可行的模式。
虾青素是具有超强抗氧化性的脂溶性色素,可以开发成保健品、药品或食品添加剂等,市场潜力巨大。红法夫酵母和雨生红球藻是主要的虾青素生产模式体系[4-6]。虽然小球藻中虾青素的含量低[7-9],但是规模化培养小球藻提取油脂后联产的虾青素也有一定规模。
基元模式是代谢网络中从底物到产物的可能途径或内部循环[10]。通过基元模式分析,可以探讨生物代谢调控机制或进行菌株改造等[11]。本文中笔者首先构建小球藻的代谢网络模型,通过基元模式分析,考察小球藻在正常培养和缺氮培养条件下油脂代谢和虾青素的合成。
1 计算部分
1.1 模型构建
在文献构建的小球藻代谢网络模型基础上[12-14],增加了虾青素合成途径,并完善了三羧酸循环(TCA)途径的代谢反应。一般来说,代谢网络中包含一个生物质合成反应,该反应由蛋白质、糖、脂类和核酸等组成,以及相关能量和辅因子代谢计算得到。生物质合成反应的系数会随着培养条件的不同而变化,比如正常培养(+N)和缺氮培养(-N)等[14],这样计算的基元模式就会不同。为了便于考察小球藻正常培养和缺氮培养的代谢情况,参照文献[15]的方法,取消了生物质合成总反应,为生物质合成反应中的若干前体物质设定了相应的外部代谢物。构建的小球藻代谢网络模型包括生化反应29个,底物和产物跨膜传递以及生物质前体生成过程14个,详见附表。
1.2 胞内代谢通量的估算方法
胞内代谢通量分布反映细胞的代谢表型,可以深入了解代谢调控机制。同位素标记代谢通量测定能准确得到胞内代谢分布,但是一般集中在中心碳代谢。为了在更大代谢网络模型上得到代谢流量分布,可以集成同位素标记实验结果,通过有约束代谢通量分析获得代谢通量分布[16-17]。代谢通量可以分解在基元模式上。通过基于基元模式的算法进行胞内代谢通量的估算也是可行的。首先由CellNetAnalyzer(V6.0)[18]计算基元模式,见式(1)。

式中:E为基元模式矩阵,λ为基元模式系数,v为代谢通量。笔者前期开发了基于基元模式的算法,可以集成同位素标记实验数据,通过最大熵原理估算胞内代谢分布[19-20]。具体算法见式(2)~(5)。
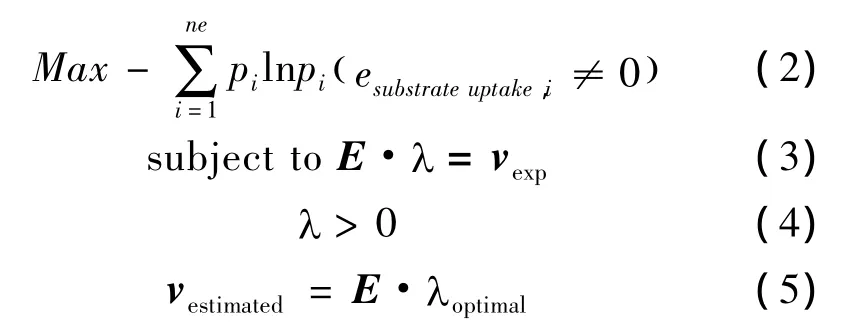
通过平均预测偏差比较预测值与实验值的差异,见式(6)。
式中:vexp为实验值;vestimated为代谢通量的预测值;ne为实验测定的代谢通量数。
1.3 基元模式概率的计算
笔者定义了基元模式概率pi[19]。第 i条基元模式概率pi由基元模式系数λi计算得到,反映了每条基元模式对代谢表型的贡献。

式中:vsubstrateuptake为底物摄取速率;esubstrateuptake,i为基元模式矩阵中第i条基元模式中底物摄取反应对应的系数。所有基元模式概率加合后为1。
1.4 油脂和虾青素合成效率的计算
基元模式的一个作用是分析代谢产物的理论合成效率。一般来说,除了内部循环外,每条基元模式都包括底物摄取和产物合成反应。由底物摄取和产物合成的基元模式系数即可计算该基元模式中的产物合成效率,见式(8)。

式中:Yi,product为第i条基元模式的某产物的合成效率;λi,product formation和 λi,product formation分别为第 i条基元模式中某产物的合成和底物摄取的基元模式系数。
2 结果与讨论
2.1 胞内代谢通量的估算
根据文献[13]报道的小球藻代谢通量数据,由式(2)~式(4)计算基元模式系数,再由式(5)估算胞内代谢通量分布,结果见图1。利用式(6)计算正常和缺氮培养条件下的代谢通量平均预测偏差均为0.05,虾青素的合成通量分别为0.38和0.35。

图1 小球藻正常培养(+N)和缺氮培养(-N)条件下胞内代谢通量估算值与实验值[13]比较Fig.1 Comparison of estimated flux distributions and experimental data[13] of Chlorella sp under normal condition and nitrogen-limited conditions
2.2 基元模式概率的计算
由式(7)计算小球藻正常培养和缺氮培养的基元模式概率,结果见图2。

图2 小球藻正常培养和缺氮培养条件下基元模式概率Fig.2 Probabilities of elementary modes of Chlorella sp.under normal and nitrogen limited conditions
由图2可见:在正常培养和缺氮培养条件下,第603、77、309和61条基元模式对代谢表型的贡献都是较大的。这4条基元模式在正常培养条件下的基元模式概率分别为26.14%、19.18%、8.84%和6.79%,总贡献为60.90%;在缺氮培养条件下的贡献为27.39%、27.88%、11.05%和11.21%,总贡献为77.53%。
第603条基元模式(EM603)包含糖酵解(EMP)和TCA途径(图3(a))。第77条基元模式(EM77)是从葡萄糖到生物质中乙酰辅酶A的合成(图3(b))。乙酰辅酶A是氨基酸和油脂合成的前体化合物。第309条基元模式(EM309)表示的是从葡萄糖到葡萄糖-6-磷酸进入磷酸戊糖途径,经糖酵解产生丙酮酸再进入TCA途径(图3(c))。第61条基元模式(EM61)是从葡萄糖经磷酸戊糖途径和糖酵解到生物质中乙酰辅酶A的合成(图3(d))。
这4条基元模式都包含能量代谢反应,说明能量代谢对小球藻代谢表型有重要作用。缺氮条件下,包含乙酰辅酶 A合成的基元模式(EM77和EM61)的贡献显著增加,对应的代谢表型表现为油脂含量的增加。概率最大的4条基元模式中并不包含虾青素的合成反应。在正常和缺氮培养条件下,含有虾青素合成的基元模式概率(pi),最大基元模式如图4所示。由图4可知:该途径不包含其他生物质前体的合成,这也是合成虾青素效率最高的途径。EMP途径有虾青素合成的2个重要前体,而从琥珀酸到富马酸的反应包含FAD等辅酶,这些辅酶也参与到虾青素的合成,因此这条基元模式包含了TCA途径。
2.3 油脂与虾青素合成效率
由式(8)计算乙酰辅酶A流向生物质合成(附表中反应R30)或虾青素合成(附表中反应R40)的理论产率。小球藻在正常和缺氮培养条件下的实际产率也标注在图5中。油脂产率和虾青素产率是竞争关系。由图4可知:在丙酮酸(PYR)节点,如果向虾青素的代谢通量增加,则向乙酰辅酶A的通量将减少,直接影响油脂产率。由图5可知,小球藻虾青素的最大理论产率为11.27%。氮胁迫(-N)使得油脂产率提高,但是虾青素含量也略有降低。如果要达到油脂和虾青素合成的最大化,还有很大的优化空间。很多手段可以调控虾青素的合成,异养即使无光也可以合成虾青素[9]。营养、盐度、铁离子、光照和活性氧等也会调控虾青素的累积[7-9,21-22],虾青素合成和油脂积累的协调优化还有待研究。

图3 小球藻正常和缺氮培养条件下主要基元模式:EM603(a)、EM77(b)、EM309(c)和EM61(d)Fig.3 Dominant elementary modes of Chlorella sp.under normal and nitrogen limited conditions:EM603(a),EM77(b),EM309(c)and EM61(d)
3 结论
1)建立了包含虾青素合成途径的小球藻代谢网络模型,并计算了其基元模式;集成同位素标记代谢通量数据,估算了胞内代谢通量分布。正常培养和缺氮培养下虾青素的代谢通量分别为0.38和0.35。
2)应用最大熵算法求取了正常和缺氮培养条件下小球藻的基元模式概率。在这2种培养条件下,4条基元模式对代谢表型的贡献分别为60.95%和77.53%。虾青素的最大理论产率为11.27%,而2种培养条件下的实际产量均低于0.4%。
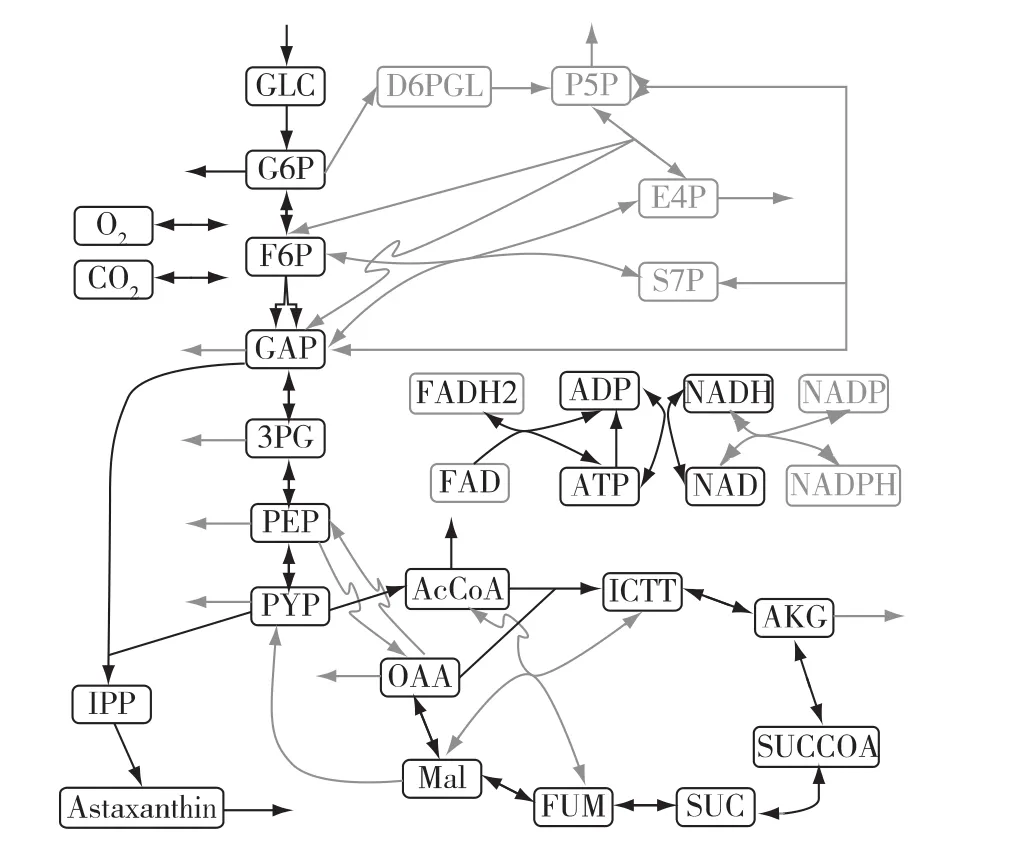
图4 虾青素的最有效基元模式ig.4 Most efficient elementary mode for astaxanthin production
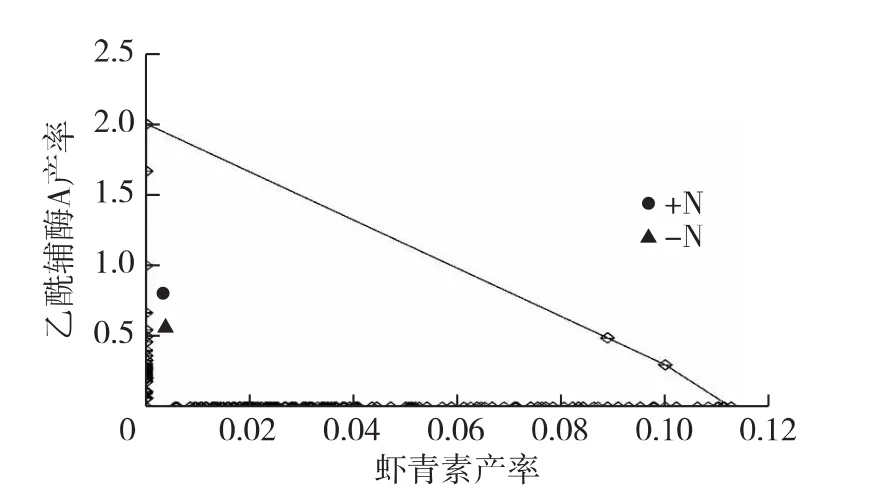
图5 小球藻虾青素产率与生物质中乙酰辅酶A产率的关系Fig.5 Relations between astaxanthin yield and ACCOA yield in biomass

附表:小球藻代谢网络模型(EXT:外部代谢物;==>不可逆反应;<==>可逆反应)

R15:ACCOA+ICIT+NAD==>NADH+FUM+MAL R16:MAL+NADP==>CO2+NADPH+PYR R17:PEP+CO2==>OAA R18:OAA+ATP==>ADP+PEP+CO2 R19:G6P+NADP==>D6PGL+NADPH R20:D6PGL+NADP==>P5P+CO2+NADPH R21:P5P+E4P<==>F6P+GAP R22:2 P5P<==>S7P+GAP R23:S7P+GAP<==>F6P+E4P R24:GAP+ATP+NADPH+PYR==>ADP+IPP+NADP+CO2 R25:NADH+8 IPP+FADH2==>Astaxanthin+NAD+FAD R26:NAD+NADPH==>NADH+NADP R27:1.5 ADP+FADH2+0.5 O2==>1.5 ATP+FAD R28:ATP==>ADP R29:ADP+NADH+0.5 O2==>NAD+ATP R30:ACCOA==>ACCOAEXT R31:AKG==>AKGEXT R32:E4P==>E4PEXT R33:G6P==>G6PEXT R34:GAP==>GAPEXT R35:OAA==>OAAEXT R36:3PG==>3PGEXT R37:P5P==>P5PEXT R38:PEP==>PEPEXT R39:PYR==>PYREXT R40:Astaxanthin==>AstaxanthinEXT R41:GLCEXT==>GLC R42:O2<==>O2EXT R43:CO2<==>CO2EXT
[1] 杨忠华,李方芳,曹亚飞,等.利用微藻固定CO2实现碳减排研究进展[J].生物加工过程,2012,10(1):70-76.
[2] 廖莎,姚长洪,薛松,等.利用乙醇发酵副产CO2培养富含淀粉亚心型四爿藻作为其补充原料[J].生物工程学报,2011,27(9):1292-1298.
[3] Liu J,Huang J,Jiang Y,et al.Molasses-based growth and production of oil and astaxanthin by Chlorella zofingiensis[J].Bioresour Technol,2012,107:393-398.
[4] 郑裕国,沈寅初.微生物发酵生产虾青素[J].生物工程进展,2002,22(2):19-22.
[5] 董庆霖,赵学明,邢向英,等.碳和氮代谢被抑制诱导雨生红球藻细胞内虾青素的合成[J].化学工程,2006,34(12):48-49.
[6] 董庆霖,赵学明,马红武,等.生物技术生产虾青素研究的最新进展[J].生物加工过程,2004,2(2):18-14.
[7] Ip P F,Chen F.Employment of reactive oxygen species to enhance astaxanthin formation in Chlorella zofingiensisin heterotrophic culture[J].Process Biochem,2005,40(11):3491-3496.
[8] Ip P F,Chen F.Peroxynitrite and nitryl chloride enhance astaxanthin production by the green microalga Chlorella zofingiensis in heterotrophic culture[J].Process Biochem,2005,40(11):3595-3599.
[9] Ip P F,Chen F.Production of astaxanthin by the green microalga Chlorella zofingiensis in the dark[J].Process Biochem,2005,40(2):733-738.
[10] Kurata H,Zhao Q,Okuda R,et al.Integration of enzyme activities into metabolic flux distributions by elementary mode analysis[J].BMC Syst Biol,2007,1:31.
[11] Zhao Q,Kurata H.Genetic modification of flux for flux prediction of mutants[J].Bioinformatics,2009,25(13):1702-1708.
[12] Xiong W,Gao C,Yan D,et al.Double CO2fixation in photosynthesis-fermentation model enhances algal lipid synthesis for biodiesel production[J].Bioresour Technol,2010,101(7):2287-2293.
[13] Xiong W,Liu L,Wu C,et al.13C-tracer and gas chromatographymass spectrometry analyses reveal metabolic flux distribution in theoleaginous microalga Chlorella protothecoides[J]. Plant Physiol,2010,154(2):1001-1011.
[14] Yang C,Hua Q,Shimizu K.Energetics and carbon metabolism duringgrowth ofmicroalgalcellsunderphotoautotrophic,mixotrophic and cyclic light-autotrophic/dark-heterotrophic conditions[J].Biochem Eng J,2000,6(2):87-102.
[15] Burgard A P,Maranas C D.Optimization-based framework for inferring and testing hypothesized metabolic objective functions[J].Biotechnol Bioeng,2003,82(6):670-677.
[16] 刘立明,刘婷,邹伟.基因组规模代谢网络模型的约束算法及其应用[J].生物加工过程,2012,10(6):70-77.
[17] 王宏丽,梁金钟.添加物对枯草芽胞杆菌γ-聚谷氨酸合成代谢的影响[J].生物加工过程,2010,8(1):45-49.
[18] Klamt S,Saez-Rodriguez J,Gilles E D.Structural and functional analysis of cellular networks with CellNetAnalyzer[J].BMC Syst Biol,2007,1:2.
[19] Zhao Q Y,Kurata H.Maximum entropy decomposition of flux distribution at steady state to elementary modes[J].J Biosci Bioeng,2009,107(1):84-89.
[20] Zhao Q Y,Kurata H.Use of maximum entropy principle with Lagrange multipliers extends the feasibility of elementary mode analysis[J].J Biosci Bioeng,2010,110(2):254-261.
[21] Wang Y,Liu Z,Qin S.Effects of iron on fatty acid and astaxanthin accumulation in mixotrophic Chromochloris zofingiensis[J].Biotechnol Lett,2013,35(3):351-357.
[22] Campenni L,Nobre B P,Santos C A,et al.Carotenoid and lipid production by the autotrophic microalga Chlorella protothecoides under nutritional,salinity,and luminosity stress conditions[J].Appl Microbiol Biotechnol,2013,97(3):1383-1393.
