产脂肪酶重组枯草芽胞杆菌的发酵优化
2014-05-04司冠儒徐美娟饶志明
司冠儒,徐美娟,饶志明
(江南大学 工业生物技术教育部重点实验室,无锡 214122)
脂 肪 酶 (lipase,EC3.1.1.3,triacylglycerol acylhydrolase),又称三酰基甘油水解酶。能催化水解三酰甘油生成脂肪酸、二酸甘油酯、单酸甘油酯以及甘油,其天然底物一般是不溶于水溶液的长链脂肪酸酰基酯。粘质沙雷氏菌脂肪酶以其独特的性质广泛应用于食品加工、生物医药和生物柴油等领域[1-2]。朱绮霞等[3-4]筛选到 1 株产脂肪酶的粘质沙雷氏菌,通过响应面法优化其发酵产酶条件,使其比酶活提高了10倍,达97.52 U/mL,并将其脂肪酶基因克隆至大肠杆菌进行表达,经发酵优化,重组菌比酶活达104 U/mL;王祎等[5]在大肠杆菌中表达了粘质沙雷氏菌脂肪酶,比酶活为8.6 U/mL;Ye等[6]将粘质沙雷氏菌脂肪酶基因克隆至毕赤酵母GS115中并成功表达,重组菌比酶活达66.2 U/mg。
粘质沙雷氏菌所产的胞外脂肪酶可应用于手性化合物的不对称合成[7-8]。此外,粘质沙雷氏菌脂肪酶对甲醇、乙醇等有机溶剂有较高的耐受性[4,9]。然而,粘质沙雷氏菌本身产灵菌红素,给后期酶的分离纯化造成了不便,同时粘质沙雷氏菌潜在的致病性限制了其在手性药物合成及生物柴油领域的应用。因此,将粘质沙雷氏菌脂肪酶基因克隆到安全宿主中进行高效表达一直是该领域研究的重要方向。
前期,笔者所在实验室成员构建了1株重组枯草芽胞杆菌B.subtilis 168/pMA5-lipA,实现了来源于粘质沙雷氏菌的脂肪酶在枯草芽胞杆菌属的首次成功表达。该菌株为组成型表达系统,无需添加诱导剂,节约了生产成本,且操作更为简便,具有广阔的工业应用前景。本文中笔者以该重组菌株为出发菌株,对其进行发酵优化,使其脂肪酶产量得到进一步提高。
1 材料与方法
1.1 菌株
粘质沙雷氏菌JNS3-9由笔者所在实验室成员筛选保藏;Bacillus subtilis/pMA5-lipA由笔者所在实验室成员构建保藏。
1.2 主要试剂与培养基
对硝基苯酚棕榈酸酯(p-NPP)购自阿法埃莎(上海)公司;其他试剂购自国药(上海)公司。
LB培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10,固体加20 g/L琼脂粉。
种子培养基(g/L):胰蛋白胨10,酵母提取物5,NaCl 10。
1.3 粗酶液的制备
将新鲜斜面上的菌种接种至种子培养基中培养过夜,按2%的接种量转接到发酵产酶培养基中。在培养温度为37℃、转速为160 r/min的摇床中发酵36 h,获得的发酵液在4℃、10 000 r/min离心5 min,收集上清液即为粗酶液。
1.4 脂肪酶活力的测定
酶活力测定采用p-NPP法,参照文献[10]进行。A液:16.5 mmol/L p-NPP的异丙醇溶液。B液:含有0.4%Triton X-100和0.1%阿拉伯树胶的50 mmol/L Tris-HCI缓冲液(pH 8.0)。测定时,将相应的A液与B液以1∶9(体积比)比例混合,取100 μL的粗酶液加入 900 μL上述混合液中,于40℃反应10 min。立即加1 mL无水乙醇终止反应,于410 nm下测定光吸收值。
酶活(U)单位定义:每分钟分解p-NPP产生1 μmol对硝基苯酚(黄色)所需的酶量定义为1个酶活单位。
1.5 B.subtilis/pMA5-lipA发酵产酶条件的优化
1.5.1 最适C源的选择
分别以葡萄糖、可溶性淀粉、麦芽糖、β-环糊精、蔗糖及α-乳糖为C源,初始发酵培养基为LB培养基。由于LB培养基中没有严格意义上的C源,可将备选C源作为唯一C源直接加入,其他组分保持不变。以最高酶活时的相对酶活定义为100%,通过计算所测酶活力值与该批次最高酶活力值的百分比为相对酶活来确定最适C源。
1.5.2 有机N源对菌体量及脂肪酶产量的影响
在最适C源的基础上,分别以酵母浸膏、牛肉浸膏、豆粕、大豆蛋白胨及玉米浆为有机N源,替换LB中的酵母膏和蛋白胨,其他组分不变。
1.5.3 无机N源对菌体量及脂肪酶产量的影响
在最适C源、有机N源基础上分别添加尿素、NH4Cl、(NH4)2SO4、(NH4)2HPO4及 NH4NO3等无机N源,其他组分不变。
1.5.4 无机盐对菌体量及脂肪酶产量的影响
在最适C源、有机N源及无机N源的基础上,分别以 KCl、NaNO3、KNO3、柠檬酸钠、CaCl2、MgSO4、CuSO4等无机盐替换LB培养基中的NaCl,其他组分保持不变。
1.5.5 正交试验设计优化培养基成分
在以上单因素的基础上,设计正交试验来优化发酵培养基成分,本研究采用“四因素三水平”方案,选取最佳C源、最佳有机N源、最佳无机N源、最佳无机盐为考察因素。
2 结果与讨论
2.1 种子生长曲线和最佳种龄的确定
种子的生长曲线如图1所示。由图1可知:菌株在5 h以后开始进入快速生长的对数期,并在20 h前后进入稳定期,随后菌体量开始缓慢下降,进入衰亡期。选择对数中后期的菌种最为合适,即可以确定生长13~15 h的种子为最佳种龄。

图1 重组菌在LB培养基中的生长曲线ig.1 Growth curve of recombinant strain in LB medium
2.2 最适C源的选择
C源对菌体量及脂肪酶产量的影响如图2所示。由图2可知:当在LB培养基中添加可溶性淀粉、麦芽糖和环糊精时,菌体量处于较高水平。其中以可溶性淀粉为C源时,菌体量最大;而菌体在添加葡萄糖、乳糖时生长不佳;添加蔗糖、乳糖较有利于菌体产脂肪酶,以蔗糖为C源时,脂肪酶产量最高并且菌体量也相对较高。综合考虑,以蔗糖为C源最有利于脂肪酶产量的提高。
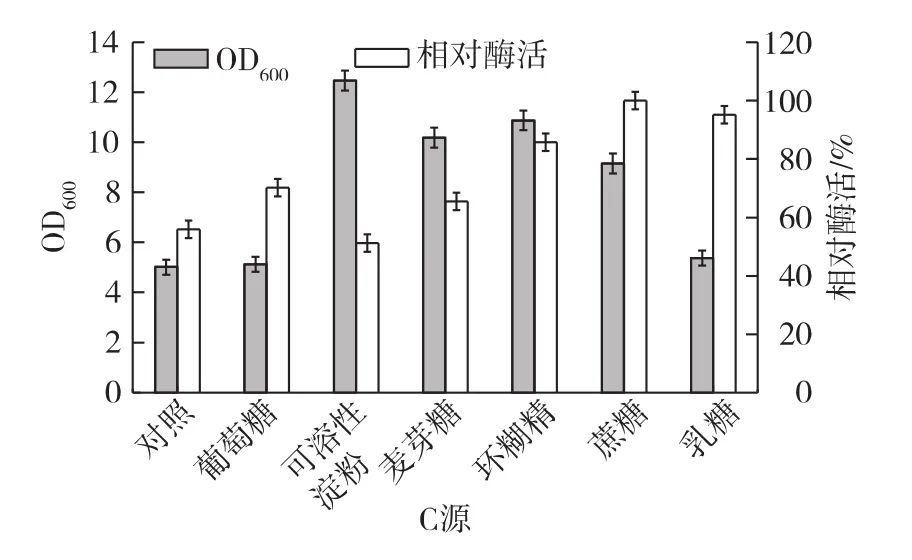
图2 C源对菌体生长和脂肪酶产量的影响Fig.2 Effects of various carbon sources on cell growth and lipase production
蔗糖浓度对菌体量及脂肪酶产量的影响如图3所示。由图3可知:重组芽胞杆菌的生长和脂肪酶产量在添加不同浓度蔗糖时是不同的。在蔗糖质量浓度为10~30 g/L时,菌体量和脂肪酶产量随蔗糖浓度升高呈上升趋势,随后开始下降;当蔗糖质量浓度为30 g/L时,菌体量与脂肪酶产量达到最高,最有利于提高重组菌脂肪酶的产量,在此条件下脂肪酶比酶活达50.1 U/mL。

图3 蔗糖对菌体生长和脂肪酶产量的影响Fig.3 Effects of sucrose concentration on cell growth and lipase production
2.3 有机N源对菌体量及脂肪酶产量的影响
有机N源对菌体量及脂肪酶产量的影响如图4所示。由图4可知:大豆蛋白胨和玉米浆为有机N源时,菌体生长情况较好且脂肪酶产量较高;以牛肉浸膏、豆粕为有机N源时则相对较低;而当以玉米浆为N源时,菌体量和脂肪酶产量最高,最有利于脂肪酶产量的提高。

图4 有机N源对菌体生长和脂肪酶产量的影响Fig.4 Effects of various organic nitrogen sources on cell growth and lipase production
玉米浆对菌体生长及脂肪酶产量的影响如图5所示。由图5可知:随着玉米浆浓度的升高,菌体量和脂肪酶产量皆呈现不断上升的趋势。当玉米浆质量浓度达到25 g/L时,达到最大值,随后开始下降。所以当以25 g/L的玉米浆为N源时,最有利于脂肪酶产量的提高,此时脂肪酶比酶活达61.5 U/mL。
2.4 无机N源对菌体量及脂肪酶产量的影响
无机N源对菌体量及脂肪酶产量的影响如图6所示。由图6可知:在添加不同无机N源的情况下,菌体量和脂肪酶产量差异较为明显,除(NH4)2HPO4外,辅助添加其他无机N源都促进菌体生长和脂肪酶酶活的提高。其中添加(NH4)2SO4的促进作用最为显著,所以当以(NH4)2SO4为无机N源时,最有利于脂肪酶产量的提高。

图5 玉米浆对菌体生长和脂肪酶产量的影响Fig.5 Effects of corn syrup concentration on cell growth and lipase production

图6 无机N源对菌体生长和脂肪酶产量的影响Fig.6 Effects of inorganic nitrogen on cell growth and lipase production

图7 (NH4)2SO4对菌体生长和脂肪酶产量的影响Fig.7 Effects of(NH4)2SO4concentration on cell growth and lipase production
(NH4)2SO4浓度对菌体量及脂肪酶产量的影响如图7所示。由图7可知:低浓度时菌体量和脂肪酶产量随(NH4)2SO4浓度升高而升高,高浓度的(NH4)2SO4不利于菌体量和脂肪酶产量的提升,当以1.5 g/L的(NH4)2SO4为无机N源时,最有利于脂肪酶产量的提高,此时脂肪酶比酶活达73.2 U/mL。
2.5 无机盐对菌体量及脂肪酶产量的影响
无机盐对菌体量及脂肪酶产量的影响如图8所示。由图8可知:当以CaCl2为无机盐时,比初始的NaCl提升约10%;而当以KCl为无机盐时,脂肪酶产量相比添加NaCl时降低了约10%,所以CaCl2最有利于脂肪酶产量的提高。

图8 无机盐对菌体生长和脂肪酶产量的影响Fig.8 Effects of various inorganic salts on cell growth and lipase production
CaCl2浓度对菌体量及脂肪酶产量的影响如图9所示。由图9可知:菌体量和脂肪酶产量均随CaCl2浓度的增大而增大;当CaCl2质量浓度为4 g/L时,最有利于脂肪酶产量的提高;当CaCl2质量浓度大于4 g/L时,菌体量和酶活反而下降。在CaCl2质量浓度为4 g/L时,脂肪酶比酶活达80.1 U/mL。

图9 CaCl2质量浓度对菌体生长和脂肪酶产量的影响Fig.9 Effects of CaCl2concentration on cell growth and lipase production
2.6 正交试验设计优化培养基成分
在上述单因素的基础上,设计正交试验来优化发酵培养基成分,采用“四因素三水平”方案,选取蔗糖、玉米浆、(NH4)2SO4、CaCl2为考察因素进行实验。具体的试验设计方案如表1所示。

表1 正交试验设计方案Table 1 Design of orthogonal experiment
正交试验结果及极差分析如表2和表3所示。极差值的大小表明该因素水平的改变对结果的影响大小,极差值越大,该因素对脂肪酶产量的影响越大。由表3极差值大小,各因素对脂肪酶产量的影响从大到小依次为:玉米浆、(NH4)2SO4、蔗糖、CaCl2。为了获得最高的产量,应选择的最优组合是A3B3C1D2,即蔗糖 35 g/L,玉米浆 27.5 g/L,(NH4)2SO41.25 g/L,CaCl24 g/L。采用此最优组合的发酵培养基培养菌体,然后测脂肪酶酶活,最终比酶活达94.7 U/mL。

表2 正交试验结果Table 2 Orthogonal experiment results

表3 正交试验结果极差分析Table 3 Range analysis of orthogonal experiment results
2.7 初始pH对菌体量及脂肪酶产量的影响
分别调节培养基初始 pH为5.0、6.0、7.0和8.0,考察初始pH对菌体量及脂肪酶产量的影响,结果如图10所示。由图10可以看出,不同初始pH对菌体量及脂肪酶的影响显著。pH为5.0时,菌体生长受到抑制,同时脂肪酶产量较低;pH为6.0~7.0时,菌体量及脂肪酶产量较高,其中pH为7.0时为最佳。
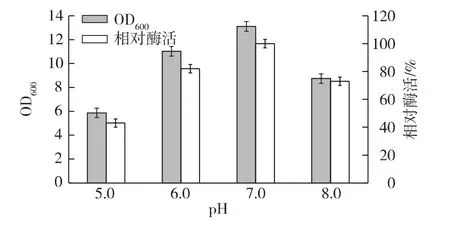
图10 初始pH对菌体生长和脂肪酶产量的影响Fig.10 Effects of initial pH on cell growth and lipase production
2.8 最佳接种量的选择
分别按1%、2%、3%、4%、5%和6%的接种量进行接种,培养36 h后测定生物量和脂肪酶产量,所得结果如图11所示。由图11可以看出,随着接种量的增加生物量和脂肪酶产量均有所增加,接种量为4%时达到最大值,随后生物量和脂肪酶产量随着接种量的增加逐步下降,因此可以确定4%的接种量最有利于提高生物量和脂肪酶产量。

图11 接种量对菌体生长和脂肪酶产量的影响Fig.11 Effects of inoculating concentrations on cell growth and lipase production
2.9 重组菌在最优发酵条件下的发酵曲线
在以上优化结果的基础上对B.subtilis 168/pMA5-lipA进行发酵培养,并在不同时间段取样测定菌体量及脂肪酶产量,所得结果如图12所示。

图12 B.subtilis 168/pMA5-lipA在最优培养条件下的发酵结果Fig.12 Fermentation results of B.subtilis 168/pMA5-lipA in optimal culture conditions
由图12可知:前期随着发酵的进行,菌体量呈不断上升趋势,并在33 h时达到最高值,在随后的一段平衡期开始缓慢下降;脂肪酶酶活的变化趋势与之相似,在33 h时达到最大值,约98.6 U/mL,约是优化前重组菌比酶活(33.24 U/mL)的3倍,优化后菌体OD600达14.3,约是优化前6.2的2.3倍,单位菌体量酶活约是优化前的1.3倍。可见优化后的发酵培养基显著提升了B.subtilis 168/pMA5-lipA的产脂肪酶能力。重组菌在30~35 h酶活较高,且较为稳定,相对于其他菌株脂肪酶发酵过程中常出现较高的峰值,随后急剧下降,重组菌具有较好的稳定产酶能力,更有利于工业化应用。
3 结论
在重组枯草芽胞杆菌B.subtilis 168/pMA5-lipA基础上,对其进行了一系列摇瓶水平上的发酵优化。确定了种子培养13~15 h为最佳种龄,最佳接种量为4%;通过单因素实验确定最佳种龄,C源、有机N源、无机N源、无机盐离子的种类及浓度,最优培养基成分为蔗糖 30 g/L、玉米浆 25 g/L、(NH4)2SO41.5 g/L和CaCl24 g/L;通过“四因素三水平”正交试验,得出最优培养基为蔗糖35 g/L,玉米浆27.5 g/L,(NH4)2SO41.25 g/L,CaCl24 g/L;最后确定了最佳初始pH为7.0。用此最优发酵培养基培养B.subtilis 168/pMA5-lipA,其脂肪酶产量可达98.6 U/mL发酵液,约是其优化前产量33.24 U/mL的3倍,为粘质沙雷氏菌脂肪酶的广泛应用奠定了基础。
[1] Jaeger K E,Ransac S,Dijkstra B,et al.Bacterial lipase[J].FEMS Microbial Rev,1994,15(1):29-63.
[2] Li X Y,Tetling S,Winkler U K,et al.Gene cloning,sequence analysis,purification and secretion by Escherichia coli of an extracellular lipase from Serratia marcescens[J].Appl Environ Microbial,1995,61:2674-2680.
[3] 朱绮霞,张搏,陆雁,等.产脂肪酶粘质沙雷氏菌发酵产酶条件的优化[J].生物技术,2009,19(5):61-65.
[4] 朱绮霞,陈英,张搏,等.粘质沙雷氏菌脂肪酶基因的克隆表达和酶学性质的研究[J].生物技术,2010,20(5):12-16.
[5] 王祎,赵健,范立强,等.重组粘质沙雷氏菌脂肪酶的可溶性表达及其性质研究[J].食品与药品,2010,12(3):77-81.
[6] Ye F,Fan L,Xu J,et al.Construction and expression of Serratia marcescens ECU1010 lipase(lipA)in Pichia pastoris[J].J Life Sci,2010,4(3):9-16.
[7] 龙章徳,许建和,潘江.黏质沙雷氏菌脂肪酶的固定化及催化拆分反式3-(4'-甲氧苯基)缩水甘油酸甲酯[J].催化学报,2007,28(2):175-179.
[8] Li G,Xu J H,Li X J,et al.Optimization of Serratia marcescens lipase production for enantioselective hydrolysis of 3-phenylglycidic acid ester[J].Microbial Biotechnol,2004,31:525-530.
[9] Zhao L L,Xu J H.Biochemical properties and potential application of an organic solvent-tolerant lipase from Serratia marcescens ECU1010[J].ProcessBiochem,2008,4(3):626-633.
[10] Tang L H,Xia L M.Purification and partial characterization of a lipasefrom BacilluscoagulanszJU318[J].ApplBiochem Biotechnol,2005,125(2):139-146.
