漆酶催化苯甲醇氧化制备苯甲醛
2014-05-04刘长根贾红华
刘长根,徐 飞,贾红华,周 华,韦 萍
(南京工业大学 生物与制药工程学院,南京 211800)
苯甲醛是一种重要的化工原料,广泛地应用于医药、农药、香料及染料等行业。生产苯甲醛的传统生产方法是采用苄叉二氯水解法[1]和甲苯氧化法[2]。其中,苄叉二氯水解法存在工艺流程长、产物分离困难、产品中含氯元素且排放出腐蚀性气体等不足,污染环境严重;甲苯氧化法是利用金属催化剂直接选择性氧化制备苯甲醛,虽然工艺过程简单,但产物产率较低。
漆酶在氧化反应中的应用研究较多,但主要偏重研究酚类、胺类和木质素类等[3-6]化合物的氧化,目前对醇类化合物的氧化研究较少,而且主要侧重于对氧化反应机制的研究[7-11],专门针对苯甲醇的氧化研究偏少,尤其是对反应底物浓度(一般底物反应浓度为20 mmol/L,偏低)、氢受体种类及反应溶剂等反应工艺参数优化的研究更未见报道。
为此,笔者以自制的高活性漆酶为催化剂,研究苯甲醇催化氧化制备苯甲醛,通过氧化反应条件的优化研究,为苯甲醛的高效绿色合成奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂
苯甲醇(分析纯),上海凌峰化学试剂有限公司;2,2-连氮-双(3-乙基苯并噻唑-6-磺酸)(ABTS)(98%),东京化成工业株式会社;2,2,6,6-四甲基哌啶-1-氧基(TEMPO)(98%),阿拉丁公司;无水1-羟基-苯并-三氮唑(HBT)(98%),上海晶纯试剂有限公司;紫脲酸(VLA)(97%),Fluka公司;其他试剂均为市售分析纯。
1.1.2 主要仪器
SP-6890型气相色谱仪(山东鲁南瑞虹化工仪器有限公司),HTZ-C-1台式冷冻恒温振荡器(太仓市实验设备厂),PHS-3C型pH计(上海雷磁仪器厂)。
1.2 实验方法
1.2.1 漆酶的发酵及提取方法
以笔者所在实验室筛选的白腐菌Coriolus versicolor ZHH为菌种,经摇瓶发酵培养后得到含酶发酵液,离心去除菌体等固形物,加入(NH4)2SO4、离心获得沉淀,经冷冻干燥获得漆酶干粉,4℃冰箱保存备用。
1.2.2 苯甲醇氧化反应方法
初始氧化反应条件:在25 mL的反应瓶中加入20 mmol/L苯甲醇溶液和40 U/mL漆酶,总反应体积为10 mL,30℃、通O20.5 h后密闭振荡反应24 h;反应结束后取样测定底物和产物浓度,计算反应转化率。
1.2.3 漆酶酶活的测定方法
以ABTS为底物,在420 nm条件下测定漆酶酶活,具体方法参照文献[12-13]。
1.2.4 底物与产物的检测方法
反应结束后转化液用二氯甲烷萃取3次,去除水相,含底物和产物的有机相直接利用气相色谱测定浓度。色谱柱为安捷伦DB-225毛细管色谱柱(30 m×0.32 mm ×0.25 um),具体分析方法参照文献[14]。
2 结果与讨论
2.1 介质体系对苯甲醇氧化反应的影响
2.1.1 介质体系的选择
漆酶的氧化还原电势较低,苯甲醇结构较稳定,必须借助电子传递介质能够完成反应。故在初始反应条件下,考察不同电子传递介质ABTS、HBT、VLA和TEMPO(10 mmol/L)对苯甲醇氧化反应的影响,结果见图1。
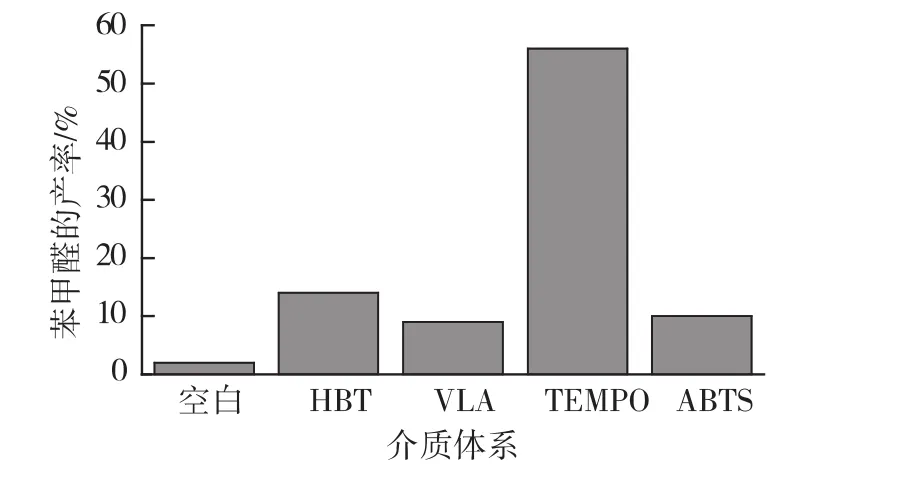
图1 介质体系对苯甲醛产率的影响ig.1 Effects of medium system of on yield of benzaldehyde
从图1可看出,介质TEMPO的加入对漆酶催化苯甲醇制备苯甲醛氧化反应的效率最高(58%),故以下实验均加入TEMPO作为氧化反应介质体系。
2.1.2 TEMPO的用量对苯甲醛产率的影响
考察TEMPO的用量对苯甲醛产率的影响,结果见图2。由图2可知:当TEMPO与苯甲醇的质量摩尔比为1∶4时,苯甲醛的产率最高,达到71%。
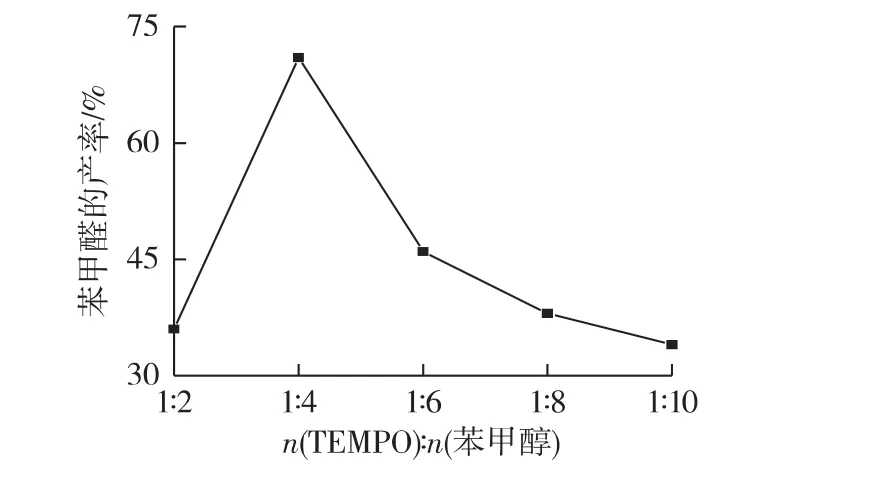
图2 TEMPO与苯甲醇的摩尔浓度比对苯甲醛产率的影响Fig.2 Effects of TEMPO and benzene methanol molar concentration ratio on yield of benzaldehyde
2.2 底物浓度对氧化反应的影响
目前,漆酶氧化醇类化合物的研究中底物浓度一般选择为20 mmol/L,较低的底物及产物浓度必将给工艺放大与应用带来诸多麻烦,因此提高底物的反应浓度对于苯甲醛的酶法制备具有积极意义。在反应体系中考察不同底物浓度(20、40、60、80和100 mmol/L),加入40 U/mL漆酶和上述浓度的TEMPO,30 ℃、通O20.5 h密闭振荡反应24 h,测定反应体系中苯甲醛的产率,结果见图3。
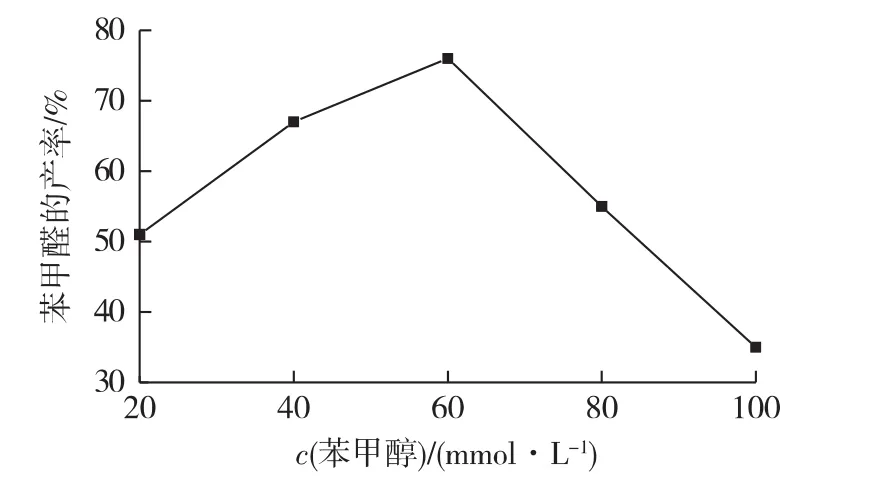
图3 苯甲醇浓度对苯甲醛产率的影响Fig.3 Effects of concentration of benzyl alcohol on yield of benzaldehyde
由图3可知:随着底物浓度的提高,氧化反应收率仍保持较高的水平,表明漆酶对高浓度底物有较好的耐受性,当底物苯甲醇的浓度为60 mmol/L,反应体系的苯甲醛产率最高,可达到76%。
2.3 漆酶用量对氧化反应的影响
为进一步提高氧化反应得率、降低漆酶用量,在上述优化实验基础上,在反应体系中采用不同漆酶用量(10、40、60、80、100 和 150 U/mL)进行氧化反应,测定苯甲醛的产率,结果见图4。
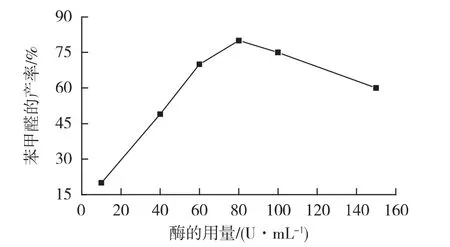
图4 漆酶用量对苯甲醛产率的影响Fig.4 Effects of concentration of laccase on yield of benzaldehyde
由图4可知:苯甲醛的产率并未随着漆酶用量的增加而增加,当反应体系中加入80 U/mL的漆酶时,苯甲醛的产率达到80%。
2.4 氢受体对氧化反应的影响
氢受体能够接受电子被还原,从而促进苯甲醇的氧化反应。在前面优化条件基础上,考察不同氢受体(丙酮、甲醛、戊二醛和乙醛)对苯甲醛产率的影响,结果见图5。由图5可知:丙酮作为氢受体效果最好。同时,考察不同丙酮浓度对苯甲醛产量的影响,结果见图6。由图6可知,当丙酮的加入量为60 mmol/L时,苯甲醛产率最高,达到89%。
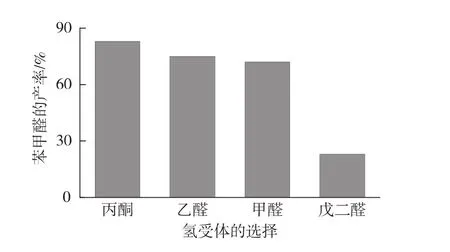
图5 氢受体对苯甲醛产率的影响Fig.5 Effects of hydrogen acceptor on yield of benzaldehyde
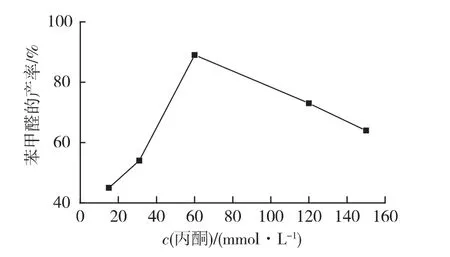
图6 丙酮浓度对苯甲醛产率的影响Fig.6 Effects of acetone concentration on yield of benzaldehyde
2.5 助溶剂对氧化反应的影响
由于产物苯甲醛不溶于水,反应体系中加入少量有机溶剂可以促进苯甲醛向有机相的转移,推动反应向产物方向进行,提高产物的转化得率。在上述优化实验条件基础上,考察不同有机溶剂(丁二酸二甲酯、环氧己烷、四氢呋喃、乙腈、乙酸乙酯和正丁酸,0.5 mol/L)对氧化反应的影响,结果见图7。由图7可知:助溶剂的加入对苯甲醛的收率提高没有促进作用,结合下游产物分离成本,故反应中不考虑添加助溶剂。
2.6 通氧方式对反应的影响
O2是氧化反应的必要因素,由于O2在反应溶液中溶解度较低,故不同的供氧方式影响氧化反应的得率。在上述优化实验的基础上,通O20.5 h后,再考察不同通氧方式(密封、敞开和连续通氧等)对氧化反应的影响,结果见图8。
由图8知:通O20.5 h后密闭反应时,苯甲醛的产率最高,达94%。敞开反应时,苯甲醛的产率最低。这可能是氧化反应需要一定量O2的参与,但过高的O2浓度对酶会产生中毒作用、导致反应率下降。
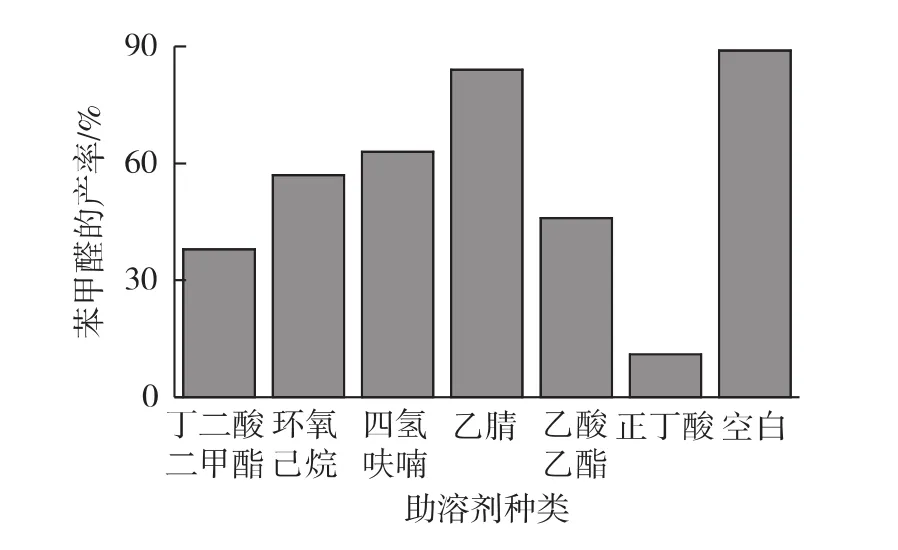
图7 助溶剂对苯甲醛产率的影响Fig.7 Effects of different solvent system on yield of benzaldehyde
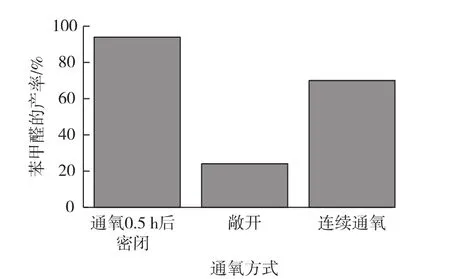
图8 供氧方式对苯甲醛产率的影响Fig.8 Effect of oxygen supply mode on yield of benzaldehyde
同时考察反应时间对苯甲醛产率的影响,发现反应36 h苯甲醛的最高产率为98%(图9)。
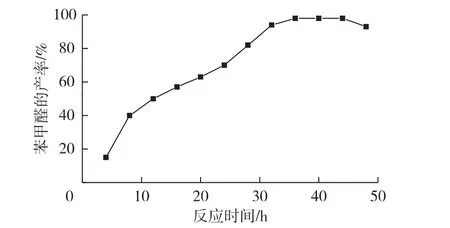
图9 反应时间对苯甲醛产率的影响ig.9 Effects of reaction time of on yield of benzaldehyde
3 结论
以自制的高活性漆酶为催化剂,开展了漆酶催化苯甲醇制备苯甲醛的合成工艺优化研究。经过优化得到的最佳工艺条件为以80 U/mL的漆酶为催化剂,在柠檬酸/柠檬酸钠反应体系中,以 TEPMO为介质体系(TEMPO与底物苯甲醇的最佳摩尔浓度比为1∶4)、60 mmol/L的丙酮为氢受体,60 mmol/L的苯甲醇在通O20.5 h后密闭反应36 h,最终苯甲醛的产率达98%,为酶法制备苯甲醛的工艺放大与应用奠定了良好基础。
[1] 柳艳修,宋华,王宝辉.甲苯直接氧化制苯甲醛研究进展[J].工业催化,2005,13(2):24-28.
[2] 葛欣,张惠良,范军.铈钼氧化物对甲苯气相选择氧化制苯甲醛的催化性能[J].催化学报,1998,19(1):42-46.
[3] Bettin F,Montanari Q,Calloni R,et al.Production of laccases in submerged process by Pleurotus sajor-caju PS-2001 in relation to carbon and organic nitrogen sources,antifoams and Tween 80[J].J Ind Microbiol Biotechnol,2009,36(1):1-9.
[4] Kim S,Kim D,Park J.Synthesis of 2,5-diaminoquinones by onepot copper-catalyzed aerobic oxidation of hydroquinones and addition reaction of amines[J].Adv Synth Catal,2009,351(16):2573-2578.
[5] Rodriguez E,Nuero O,Guillén F,et al.Degradation of phenolic and non-phenolic aromatic pollutants by four Pleurotus species:the role of laccase and versatile peroxidase[J].Soil Biol Biochem,2004,36(6):909-916.
[6] Kluczek-Turpeinen B,Tuomela M,Hatakka A,et al.Lignin degradation in a compost environment by the deuteromycete Paecilomyces inflatus[J].Appl Microbiol Biotechnol,2003,61(4):374-379.
[7] Barreca A M,Fabbrini M,Gali C,et al.Laccase/mediated oxidation of a lignin model for improved delignification procedures[J].J Mol Catal B:Enzymatic,2003,26(1/2):105-110.
[8] Arzola K G,Arevalo M C,Falcon M A.Catalytic efficiency of natural and synthetic compounds used as laccase-mediators in oxidising veratryl alcohol and akraftlignin,estimated by electrochemical analysis[J].Electrochim Acta,2009,54(9):2621-2629.
[9] Hong F,Jönsson L J,Lundquist K,et al.Oxidation capacity of laccases and peroxidasesasreflected in experimentswith methoxy-substituted benzyl alcohols[J]. Appl Biochem Biotechnol,2006,129(1/2/3):303-319.
[10] Liebminger S,Siebenhofer M,Guebitz G.Oxidation of glycerol by 2,2,6,6-tetramethylpiperidine-N-oxyl(TEMPO)in the presence of laccase[J].Bioresour Technol,2009,100(20):4541-4545.
[11] d'Acunzo F,Baiocco P,Fabbrini M,et al.A mechanistic survey of the oxidation of alcohols and ethers with the enzyme laccase and its mediation by TEMPO[J].Eur J Org Chem,2002,2002:4195-4201.
[12] 何为,詹怀宇,王习文,等.一种改进的漆酶酶活检测方法[J].华南理工大学学报:自然科学版,2003,31(12):46-57.
[13] 张鹏.以ABTS为底物测定漆酶活力的方法[J].印染助剂,2007,24(1):43-45.
[14] 谭平华,唐盛伟,刘长军,等,气相色谱法同时测定苯甲醛、苯甲醇和苯甲酸[J].天然气化工,2007,32(2):64-66.
