利用生物柴油副产物粗甘油生产二羟基丙酮
2014-05-04郑小娟陈万河靳魁奇刘宇鹏
郑小娟,孙 杨,陈万河,靳魁奇,潘 龙,刘宇鹏
(1.河南大学 生命科学学院 生物工程研究所,开封 475004;2.保定九孚生化有限公司,保定 071052)
二羟基丙酮(1,3-dihydroxyacetone,DHA)是一种简单的酮糖,化学性质活泼,是重要的医药原料、农药合成中间体、化妆品原料、饲料添加剂、食品保鲜剂、制革工业中皮革保护剂、功能性食品添加剂等,具有广泛的应用前景[1-4]。DHA 生产方法有化学法和微生物发酵法。与化学法相比,微生物发酵法反应条件温和、原料利用率高、产品纯度高、工艺简单、易于控制、环境友好,因此显得更有生命力。从20世纪70年代起,在德国、日本、美国、丹麦等国家,生物转化法甘油生产DHA在工业上得到大规模应用[5],国内DHA产业尚处于起步阶段。
近些年来,生物柴油作为清洁能源得到了大力发展[6],在生物柴油的生产过程中,每生产10 t生物柴油有大约1 t的甘油产生[7],这些粗甘油如果不经过严格的精制提纯就不能被重新利用。但纯化过程繁琐,成本极高。出于对环境和生态保护,利用生物柴油粗甘油生产一些高附加值的产品是发酵产业所努力的目标,到目前为止,已经有以生物柴油副产物粗甘油生产乙醇[8]、丙二醇[1]和丁二醇[9]等的报道。
由于国内大多数生物柴油企业生产原料主要是餐饮废油,从而导致副产物粗甘油纯度较低,利用其生产下游产品困难;而且粗甘油中含有大量金属离子及甲醇、游离脂肪酸等有毒物质[10],导致微生物生长受到抑制,不能直接被利用生产DHA。笔者利用本实验室成员筛选出的耐高浓度甘油、高转化能力的弗托氏葡糖杆菌(Gluconobacter frateurii)CGMCC5397[11],对餐饮废油为来源的生物柴油副产物粗甘油生产DHA生产工艺条件进行初步研究。
1 材料与方法
1.1 菌种
弗托氏葡糖杆菌(Gluconobacter frateurii),河南大学生物工程实验室自主筛选,中国普通微生物保藏中心保藏号:CGMCC5397。
1.2 生物柴油副产物粗甘油及其预处理
生物柴油(由餐饮废油制备)副产物粗甘油是由唐河金海生物技术有限公司提供。甘油质量分数为53%,各种离子含量(g/L):SO2-443.9、Zn2+2.848、Ca2+2.800、K+0.315、Fe2+1.730、Fe3+1.800、Cl-4.800、Na+49,pH 1.1。
预处理方法:5 mol/L NaOH调节pH为7,沉淀8 h,抽滤,滤液分别通过732阳离子交换树脂和D315阴离子交换树脂,流速为2 mL/min,稀释为10%甘油溶液待用。
1.3 培养基
一级种子培养基组成(%):甘油5.0、酵母浸粉1.5、KH2PO40.3,pH 6.0;二级种子培养基组成(%):甘油3.0、酵母浸粉 1.0、CaCO30.3,pH 6.0;发酵培养基组成(%):甘油10.0、酵母浸粉1.5、CaCO30.3,pH 6.0;121℃湿热灭菌20 min。
以上培养基配制均使用粗甘油配制,根据所使用粗甘油纯度,培养基中甘油浓度已经换算成纯甘油含量(下同)。
1.4 培养方法
摇瓶发酵:取冷冻管保藏菌株接于装液量为30 mL一级种子培养基的250 mL三角瓶,30℃、220 r/min摇床培养24 h,5%接种量接二级种子,同上条件培养9 h,接装液量为30 mL发酵培养瓶,培养48 h。
发酵罐分批发酵:分批发酵是在7 L发酵罐(BioFlo 4000,NBS)中,装液量 4 L,30 ℃条件下进行,通气量为1.2 vvm(vvm表示每分钟通气量与罐体实际料液体积的比值),10 mol/L NaOH控制pH 5.5,发酵培养基组分同摇瓶发酵培养基。
UAV+RFID实现在制品的信息采集,其主要工作任务为RFID读写器识别并收集在制品的信息。首先对于在制品存放区域来说,在制品存放区域既是需要被识别的区域也是障碍区域,故UAV在飞行过程中遇到在制品存放区域时也需要满足式(2)。其次,在UAV的飞行路径中要确保存在节点Li(xi,yi,zi)与在制品存放区域的距离小于RFID读写器的读取距离。同时对在制品存放区域按照UAV半径进行膨胀,UAV按质点处理,则RFID读写器识别的适应度函数
发酵罐补料分批发酵:初始总甘油质量浓度为50 g/L,当甘油质量浓度低于20 g/L时,500 g/L灭菌甘油加到罐中,以保持甘油浓度。
1.5 分析方法
DHA检测通过HPLC法测定,条件:Bio-Rad公司Aminex HPX-87H色谱柱(300 mm×7.8 mm,9 μm);UV检测器(检测波长270 nm);流动相:8 mmol/L H2SO4;柱温50℃;流速0.5 mL/min;进样量 20 μL。
甘油检测方法:示差折光检测器,HPLC条件与DHA检测条件相同。
菌体量测定方法:取1 mL发酵液用2%HCl稀释10倍,振荡混匀,以蒸馏水为对照在波长560 nm下测其吸光度。
电导率测定方法:使用杭州奥立龙TDS.电导笔测定。
DHA转化率 =ρ(DHA)/ρ(消耗的甘油)(1)
Zn2+测定采用火焰原子吸收光谱法测定,AA-6300F型原子吸收光谱仪(日本岛津公司),P-800S型空心阴极灯(澳大利亚Photron公司)。
2 结果与讨论
2.1 不同离子对弗托氏葡糖杆菌转化生产DHA的影响
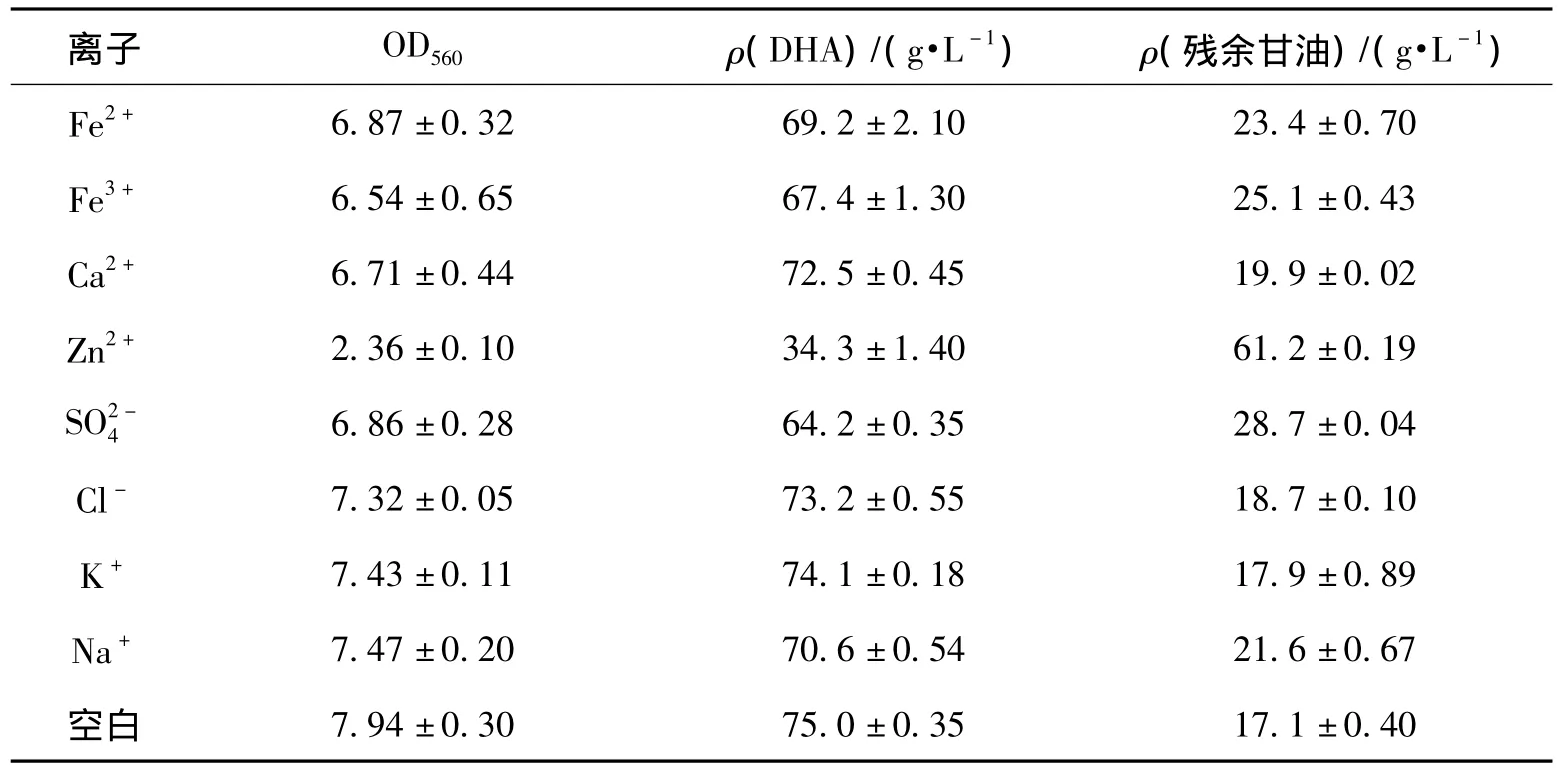
表1 不同离子对细胞生长和生产DHA的影响Table 1 Effects of different ions on cell growth and production of DHA
由表1可知:在含有Zn2+的发酵液中,OD560为2.36,DHA产量34.3 g/L,大大低于其他实验项,由此可知Zn2+可严重抑制G.frateurii CGMCC5397菌体生长和转化活性,Fe2+、Fe3+、Ca2+和SO2-4对此也有一定的影响,而Cl-、K+和Na+对发酵几乎没有影响。
为了研究不同浓度的Zn2+对发酵的影响,考察不同浓度Zn2+对发酵生产DHA的影响,结果如图1所示。由图1可知:当Zn2+质量浓度小于0.05 g/L时,随着离子浓度的增加,菌体量和DHA产量都随着Zn2+浓度的增加而增加,当Zn2+质量浓度大于0.1 g/L时,抑制作用明显增加,DHA产量迅速下降。随着Zn2+质量浓度继续增加,超过1 g/L时,转化几乎受到完全抑制。
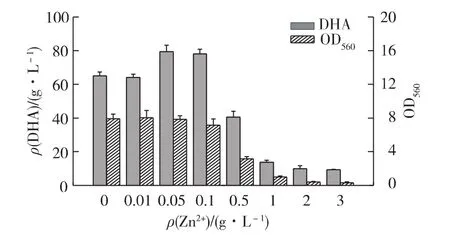
图1 Zn2+质量浓度对发酵的影响Fig.1 Effects of different Zn2+concentrations on DHA fermentation
2.2 粗甘油预处理对发酵生产DHA的影响
为了除去粗甘油中影响发酵生产DHA的杂质,特别是Zn2+,笔者选取了一些化学和物理除杂方法来进行。初始甘油的质量浓度为530 g/L,由于黏度过大不利于处理,加入一倍体积蒸馏水稀释,通过调节pH使Fe2+、Fe3+及一些酸性蛋白、杂质充分沉淀,抽滤除去沉淀物,通过离子交换树脂除去其他一些离子及可溶性蛋白。每步处理后,取此步处理后甘油作为C源配制发酵培养基,摇瓶发酵后测DHA,结果如表2所示。结果中每个值均用3次试验的平均值±标准差表示。
由表2可知:未处理的粗甘油不能生产DHA,随着不同的处理,电导率不断降低,DHA产量随着杂质的减少而增加,经过732阳离子交换树脂处理后,电导率降低到3 278 μS/cm,降低了97%,Zn2+质量浓度也由2 848 mg/L降到21 mg/L,经过处理后,甘油收率为88.1%,处理后DHA产量从0提高到74.6 g/L。
2.3 初始粗甘油浓度的影响
图2考察了不同初始浓度粗甘油对菌体转化生产DHA及菌体生长的影响。由图2可知:当甘油质量浓度为20 g/L时,OD560最大为8.4,但由于甘油浓度过低,转化生成DHA浓度很低,随着甘油浓度不断增加,DHA产量不断变大,而菌体量趋于平衡;当甘油质量浓度为100 g/L时,DHA达到最大质量浓度(71.36 g/L)。随着甘油浓度不断增加,由于高浓度底物甘油及金属离子的浓度的增大,菌体生长受到抑制,菌体量不断降低,DHA产量也不断降低。

图2 甘油质量浓度对发酵生产DHA的影响Fig.2 Effects of different glycerol concentrations on DHA fermentation
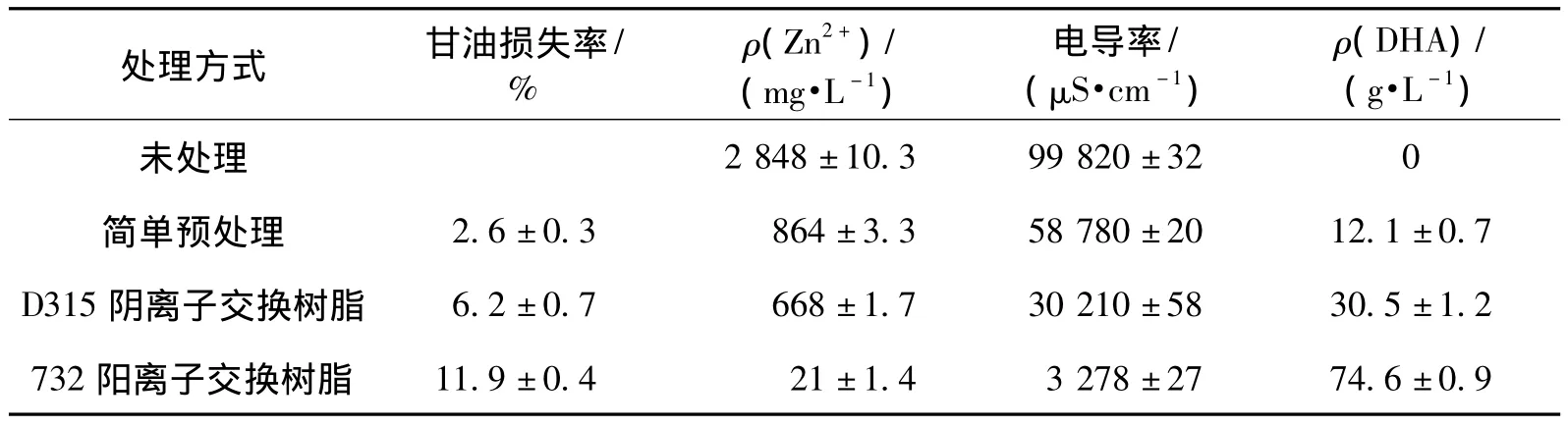
表2 粗甘油预处理对DHA发酵的影响Table 2 DHA production from pretreatment biodiesel byproduct glycerol
2.4 预处理的粗甘油分批发酵
在摇瓶发酵的基础上,进行处理后生物柴油副产品甘油在7 L发酵罐中分批发酵实验。初始甘油质量浓度为100 g/L,30℃下,通气量为2 vvm,发酵48 h,结果如图3所示。图3结果显示,用生物柴油副产品甘油进行分批发酵时,菌体在前8 h迅速增长,在32 h时达到最大,DHA浓度的增长延迟于细胞的生长,在发酵结束时DHA质量浓度为74.6 g/L。
2.5 处理后粗甘油补料分批发酵
在分批发酵的过程中,底物的抑制作用是影响弗托氏葡糖杆菌转化生产DHA的主要因素(图4),因此在发酵过程采取补料分批发酵,即初始底物浓度较低,一段时间后加入一定量底物,使底物一直保持在一个相对较低的浓度,结果如图4所示。由图4可知:菌体能快速生长,并且稳定期得到延长,底物抑制作用降低,转化效率提高,经过32 h,OD560达到稳定8.37,发酵结束后DHA产量为89.5 g/L,比分批发酵提高20.0%。生产强度为1.86 g/(L·h),甘油转化率为90.1%。
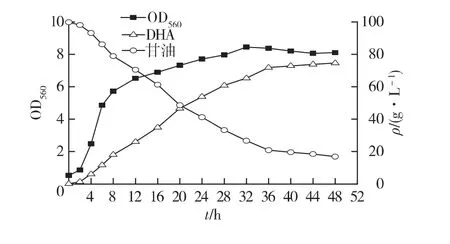
图3 生物柴油甘油7 L发酵罐分批发酵生产DHAig.3 Time courses of cell growth and production of DHA in 7-L stirred bioreactors with pretreated glycerol
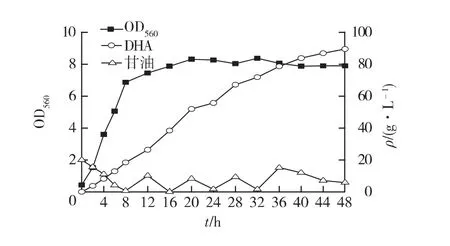
图4 生物柴油副产品甘油补料分批发酵生产DHAFig.4 Production of DHA in fed batch fermentation with crude glycerol
3 结论
通过对生物柴油副产物粗甘油性质的研究发现,粗甘油中的Fe2+、Fe3+、SO2-4及Zn2+对菌体的生及转化长有一定的抑制作用,尤其是Zn2+对菌体的生长及转化抑制非常明显,不适合进行生产DHA。通过调节pH、沉淀、过滤、过柱等处理后,生物柴油副产物粗甘油可以用于微生物转化法生产DHA。在7 L发酵罐中进行补料分批发酵48 h,DHA产量达到89.5 g/L。
随着能源危机的加剧,新能源的开发利用越来越得到重视,而对新能源副产品的利用也亟须得到解决,本文通过实验初步证明了利用生物柴油副产物粗甘油生产DHA的可行性,为今后的工业化大生产提供必要的基础数据。
[1] Metsoviti M,Paraskevaidik,Koutinas A,et al.Production of 1,3-propanediol,2,3-butanediol and ethanol by a newly isolated Klebsiella oxytoca strain growing on biodiesel-derived glycerol based media[J].ProcessBiochemistry,2012,47(12):1872-1882.
[2] Brown D A.Skin pigmentation enhancers[J].Journal of Photochemistry and Photobiology B:Biology,2001,63(1):148-161.
[3] Levy S B.Dihydroxyacetone-containing sunless or self-tanning lotions[J].Journal of the American Academy of Dermatology,1992,27(6):989-993.
[4] Nguyen B C,Kochevar I.Factors influencing sunless tanning with dihydroxyacetone[J].British Journal of Dermatology,2003,149(2):332-340.
[5] 李尧.微生物发酵生产二羟基丙酮的应用研究进展[J].四川食品与发酵,2007,139(5):20-23.
[6] 陈英明,陆继东,肖波,等.生物柴油原料资源利用与开发[J].能源工程,2007,1:33-37.
[7] Johnson D T,Taconi K A.The glycerin glut:options for the value added conversion of crude glycerol resulting from biodiesel production[J].Environmental Progress,2007,26(4):338-348.
[8] Oh B R,Seo J W,Heo S Y,et al.Efficient production of ethanol from crude glycerol by a Klebsiella pneumoniae mutant strain[J].Bioresource Technology,2011,102(4):3918-3922.
[9] 张育川.二羟丙酮 (DHA)[J].精细与专用化学品,2003,22:21.
[10] 罗敏健,叶活动,罗丹明,等.生物柴油生产过程中粗甘油的预处理[J].广东化工,2012,9(5):67-68.
[11] 刘宇鹏,陈万河,王磊,等.一种微生物发酵生产二羟基丙酮的菌种 HD924 和方法:中国,20110388519[P].2012-09-28.
