小干扰RNA长期作用乙型肝炎病毒转基因小鼠对机体免疫系统的影响
2014-05-04张卫云石玉玲孙朝晖任广立张蓉唐荣芝
张卫云,石玉玲,孙朝晖,任广立,张蓉 ,唐荣芝
广州军区 广州总医院 a.检验科;b.儿科;广东 广州 510010
据世界卫生组织报道,全球约20亿人曾感染过乙型肝炎病毒(hepatitis B virus,HBV),其中约4亿人为慢性感染者,每年有超过100万人死于HBV感染相关疾病。中国是HBV感染的高发地区,乙肝表面抗原携带者占全国人口的10%~15%。目前,针对慢性乙肝的抗病毒治疗主要采用重组干扰素和以拉米夫定和阿德福韦为代表的核苷类似物,但迄今其治疗效果不能让人满意,并伴有严重的副作用,停药后的反弹和耐药株的出现仍然是亟待解决的难题。自RNA干扰(RNA interference,RNAi)技术发现以来,作为基因治疗手段之一的RNAi已被证实是非常有开发前景的HBV治疗手段之一[1-2]。RNAi是保守的进化机制,有利于对抗外来基因的入侵如病毒和转座子等,是基因水平的抗病毒免疫机制。而小干扰RNA(small interfering RNA,siRNA)似乎对已存在的HBV共价闭合环状DNA(covalently closed cir⁃cular DNA,cccDNA)没有作用,彻底清除HBV尚有一定的困难。因此,从增强机体免疫应答的角度,探讨siRNA长期作用HBV转基因小鼠的机体免疫应答状况是非常必要的。
1 材料和方法
1.1 材料
HBV全基因转基因小鼠购自解放军第458医院全军传染病中心;正常BALB/c小鼠来自我院动物实验室,于实验室相对清洁环境饲养,体重(20±2)g,8~10周龄,雌雄分笼,稳定2周后进行实验。实验设立特异性siRNA组(pSilencer4.1/C2)、PBS对照组和正常BALB/c小鼠组,每组10只小鼠。
根据既往研究[3-5],选择pSilencer4.1/C2载体(本单位构建并保存)转染HBV转基因小鼠。
免疫球蛋白检测采用德国SIEMENS公司生产的BNⅡ特种蛋白分析仪及配套试剂;细胞因子试剂盒由上海研吉生化科技有限公司提供,采用芬兰Denley Drogon公司的Wellscan mk2酶标仪分析;CD4+和CD8+T淋巴细胞检测采用美国BD公司生产的BD FACS Calibur流式分析仪及配套试剂。
1.2 方法
参照文献[6-7],用高压水尾静脉注射法将siRNA表达载体按5 mg/kg给药,按小鼠体重的8%注入,均以 PBS(1.5~2.0 mL)稀释,10 s左右完成注射。注射后1、3、6、9和12个月通过小鼠内眦静脉采血,采用免疫散射比浊法测定小鼠血清中的IgG、IgA和IgM,ELISA法测定IL-2、IL-4、IL-6和IFN-γ,流式细胞术检测小鼠外周血中的CD4+和CD8+T淋巴细胞。
1.3 统计学方法
用SPSS 17.0统计分析软件对数据进行统计学分析,用t检验做差异的显著性分析,以P<0.05为差异显著,有统计学意义。
2 结果
2.1 长期siRNA治疗后转基因小鼠IgG、IgA和IgM水平的变化
用散射免疫比浊法检测了3组小鼠的IgG、IgA和IgM水平。从图1可以看出,随着siRNA作用时间的延长,pSilencer4.1-C2组小鼠IgG、IgA、IgM的表达水平均显著增加,至第9个月时几乎接近于正常BALB/c小鼠组水平,与PBS组相比差异显著(P<0.05),而PBS组免疫球蛋白水平基本无改变。
2.2 长期siRNA治疗后转基因小鼠细胞因子表达水平的变化
用ELISA方法检测了3组小鼠血清中相关细胞因子的水平。随着siRNA作用时间的延长,pSilenc⁃er4.1-C2组小鼠的IL-2、IL-4、IL-6和IFN-γ的表达有上调趋势,水平显著增加,至第12个月时几乎接近于正常BALB/c小鼠组水平,与PBS组相比差异显著(P<0.05),而PBS组细胞因子水平基本无改变。见图2。
2.3 长期siRNA治疗后转基因小鼠外周血中CD4+和CD8+T淋巴细胞的水平变化
为了解细胞免疫水平的变化,利用流式细胞术检测了小鼠外周血中CD4+和CD8+T淋巴细胞的水平,并计算CD4+/CD8+T淋巴细胞的比值。pSilenc⁃er4.1-C2组在特异性siRNA长期治疗下,转基因小鼠CD4+和CD8+T淋巴细胞水平均有上升趋势,与PBS组相比有显著性差异(P<0.05),治疗后第9个月,CD4+和CD8+T淋巴细胞的水平接近正常BALB/c小鼠组,CD4+/CD8+T淋巴细胞的比值更接近于正常BALB/c小鼠组,而PBS组基本无改变。见图3。
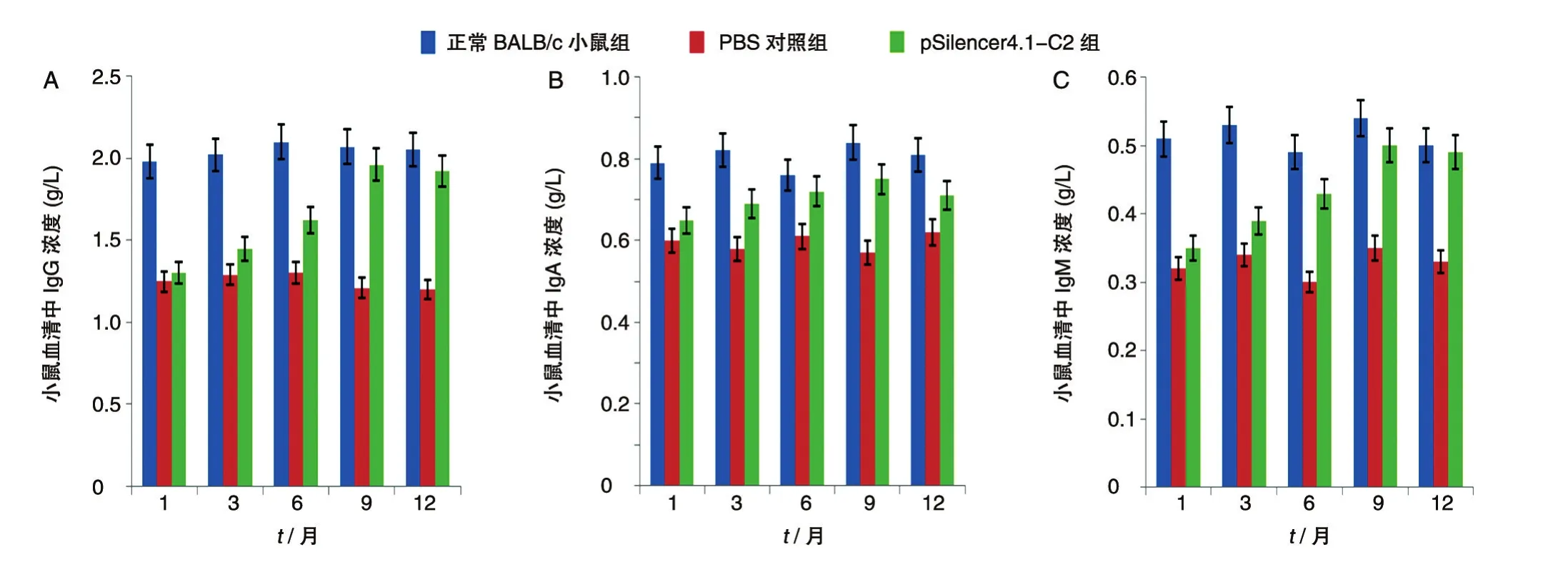
图1 长期siRNA治疗后不同时间点转基因小鼠血清中IgG(A)、IgA(B)、IgM(C)水平的变化

图2 长期siRNA治疗后不同时间点转基因小鼠血清中IL-2(A)、IL-4(B)、IL-6(C)、IFN-γ(D)水平的变化
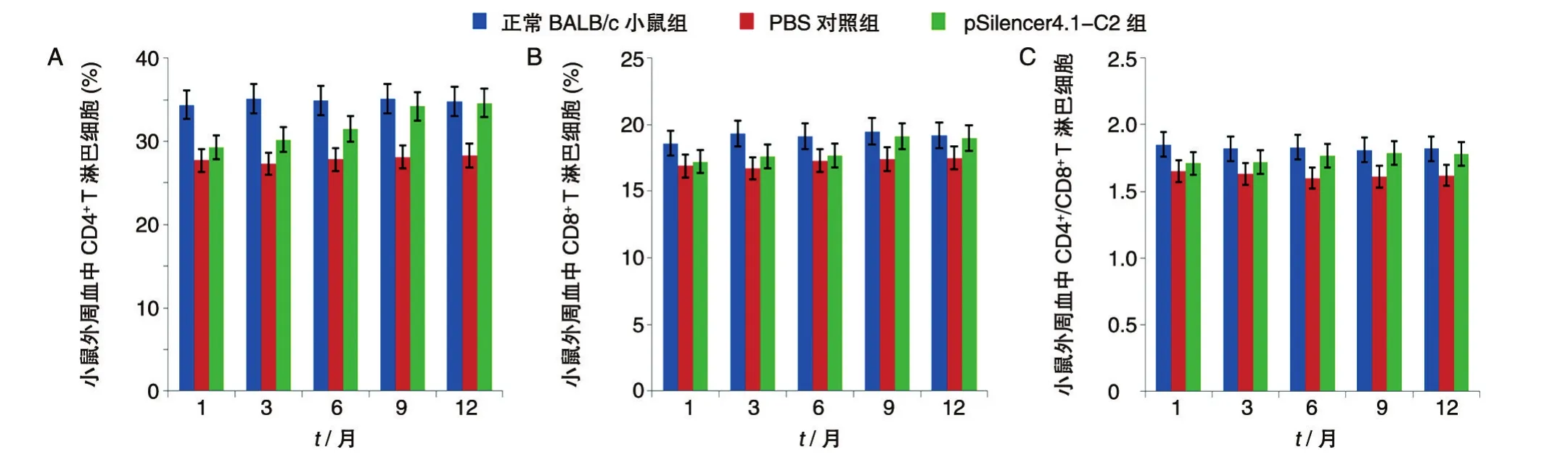
图3 长期siRNA治疗后不同时间点转基因小鼠外周血CD4+(A)、CD8+(B)T淋巴细胞水平的变化及CD4+/CD8+T淋巴细胞比值(C)
3 讨论
通常在机体免疫状态好的情况下,急性HBV感染多容易被清除。但是当机体免疫功能低下时,不能产生有效的针对HBV的特异性细胞毒T淋巴细胞反应(CTL),从而不能有效地彻底清除HBV。病毒产生针对机体先天免疫的逃逸策略是HBV感染慢性化、持续化的主要原因之一[8-9]。实验表明HBV感染可导致机体先天免疫降低,而特异性siRNA长期治疗后细胞免疫和体液免疫水平均有上调,与PBS组相比差别具有显著意义,而且在特异性siRNA长期作用下机体免疫功能接近正常BALB/c小鼠组,HBV转基因小鼠通过提高血清中IL-2、IL-4、IL-6、IFN-γ、IgG、IgA、IgM和外周血CD4+和CD8+T淋巴细胞水平来调节机体细胞免疫和体液免疫。
免疫球蛋白是具有抗体活性的动物蛋白,主要存在于血浆中,也见于其他体液、组织和一些分泌液中,是机体体液免疫的物质基础。在免疫系统中,免疫球蛋白参与体液免疫应答反应中的免疫特异性结合、与补体的结合及免疫调节。我们选用IgG、IgA、IgM进行分析,结果表明,与PBS组相比,pSilenc⁃er4.1-C2组的3种免疫球蛋白水平均显著增加,至第9个月时几乎接近于正常BALB/c小鼠水平,差异显著,说明特异性siRNA长期作用下可提高机体免疫球蛋白含量,从而增加机体的体液免疫反应。
白细胞介素是在白细胞或免疫细胞间相互作用的淋巴因子,在传递信息,激活与调节免疫细胞,介导T、B细胞活化、增殖与分化,以及炎症反应中起重要作用。IL-2主要由活化的CD4+和CD8+T细胞产生,是具有广泛生物活性的细胞因子,对T细胞的激活及生长有作用,是调控免疫应答的重要因子,也参与抗体反应、造血和肿瘤监视。IL-4是一种多功能细胞因子,主要由Th2细胞、肥大细胞及嗜碱性粒细胞产生,具有促进B细胞增殖、分化,诱导IgG1和IgE产生,促进Th0细胞向Th2细胞分化等作用。IL-6由Th2细胞分泌,它可诱导B细胞分化并产生免疫球蛋白,具有促进T细胞增殖生长、促进骨髓造血干细胞增殖、增强血细胞分化、抗瘤效应等。IFN-γ是一类分泌性蛋白,具有广谱抗病毒、抗肿瘤和免疫调节功能,是Th1细胞分泌的特征性细胞因子,具有促进Th1细胞分化、上调Th1型免疫反应对病毒抑制与清除的作用。在乙肝病毒的清除过程中,机体主要通过IFN-γ介导非溶细胞途径清除病毒[10]。IL-2和IFN-γ由Th1细胞分泌,通过促进CTL、NK细胞及巨噬细胞活化和增殖,介导细胞毒效应,在抗胞内病原体感染中发挥重要作用。IL-4和IL-6是Th2细胞分泌,其主要功能在于刺激B细胞增殖,参与体液免疫。当机体处于正常状态时,Th1/Th2型细胞因子相互制约,处于动态平衡,维持正常的细胞免疫和体液免疫功能,任何一方的增多或减少都会使正常免疫调节失去平衡而引起免疫功能紊乱[11]。
T淋巴细胞亚群是参与机体免疫防御的重要细胞,CD4+和CD8+T淋巴细胞在机体细胞免疫中具有非常重要的作用。CD4+T淋巴细胞具有调节免疫反应活性、辅助B细胞产生抗体、分泌细胞因子的作用;而CD8+T淋巴细胞有免疫抑制和细胞毒性的作用。此2类细胞所占比例在一定程度上可以揭示机体的免疫状态。在正常情况下,CD4+/CD8+T细胞比值应在一定范围内并处于一种平衡状态。实验结果表明,特异性siRNA长期作用下可使HBV转基因小鼠机体细胞免疫水平上调,外周血中的CD4+和CD8+T淋巴细胞增加,CD4+/CD8+T细胞比值升高,表现出一定的正向免疫调节作用,有利于机体抗病毒、抗肿瘤、抵抗宫内感染。
总之,慢性HBV感染由于持续存在的HBV cccDNA,单靠RNAi目前很难彻底清除病毒。因此,利用特异性siRNA长期作用机体,探讨机体免疫反应,可为以后免疫疫苗提供应用时机。
[1] Konishi M,Wu C H,Wu G Y.Inhibition of HBV replication by siRNA in a stable HBV-producing cell line[J].Hepatolo⁃gy,2003,38(4):842-850.
[2] Carmona S,Jorgensen M R,Kolli S,et al.Controlling HBV replication in vivo by intravenous administration of triggered PEGylated siRNA-nanoparticles[J].Mol Pharm,2009,6(3):706-717.
[3] Ren G L,Bai X F,Zhang Y,et al.Stable inhibition of hepa⁃titis B virus expression and replication by expressed siRNA[J].Biochem Biophys Res Commun,2005,335(4):1051-1059.
[4] Ren G L,Fang Y,Ma H H,et al:The short hairpin RNA driven by polymeraseⅡ suppresses both wild-type and lamivu⁃dine-resistant hepatitis B virus strains[J].Antivir Ther,2007,12(6):865-876.
[5] 任广立,方颖,张卫云,等.小干扰RNA抑制HepG2.2.15细胞中乙型肝炎病毒复制与表达[J].实用儿科临床杂志,2008,23(22):1750-1753.
[6] Liu F,Song Y,Liu D.Hydrodynamics-based transfection in animals by systemic administration of plasmid DNA[J].Gene Ther,1999,6(7):1258-1266.
[7] Yang P L,Althage A,Chung J,et al.Hydrodynamic injec⁃tion of viral DNA:A mousemodel of acute hepatitisB virus in⁃fection[J].Proc Natl Acad Sci USA,2002,99(21):13825-13830.
[8] Revill P,Yuan Z.New insights into how HBV manipulates the innate immune response to establish acute and persistent infection[J].Antivir Ther,2013,18(1):1-15.
[9] Zheng B J,Zhou J,Qu D,et al.Selective functional deficit in dendritic cell-T cell interaction is a crucial mechanism in chronic hepatitis B virus infection[J].J Viral Hepat,2004,11(3):217-224.
[10]Wieland S F,Eustaquio A,Whitten-Bauer C,et al.Interfer⁃on prevents formation of replication-competent hepatitis B vi⁃rusRNA-containing nucleocapsids[J].Proc NatlAcad Sci USA,2005,102(28):9931-9917.
[11]赵武述.免疫平衡的研究及其临床意义[M].北京:科学出版社,2005:127-137.
