海泡石吸附固定化猪胰脂肪酶
2014-05-04胡集铖韩萍芳
王 欢,胡集铖,李 亚,韩萍芳
(1.南京工业大学 生物与制药工程学院,南京 211800;2.上海市尚德实验学校,上海 201315)
作为生物催化剂,酶在工业、医药、农业和食品等各个领域有着广泛的应用[1]。在资源、能源短缺和环境不断恶化的今天,酶促转化已被提到相当重要的战略高度[2]。但是,游离酶在实际使用过程中对环境十分敏感,同时很难从反应体系中被分离回收和重复利用,这些缺点是酶促反应产业化的技术瓶颈[3]。为了克服这些问题,在20世纪60年代,酶固定化技术应运而生且快速发展起来。
随着对酶固定化技术研究的深入,探索高效廉价的载体引起了人们的重视。海泡石具有截面积为0.36 nm×1.06 nm的管状贯穿通道及高达900 m2/g的理论表面积[4]。在通道和孔洞中可以吸附大量的水或极性物质,包括低极性物质,因此,海泡石具有很强的吸附能力[5]。由于海泡石具有以上这些特点,使之具备作催化剂载体的良好条件[6]。
脂肪酶(lipase,E C 3.1.1.3,甘油酯水解酶)是一类特殊的酯键水解酶,能分解生物产生各种天然油脂,主要水解由甘油和C12原子以上的长链脂肪酸形成的甘油三酯。其重要特征是在异相系统(油-水)界面上水解特殊酯(脂肪酸甘油酯)类作为重要的工业用酶被广泛应用于食品、制革、饲料洗涤和油脂化工等工业领域[7-8]。
笔者以海泡石为载体固定化猪胰脂肪酶(PPL),并考察固定化酶的最适条件及稳定性、最适pH等理化性质,以期为进一步的应用奠定基础。
1 材料和方法
1.1 材料
猪胰脂肪酶(porcine pancreas lipase,PPL),南京奥多福尼生物技术有限责任公司;海泡石(47 μm,预处理);Pluronic P123(EO20-PO70-EO20)、柠檬酸、三乙酸甘油酯、磷酸(分析纯),国药集团化学试剂有限公司;NaHCO3、NaH2PO4、Na2HPO4和 NaOH(分析纯),广东汕头西陇化工厂。
1.2 分析测试仪器
DSHZ-300A型恒温振荡器(太仓市试验设备厂),85-1型磁力搅拌器(金坛医疗设备厂),PHS-3C型pH测定仪(上海盛磁仪器有限公司),GL-21M型离心机(上海离心机械研究所),Nexus 670傅里叶红外光谱仪(FT-IR)(美国Nicolet公司),JEM-2010UHR高分辨透射电镜(SEM)仪(日本电子光学公司)。
1.3 海泡石的预处理
取原矿样放入烧杯中,加入适量蒸馏水(体积比1∶5),磁力搅拌10 min后,水化过夜。倾去上层悬浮物,取中间层悬浊液。下层沉淀物按上述方法再处理几次,把得到的所有悬浊液抽滤,所得固体在105 ℃下烘干[9]。
1.4 脂肪酶的固定化
取2 mg/mL的酶溶液40 mL、海泡石80 mg,加入100 mL具塞三角烧瓶中,混合液在25℃、110 r/min的条件下,进行酶固定化。混合液反应到一定时间后,取出烧瓶在10℃、3 000 r/min条件下离心10 min。上清液用考马斯亮蓝蛋白测试方法测定其蛋白含量,上清液中减少的蛋白量即是海泡石材料上所固定的酶蛋白量,固定化的酶蛋白与载体量的比例可以由Pa=(ρi-ρf)V/m计算得出,式中:Pa为单位载体上固定的酶蛋白的量(mg/g),ρi和ρf为反应前后酶溶液的质量浓度(g/L),V为反应液体积(mL),m为使用的载体质量(g)。
1.5 酶活的测定
在100 mL的三角瓶中加入2 g三乙酸甘油酯、50 mL去离子水、10 mL pH为7.0的缓冲液,磁力搅拌器搅拌10 min制备成乳浊液。当溶液pH稳定后记录初始pH值,并加入游离脂肪酶或固定化的脂肪酶。反应30 min,用0.02 mol/L的NaOH溶液滴定,使pH回到初始值,记录消耗的NaOH的量。
一个酶活(U)定义:在40℃的条件下,每分钟内催化1 μmol底物转化为产物所需要的酶量。
2 结果与讨论
2.1 脂肪酶的固定化
2.1.1 固载时间对酶固定化的影响
在磷酸缓冲液(PBS)pH 7.0的条件下,考察固载时间对脂肪酶固定化的影响,结果见图1。由图1可知:脂肪酶在海泡石的最佳固定化时间为4 h,此时固定化酶活力达到最大值,固定化时间过长或过短均使固定化酶活力下降。这是因为随着时间的延长,过多的酶吸附于载体表面,导致载体孔道堵塞,酶蛋白分子互相屏蔽,能与底物契合的酶数量减少。因此,最佳固定化酶反应时间为4 h。

图1 固定化时间对海泡石固载猪胰脂肪酶比酶活的影响Fig.1 Effects of time on activities of immobilized PPL on sepiolite
2.1.2 温度对酶固定化的影响
由于温度过高会导致酶变性失活,因此考察不同温度(20~50℃)对酶固定化的影响,结果见图2。
由图2可知:当温度小于30℃,所得固定化脂肪酶的比酶活较高(306 U/g);但是当温度超过30℃时,酶活急剧下降,这是因为在固定化过程中酶失活所致。因此,在脂肪酶固定化过程中温度应控制在25~30℃之间比较理想,最佳温度为25℃。
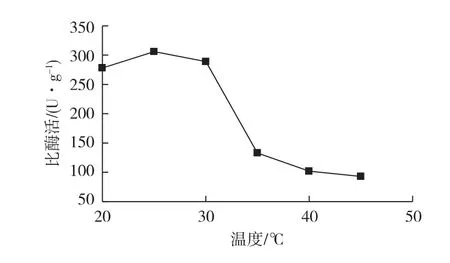
图2 温度对海泡石固载猪胰脂肪酶比酶活的影响Fig.2 Effects of temperature on activities of immobilized PPL on sepiolite
2.1.3 pH对酶固定化的影响
考察缓冲液的pH对酶固定化的影响,结果如表1所示。
由表1可知:脂肪酶的固定量受pH的影响较大,在pH 5.0的缓冲液中,酶的固定量最大为97.36 mg/g;在pH 6.0~7.0的缓冲液中,酶的固定量有所降低,但不明显。这是因为脂肪酶的等电点为5.0,当溶液的pH大于酶分子的等电点时,酶分子带负电;当溶液的pH小于等电点时,酶分子带正电,同时载体孔道内表面pH比溶液中pH要小,在这种情况下,蛋白质分子表面的正电荷逐渐减少为零电荷,蛋白质分子间的库伦力在减少,分子之间可以较紧密的单层排列在载体的内表面[10-11],从而能在 pH 5.0 ~7.0时得到较高的固定量,并使得酶分子的活力在pH 6.0处充分表现出来。但在pH 6.0~9.0之间,由于酶分子表面所带电荷从中性变为负值,这时酶分子和载体表面都带负电荷,彼此之间相互排斥,从而导致酶的固定量降低,酶活降低[12]。
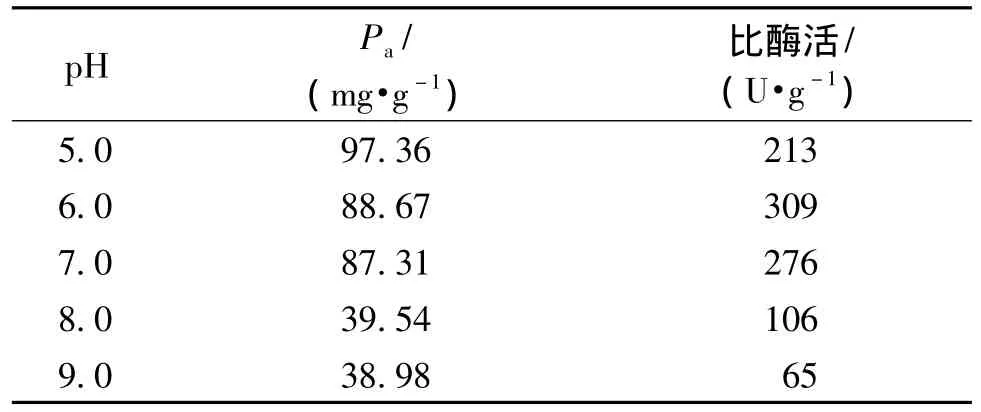
表1 pH对酶固定量及酶活的影响Table 1 Effects of pH on PPL enzymeimmobilization and enzymatic activities on sepiolite
2.2 固定化酶的酶学性质
2.2.1 固定化酶的化学稳定性
考察不同pH的磷酸缓冲液分别浸泡游离脂肪酶和海泡石固定化脂肪酶30 min,然后测定其酶活,以各自未经浸泡的初始酶活力为100%计,计算相对酶活力,结果如图3所示。由图3可知:游离脂肪酶的酶活大大降低,最高的相对酶活力也未达到50%,而且游离酶对酸碱非常敏感;经固定化的脂肪酶对酸碱的耐受力明显加强,相同pH条件下浸泡后固定化脂肪酶的相对活力均大于游离酶,而且固定化脂肪酶在pH在5.0~9.0范围内都能维持接近90%的较高酶活。
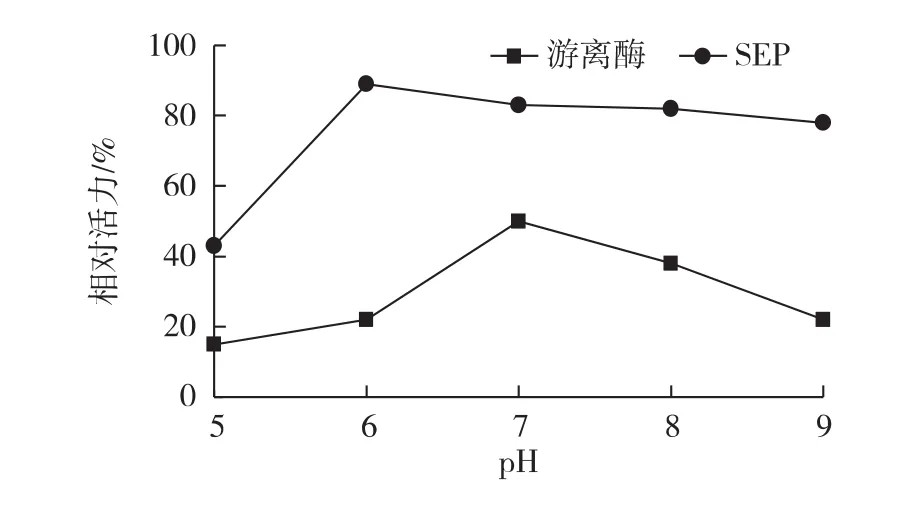
图3 游离脂肪酶和固定化脂肪酶的pH稳定性Fig.3 Effects of pH on stability of free and immobilized lipase
2.2.2 固定化酶的热稳定性
将游离脂肪酶和海泡石固定化脂肪酶分别置于60℃环境中处理0~6 h,然后测定处理后的酶活,计算相对酶活力,以各自未经热处理的初始酶活力为100%计,结果见图4。
由图4可知:游离酶在60℃环境下活力下降很快,1 h后游离酶的活力基本只有最初活力的33%。而对于固定化酶,其活力在60℃环境下下降比较缓慢,且反应2 h后固定化酶的活力仍保留最初活力的87%。这说明固定化脂肪酶的热稳定性得到了显著的提高。酶作为一种蛋白质,其构象对热不稳定,在高温下会因变性而失活。当酶蛋白被固定在载体上后,脂肪酶的三级结构可以得到保护而不至于被高温破坏,酶活力从孔道中缓慢释放,使得固定化酶的热稳定性得到了提高。酶催化反应通常会在较高温度下进行,固定化酶提高了酶作用效率和耐热性,这无疑对酶催化反应是非常有利的。
2.2.3 固定化酶的可重复利用性
重复利用在酶催化应用方面具有很重要的作用,尤其在工业上对于节约成本方面显得非常重要。图5表示的是重复利用次数对酶活的影响结果。由图5可知:固定化酶的催化活力随重复次数的增加而下降,但在经过5次重复使用后,其活力仍保留了91 U/g的比酶活。由于实验中,固定化酶使用量比较少,在回收脂肪酶的过程时不可避免地存在一定的损失,这可能也是导致酶活下降的原因之一。同时酶分子与材料之间是通过弱的分子间作用力(氢键、范德华力)吸附,经过多次的反应、分离和洗涤,也使得酶分子很容易从孔道中脱落[13-14]。因此,就固定化脂肪酶本身而有,其重复使用性能还是理想的。

图4 游离脂肪酶和海泡石固定化脂肪酶的热稳定性Fig.4 Effects of temperature on stability of free and immobilized lipase
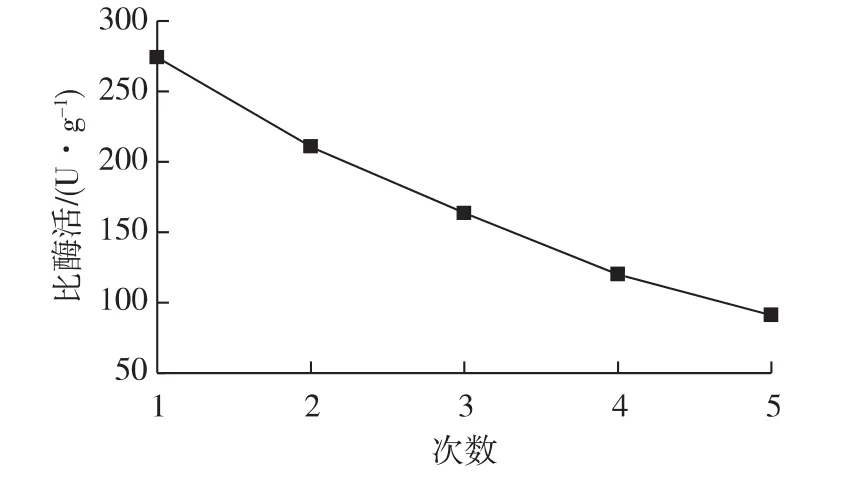
图5 使用次数对海泡石固载猪胰脂肪酶比酶活的影响Fig.5 Effects of reuse cycles on the activity of the immobilized PPL on sepiolite
2.3 固定化海泡石材料的表征分析
2.3.1 FT-IR分析
图6为固定化海泡石材料的红外表征结果。由图6可知:Si—O—Si对称和不对称伸缩振动峰出现在471、1 095 和 800 cm-1处。这些 Si—O—Si键形成了SiO2网状结构,在脂肪酶固载上去之后,该峰的强度明显减少,是因为Si—OH的基团和脂肪酶的N—H基团产生了氢键。而且2 850到2 995 cm-1处的C—H伸缩振动峰、1 577cm-1处的C—O伸缩振动峰、1 434 cm-1周围的C—H扭曲振动峰,这些脂肪酶的特征峰都只出现在固载酶的红外图谱上[15]。这些结果均表明,脂肪酶已成功固载在海泡石上。

图6 海泡石材料和固定化脂肪酶的FT-IR图谱Fig.6 FT-IR spectra of SEP and SEP-PPL
2.3.2 SEM分析
图7为海泡石与固载后海泡石后的SEM照片结果。由图7可知:未固载脂肪酶的海泡石和固载后的海泡石的存在明显差异,对比可以看出脂肪酶已经聚集固载于海泡石上。

图7 海泡石和固定化酶的海泡石的扫描电镜照片Fig.7 SEM images of SEP and SEP-PPL
3 结论
采用海泡石制备固定化脂肪酶具有工艺简单、条件温和及操作方便的特点。制备的固定化酶有较高的酶活,其最适固载时间为4 h,磷酸缓冲液pH 6.0,此时比酶活为309 U/g。获得的固定化酶在pH和热稳定性的适应能力都有显著提高,固定化酶在60℃环境中保存2 h后仍保留最初活力的87%。实验表明海泡石是固定化脂肪酶的良好载体。
[1] Katchalski-Katzir E.Immobilized enzymes-learning from past successes and failures[J].Trends Biotechnol,1993,11(11):471-478.
[2] Schmid A,Dordick J S,Hauer B,et al.Industrial biocatalysis today and tomorrow[J].Nature,2001,409:258-268.
[3] 游金坤,余旭亚,赵鹏.吸附法固定化酶的研究进展[J].化学工程,2012,40(4):1-2.
[4] 张琦.海泡石吸附性能研究[D].天津:河北工业大学,2002.
[5] 宋秀芹,马建峰,杨华丽,等.海泡石澄清作用在菜汁制作中的应用[J].化学世界,1996,37(7):349-351.
[6] 邓庚风,罗来涛,陈昭平,等.海泡石的性能及其应用[J].江西科学,1999,17(1):61.
[7] Jaeger K E,Eggert T.Lipases for biotechnology[J].Curr Opin Biotechnol,2002,13(4):390-397.
[8] 刘海洲,吴小飞,牛佰慧,等.脂肪酶在食品工业中的应用与研究进展[J].粮食加工,2008,33(5):55-57.
[9] 张晴,陈勇.海泡石对有机染料吸附作用的研究[J].青岛大学学报:自然科学版,1995,8(2):73-77.
[10] Vinu A,Murugesan V,Tangermann O,et al.Adsorption of cytochrome c on mesoporous molecular sieves:influence of pH,pore diameter,and aluminum incorporation[J].Chem Mater,2004,16(16):3056-3065.
[11] Vinu A,Murugesan V,Hartmann M,et al.Adsorption of lysozyme over mesoporous molecular sieves MCM-41 and SBA-15:influence of pH and aluminum incorporation[J].J Phys Chem B,2004,108:7323-7330.
[12] Katiyar A,Lei L,Smirniotis P,et al.Protein adsorption on the mesoporous molecular sieve silicate SBA-15:effects of pH and pore size[J].J Chromatogr A,2005,1069:119-126.
[13] Ma H,He J,Evans D G,et al.Immobilization of lipase in a mesoporous reactor based on MCM-41[J].J Mol Catal B:Enzymatic,2004,30(5/6):209-217.
[14] Yadav G D,Jadhav S R.Synthesis of reusable lipases by immobilization on hexagonal mesoporous silica and encapsulation in calcium alginate:transesterification in non-aqueousmemdium[J].Microporous Mesoporous Mater,2005,86:215-222.
[15] Zhu Kai,Wang Jianqiang,Wang Yanhua,et al.Synthesis of retinyl palmitate catalyzed by Candida sp.99-125 lipase immobilized on fiber-like SBA-15[J].J Nanosci Nanotechnol,2011,11(9):7593-7602.
