原位吸附浸没式膜生物反应器催化制备茚二醇
2014-05-04成喜雨
成喜雨,王 静,柯 屾
(1.北京交通大学 理学院 生命科学与生物工程研究院,北京 100044;2.北京节能环保促进会,北京 100195)
全细胞生物催化是可持续药物生产过程中的重要一环,该过程存在的一个主要问题是微生物所面临的底物和产物抑制[1-3]。恶臭假单胞菌催化茚合成顺式茚二醇就是一个典型例子,在此过程中,可以使用硅油建立液-液两相系统,降低茚对微生物的抑制[4-5]。但该过程存在的乳化问题,使下游产物分离变得困难;也可以使用高分子聚合物建立固-液两相系统,降低抑制的同时可以消除液-液两相系统存在的乳化问题[6-7],然而,聚合物颗粒的大量使用使过程复杂化,可能提高过程能耗和操作费用。膜反应器被报道可克服底物抑制,如利用中空纤维膜固定化微生物,可以明显提高微生物对废水中不同底物的耐受性[8-10]。
膜反应器用于废水处理已得到了广泛认可,由此笔者提出采用浸没式膜反应器(IMB)降低生物催化过程中的抑制问题。但在生物催化过程中底物的溶解度、毒性均不同于废水组分,因此所提出的IMB无论过程操作还是机制都与传统的膜生物反应器不同。在IMB中,膜既作为载体固定化细胞,又可作为第二相来吸附不溶性底物,从两方面降低过程抑制。笔者对比研究了IMB和悬浮细胞反应器的性能,考察过程加强机制,并进一步将原位吸附与IMB耦合,以期提高过程效率,为其在生物催化方面的应用打下基础。
1 材料和方法
1.1 试剂和菌株
茚购于Sigma公司,其中分析用的茚纯度为98%,生物催化实验用的茚纯度为90%;顺式茚二醇购于美国Wako公司;TSA(tryptic soy agar)、TSB(tryptic soy broth)培养基购于美国BD Biosciences公司;常规用化学试剂都购于Sigma公司或北京化学试剂公司。
恶臭假单胞菌ATCC55687购于美国ATCC菌种中心。菌株用TSA斜面培养基传代保存。种子准备过程如下:从斜面挑取1环菌,接种于装有150 mL TSB培养基的三角瓶中,三角瓶在200 r/min、30℃摇床上恒温培养过夜获得种子。
1.2 膜组件制备
实验用中空纤维膜为聚偏氟乙烯(PVDF)膜,购于厦门鲲扬膜科技有限公司。膜丝外径2.2 mm,内有一聚酯支撑层,膜丝截面图见图1。其聚酯支撑层由纤维细丝编网而成,纤维细丝间距5 μm左右(图1(b)和图1(c))。膜组件制备过程如下:取一定数量16 cm长膜丝,将此组膜丝两端长大约2 cm以内的膜丝之间均匀涂抹环氧树脂胶,使2个端口的膜丝之间没有间隙,之后将这组膜丝的两端置入长约1.5 cm长的玻璃或者聚丙烯小管内,将环氧树脂胶注入膜丝与小管之间间隙,在恒温烘箱干燥6 h左右,直至胶完全干燥,用锋利刀片切割两端获得平整断面,即获得膜组件。取合适直径硅胶管连接小管和循环用管路,经过灭菌后即可用于生物转化实验。

图1 PVDF中空纤维膜扫描电镜照片Fig.1 SEM images of PVDF hollow fiber membrane
1.3 悬浮培养生物催化过程
实验采用悬浮细胞反应器(SCB)作为IMB生物催化过程的对照。实验在装有150 mL培养基的500 mL三角瓶中进行,压缩空气通过灭菌后的过滤器(美国Milipore公司)进行无菌过滤,然后以75 mL/min的速率通入三角瓶反应器中。反应器的接种量为2.5%(体积分数),种子液吸光值约5。生物催化反应所用培养基为MMG培养基[4],C源为20 g/L葡萄糖。茚作为反应底物,在接种同时按照预定的浓度直接加入培养基中,然后将三角瓶置于200 r/min、30℃水浴摇床进行反应,在设定的时间点取样1 mL进行分析。
1.4 IMB生物催化过程
IMB实验装置如图2所示。IMB与SCB相似,不同的是三角瓶反应器加入了一个膜组件。膜组件与聚四氟乙烯(PTFE)循环管路连接,将膜组件浸入三角瓶培养基中,然后用蠕动泵以5 mL/min速率将培养基从三角瓶循环进入膜组件一端,从另一端返回三角瓶中,其余所有操作条件同SCB反应器。培养基和器皿采用高温灭菌,而膜组件和循环管路采用70%乙醇溶液循环浸泡5 h以上进行灭菌,之后用无菌蒸馏水循环冲洗6次以上,以去除酒精残留。
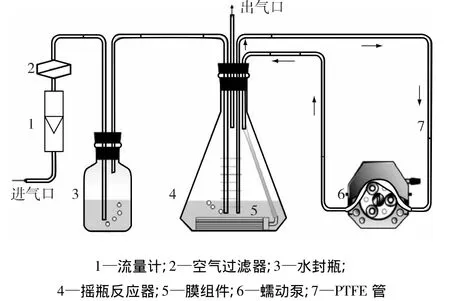
图2 IMB流程Fig.2 Flow chart of the immersed membrane bioreactor(IMB)
膜反应器中细胞固定化方法如下:将膜组件浸入种子培养瓶中,连接循环管路,用蠕动泵将三角瓶中种子液从膜组件一端泵入,种子液从膜组件另一端返回三角瓶中,如此循环12 h,使细胞吸附固定到膜丝表面和内部聚酯纤维支撑层的细丝之间。之后,将膜组件取出,用无菌蒸馏水轻轻淋洗表面,再置入含150 mL MMG培养基的三角瓶反应器中,同时将茚按照预定的浓度直接加入培养基中,然后将三角瓶置于200 r/min、30℃水浴摇床进行反应,在设定的时间点取样1 mL进行分析,每个实验设置3个平行样。
原位吸收反应器设置与图2基本相同,不同的是在反应开始时在反应器中添加1个包含有灭菌树脂的小包。树脂sp 207购买自Sigma公司,树脂用58 μm的尼龙布做成的小包包裹,采用70%的酒精溶液进行灭菌,之后用无菌蒸馏水清洗后用于生物转化实验中。
1.5 分析
细胞浓度采用分光光度计测定,测定波长为600 nm。产物和副产物茚酮测定采用HPLC进行,色谱条件如下:安捷伦Zorbax RX-C8色谱柱,紫外检测器,检测波长为220 nm,其余设置参照文献[4]。副产物茚酚市场上没有标准品,因此未进行定量检测。实验过程中收集一定量的样品,10 000 r/min离心10 min,取上清,用2-丙醇稀释,再使用0.45 μm PVDF膜过滤后用于HPLC分析。
茚不溶于水,同时反应过程可能吸附到膜组件和反应器内壁,很难准确定量测定过程中茚浓度,因此过程主要监测顺式茚二醇的浓度,最终通过产物顺式茚二醇浓度和初始茚添加量计算产率。
2 结果和讨论
2.1 SCB中顺式茚二醇合成
首先对SCB中细胞生长和顺式茚二醇合成的抑制情况进行了研究,作为IMB反应器运行结果的对照,结果见图3。由图3可知:在不添加底物茚的MMG培养基中,恶臭假单胞菌ATCC55687生长几乎没有延滞期,2 h后开始对数生长,比生长速率达0.6 h-1,8 h后生物生物量达到较高水平,之后进入缓慢生长期,24 h后OD600达5.3。当反应器中加入3 g/L茚作为底物,细胞生长受到明显抑制,比生长速率降低到0.4 h-1;当底物茚质量浓度增加到6 g/L,细胞生长受到严重抑制,比生长速率降低到0.3 h-1,24 h 后 OD600仅 1.6。
由图3还可知:在茚质量浓度为3 g/L时,4 h后观察到顺式茚二醇的快速合成,12 h后进入平台期,18 h后顺式茚二醇质量浓度达到107 mg/L,平均容积产率为6 mg/(L·h),过程摩尔产率很低,只有0.03 mol/mol(以1 mol茚计)。在6 g/L茚条件下,顺式茚二醇合成受到更严重抑制,顺式茚二醇质量浓度和摩尔产率分别低至84 mg/L和0.01 mol/mol。

图3 在SCB中茚浓度对细菌生长和顺式茚二醇合成的影响Fig.3 Effects of indene on cell growth and cisindandiol biosynthesis in the SCB
在恶臭假单胞菌催化茚合成顺式茚二醇的模式系统中,副产物比较多,这是其摩尔产率较低的原因之一,同时,茚不溶于水,通气过程中气提作用会造成底物损失,从而降低其产率[6]。底物和产物抑制是造成终产物浓度和摩尔产率降低的主要原因之一[4],上述研究结果也表明,SCB中细胞生长和产物合成受到了明显抑制。
2.2 IMB中顺式茚二醇合成
进一步研究IMB反应器降低上述全细胞催化过程普遍存在的底物和产物抑制的效果。IMB中既有固定化细胞(图1(d)),又有悬浮细胞,因为膜组件上吸附固定的微生物难以定量,因此对IMB中悬浮培养物浓度进行了监测,评估IMB对微生物生长的影响,结果见图4。由图4可知:与SCB相比,在使用12根膜丝的IMB-S中,即使在6 g/L的高底物浓度下,经过4 h的延滞期,细胞开始快速增长,比生长速率在0.4 h-1;24 h后细胞浓度为4.5,明显高于SCB中相应底物浓度下的水平(1.6)。膜组件中膜丝数量的调整也有利于降低底物对细胞生长的抑制,在使用25根膜丝的IMB-L中,悬浮细胞生长更快,在3 g/L的高底物浓度下,8 h左右OD600水平达到4.7,而在IMB-S中,达到相似水平需要到18 h。
在SCB中,在底物质量浓度分别为3和6 g/L时,顺式茚二醇质量浓度分别为107和84 mg/L。与之相比,IMB-S中产物合成量得到了明显的提高,分别达358和404 mg/L,摩尔产率则分别提高到0.08和0.05 mol/mol。反应周期也从SCB中的18 h延长到30 h,但容积产率达12 mg/(L·h),是SCB中水平的2倍。
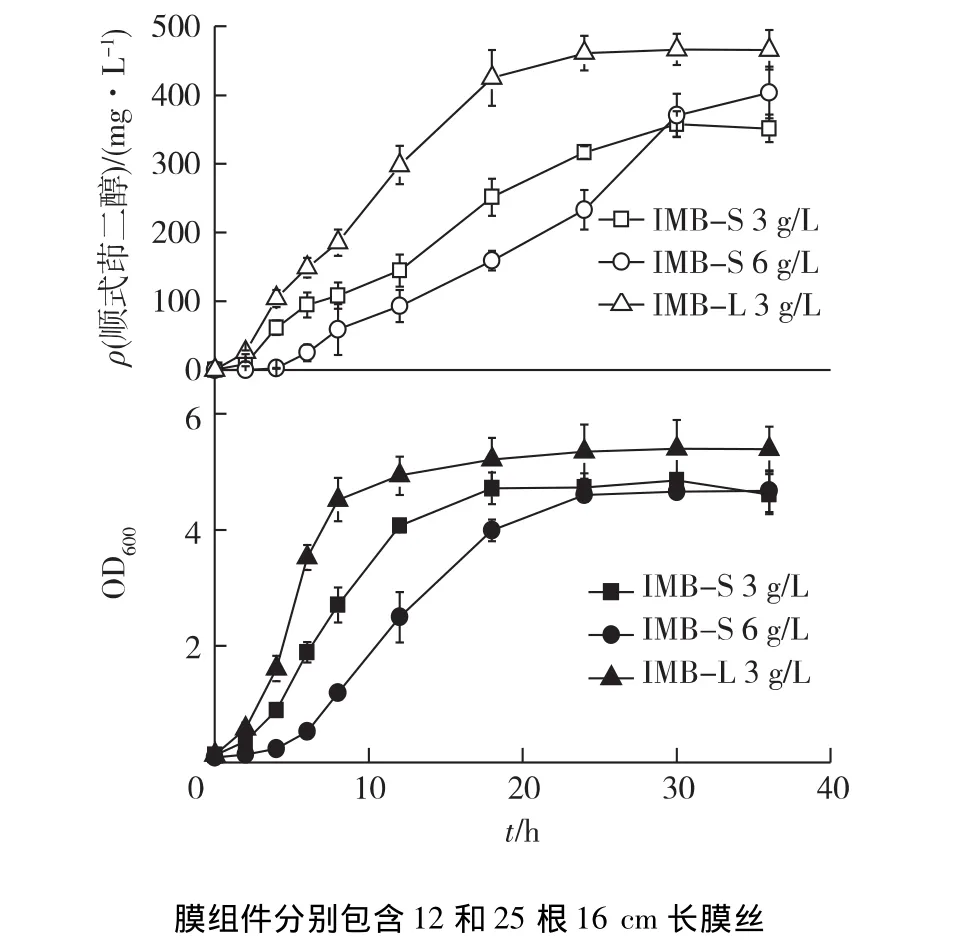
图4 在IMB中茚浓度下对细菌生长和顺式茚二醇合成的影响Fig.4 Effects of indene concentration on cell growth and cis-indandiol biosynthesis in the IMB
由图4还可知:通过增加膜组件中膜丝数量,顺式茚二醇合成速率和终浓度都得到了进一步提高。在底物为3 g/L时,培养18 h后顺式茚二醇质量浓度就达到425 mg/L,24 h后达到461 mg/L,容积产率达19 mg/(L·h),较IMB-S提高60%,是 SCB中水平的3倍。
IMB对顺式茚二醇过程的加强可能通过2种不同的机制。一方面,在IMB中固定化细胞可以提高反应器中细胞浓度,通过细胞固定化,微生物可以耐受更高浓度的底物[9]。增加膜丝数量将增加固定化微生物浓度,从而加强生物转化效率,在IMB-L中比在IMB-S中更高的产物浓度和容积产率证实了这一点。另一方面,用于IMB的PVDF膜具有较强的疏水性,与疏水的不溶性底物茚具有较好的亲和性,因而可以吸附茚,降低其对反应器中悬浮细胞抑制的同时,使IMB中悬浮细胞液可以获得很好生长,还可以减少通气过程造成的底物茚损失。
Dafoe等[6]报道了1个两相反应器,采用聚合物颗粒取代硅油作为第二相,过程效率得到大幅加强,指出聚合物颗粒对底物、副产物和产物的吸附是过程加强的重要原因。笔者的研究结果表明,膜组件对可溶性产物和副产物亲和性较低。在底物为3 g/L时,在IMB-S中,发酵终点顺式茚二醇和茚酮在膜相中分配比例分别为3%和27%(数据未显示),其余部分存留在水相中;在IMB-L中,由于膜丝数量增加,顺式茚二醇和茚酮在膜相中分配比例增加到6%和46%。由此可见,在IMB中,膜组件本身不能通过吸附移除产物来降低产物抑制,过程加强应该是通过固定化来提高微生物耐受性与通过膜组件对底物茚的吸附来降低底物茚的抑制的共同作用完成的。同时,膜组件对副产物茚酮具有一定的吸附作用,这种吸附随着膜丝数量的增加而得到增强,对过程加强将产生一定贡献。
2.3 原位吸附IMB中顺式茚二醇合成
从上面结果知道,膜组件本身并不能吸附顺式茚二醇,因此,进一步考察通过树脂原位吸附提高过程效率的可能性。在3 g/L底物质量浓度下,在IMB-L中,于接种的同时分别加入0.5%、1%、2%和4%的灭菌处理过的sp-207树脂,考察原位吸附对细胞生长和产物合成的影响,结果见图5。由图5(a)可知:树脂的添加量在5~10 g/L时对生长过程影响不大,而添加量增加到20~40 g/L时,生长明显受到影响。
由图5(b)可知:树脂的添加量在5~10 g/L时,顺式茚二醇总浓度随着树脂的添加量增加而增加;进一步增加树脂,产物产量有所降低。在10 g/L树脂添加量下,顺式茚二醇总质量浓度最高,达709 mg/L,比无树脂添加的IMB-L中产量提高45%,是SCB中产量的6.6倍。相应地,摩尔产率从SCB的0.03提高到0.18 mol/mol;容积产率提高到30 mg/(L·h),是SCB中水平的5倍。
由图5(b)可以发现:产物在水相、树脂相和膜相的分布情况,根据该数据可以计算到产物顺式茚二醇在各部分中的比例。在IMB-L中,因为膜本身对产物吸附性能非常弱,94%的产物分布在水相中,因此随着产物积累,其对微生物的抑制将不断增强;在原位吸附IMB-L中,树脂添加量为5~40 g/L时,生成的产物中有13% ~67%的量转移到树脂相中,通过树脂对产物的吸附,产物抑制一定程度上得以降低,而且树脂用量越高,水相中产物浓度占比越低,这可能是原位吸附IMB中生物转化效率得到进一步的原因之一。
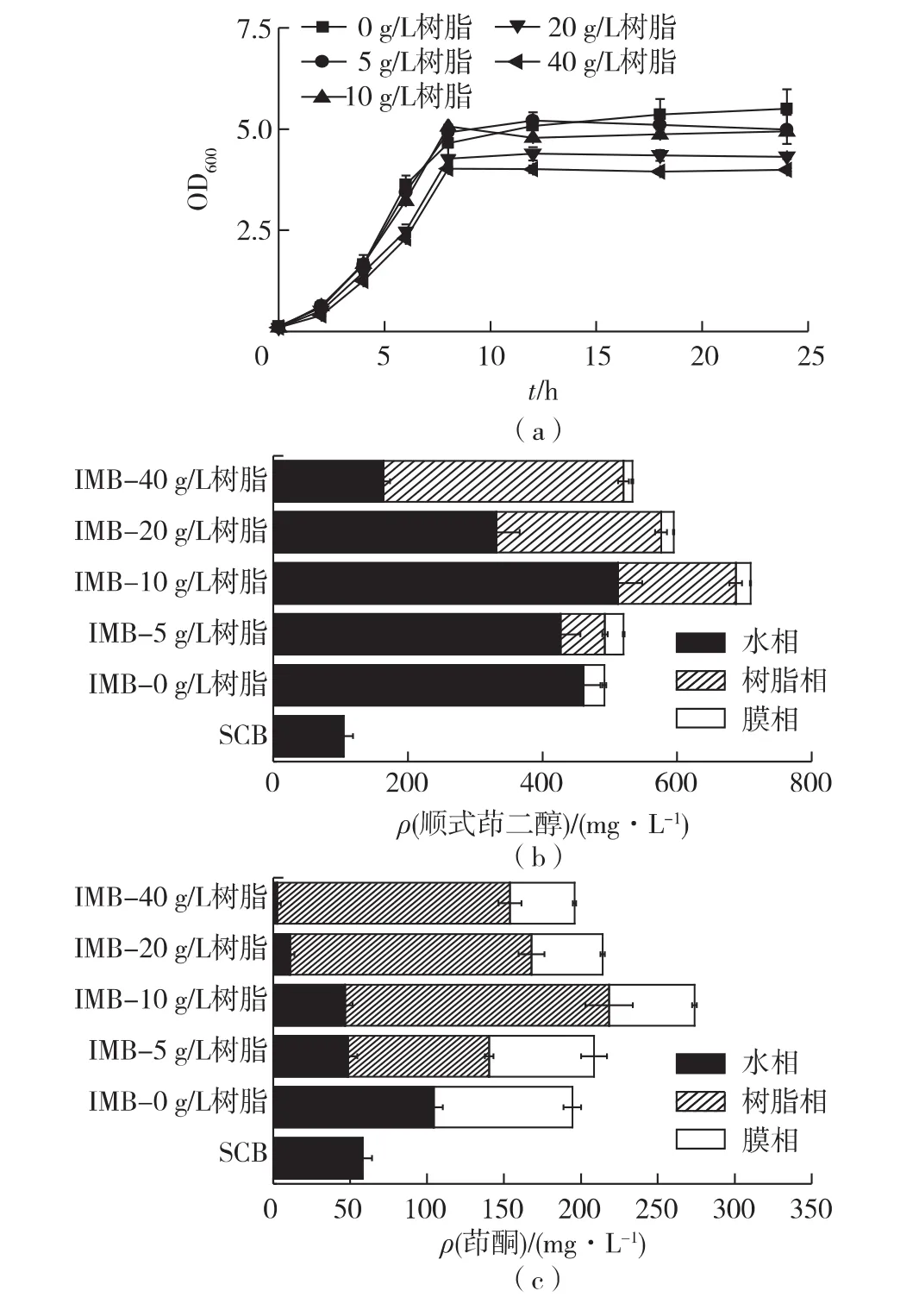
图5 树脂添加量进行原位吸附对IMB中细胞生长、顺式茚二醇和茚酮合成的影响Fig.5 Effects of in situ adsorption using resin at different concentrations on cell growth,cis-indandiol and indanone production in the IMB at 3 g/L and 6 g/L indene
由图5(c)可知:膜丝对茚酮有一定亲和性,在IMB-L中,46%的茚酮分布在膜相中,水相中茚酮比例是54%;在原位吸附IMB-L中,树脂添加量为5~40 g/L时,膜相中茚酮降低到21% ~33%,而树脂中茚酮占比例为44% ~77%,最终,水相中茚酮比例降低到2%~23%。上述结果表明,树脂添加也能移除副产物茚酮,移除能力随树脂添加量增加而增加。通过原位吸附,产物和副产物被部分或大部分移除,消除抑制,从而使IMB-L的效率得到了进一步提高。
值得注意的是,在4个树脂添加量的IMB反应过程中,当添加量为40 g/L时,在液相中无论产物浓度还是副产物茚酮浓度,都处于最低水平,但顺式茚二醇总产量比10 g/L树脂添加量有所降低,这可能与树脂添加对微生物活性影响和营养成分的吸附有关,相似的结果在其他体系中也有所报道[11-12]。树脂袋的加入有可能对摇瓶反应器中传质和供氧产生负面影响,从而影响转化效率。然而,此结果也预示在放大的反应器系统中,可能可以取得比现有摇瓶反应器系统更好的转化效率,因为通过放大,可以设置分离的扩张床系统,对产物和副产物进行原位移除,同时又可以尽可能降低对微生物活性和传质供氧的影响。
在相同的摇瓶反应器中,使用硅油的液-液两相摇瓶系统,顺式茚二醇质量浓度在10和12 h分别达到210和250 mg/L,通过过程优化,产量可以进一步提高到 400 mg/L[4],低于本研究原位吸附IMB-L中所得的709 mg/L的水平。通过采用聚合物颗粒替代硅油,研究者构建了基于机械搅拌式反应器的固-液两相系统,终产物质量浓度从0.29 g/L提高到1.29 g/L[6],高于IMB-L中相应水平。直接比较上述固-液两相系统和基于摇瓶的IMB系统的产量和产率水平很难对2个体系给出正确的评价,因为搅拌式反应器允许前者采用优化的底物添加策略、具有更好的传质和供氧,这些都必然对过程产生很大影响。值得注意的是,上述固-液两相系统中,容积产率从对照的29 mg/(L·h)提高到90 mg/(L·h),获得了3倍的提高;而采用IMB系统,容积产率从对照的6 mg/(L·h)提高到 30 mg/(L·h),获得了5倍的提高。另外,在此膜反应器中,吸附于膜上的微生物和悬浮微生物都可以进行生物转化,培养基在膜组件内部的连续循环也将控制固定化微生物和悬浮微生物的数量,传统废水处理膜生物反应器中经常碰到的膜污染问题在本系统中并未观察到,从电镜照片可以看到(图1(d)),微生物并未形成致密层影响传质和反应。当前的IMB系统集成了固定化细胞反应器和两相反应器的优点,其低的操作费用、巨大的优化空间为全细胞生物催化过程提供了一个可供选择的重要途径。
3 结论
在原位吸附IMB系统中,可通过细胞固定化以及底物、产物和副产物的吸附降低茚生物转化过程抑制,顺式茚二醇质量浓度和容积产率分别达到709 mg/L和30 mg/(L·h),与对照SCB相比,分别提高7和5倍。IMB系统操作简单灵活,可以通过改变膜丝数量、膜结构、膜材料和循环过程等多种方式对过程进行优化,进一步提高过程效率。同时,IMB容易放大,在全细胞生物催化制药领域具有重要的应用前景。
[1] Pham S Q,Gao P F,Li Z.Engineering of recombinant E.coli cells co-expressing P450pyrTM monooxygenase and glucose dehydrogenase for highly regio-and stereoselective hydroxylation of alicycles with cofactor recycling[J].Biotechnol Bioeng,2013,110(2):363-373.
[2] Nestl B M,Nebel B A,Hauer B.Recent progress in industrial biocatalysis[J].Curr Opin Chem Biol,2011,15(2):187-193.
[3] Chang D L,Feiten H J,WitholtB,etal.Regio-and stereoselective hydroxylation of N-substituted pippridin-2-ones with Sphingomonas sp.HXN-200[J].Tetrahedron:Asymmetry,2004,15(3):571-572.
[4] Connors N C,Prevoznak R,Chartrain M M,et al.Conversion of indene to cis-(1S),(2R)-indandiol by mutants of Pseudomonas putida F1[J].J Ind Microbiol Biotechnol,1997,18(6):353-359.
[5] Buckland B C,Drew S W,Connors N C,et al.Microbial conversion of indene to indandiol:a key intermediate in the synthesis of CRIXIVAN[J].Metab Eng,1999,1(1):63-74.
[6] Dafoe J T S,Daugulis A J.Bioproduction of cis-(1S,2R)-indandiol,a chiral pharmaceutical intermediate,using a solidliquid two-phase partitioning bioreactor for enhanced removal of inhibitors[J].J Chem Technol Biotechnol,2011,86(11):1379-1385.
[7] Daugulis A J,Khan T R.The effects of polymer phase ratio and feeding strategy on solid-liquid TPPBs for the production of L-phenylacetylcarbinol from benzaldehyde using Candida utilis[J].Biotechnol Lett,2011,33(1):63-70.
[8] Chung T S,Loh K C,Tay H L.Development of polysulfone membranes for bacteria immobilization to remove phenol[J].J Appl Polymer Sci,1998,70(13):2585-2594.
[9] Li Y,Loh K C.Activated carbon impregnated polysulfone hollow fiber membrane for cell immobilization and cometabolic biotransformation of 4-chlorophenol in the presence of phenol[J].J Membr Sci,2006,276(1/2):81-90.
[10] Li Y,Loh K C.Hybrid-hollow-fiber membrane bioreactor for cometabolic transformation of 4-chlorophenol in the presence of phenol[J].J Environ Eng,2007,133(4):404-410.
[11] D'Arrigo P,Fuganti C,Fantoni G P et al.Extractive biocatalysis:a powerful tool in selectivity control in yeast biotransformations[J].Tetrahedron,1998,54:15017-15026.
[12] Achmon Y,Goldshtein J,MargelS,etal.Hydrophobic microspheres for in situ removal of 2-phenylethanol from yeast fermentation[J].J Microencapsulation,2011,28(7):628-638.
