黄豆酱中低聚肽的分离及抗氧化活性研究
2014-05-03阮长青刘肇明
阮长青 刘肇明
RUAN Chang-qing 1,2 LIU Zhao-ming 1
(1.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;2.农业部农产加工品质量监督检验测试中心,黑龙江 大庆 163319)
(1.Heilongjiang Bayi Agricultural University,Daqing,Heilongjiang 163319,China;2.National Coarse Cereals Engineering Research Center,Daqing,Heilongjiang 163319,China)
黄豆酱亦称大豆酱,是以大豆和面粉为主要原料,通过微生物发酵酿制而成的一种半流动状态的调味品[1,2]。在发酵过程中由于微生物酶系的作用,会发生复杂的变化,形成豆酱特有的风味、营养和质地。与此同时大分子的蛋白也有一部分被分解成小分子的肽段[3]。这些被分解而成的小肽不仅利于人体吸收而且还有许多肽具有多种生物活性,其中包括抗氧化活性、降血压活性(ACE抑制肽)、降胆固醇活性、降血脂、抑菌、抗病毒等等[4-6]。目前相关国内外的研究重点主要集中在从大豆水解液中分离纯化抗氧化肽,曹亚兰等[7]从大豆水解液中分离并测定 出 Leu-Tyr-His-Thr,Ser-Phe-Val三段具有抗氧化活性的肽段,而基于大豆天然发酵产物分离纯化抗氧化肽并测得序列的研究相对匮乏。关晴等[8]利用葡聚糖凝胶柱从黄豆酱中分离得4个抗氧化肽峰谱图,但未测定活性肽的分子量分布且所获产品未达到测序的要求纯度。本研究拟在前期研究基础上,利用膜分离、柱分离等手段找到具有较强抗氧化活性的低聚肽并确定其分子量分布及抗氧化性质,为进一步的构效关系、吸收机制等研究提供方法。
1 材料与方法
1.1 材料与试剂
黄豆酱:黑龙江省宝泉岭农垦宝泉酱业有限公司;
活性炭粉末:天津市大茂化学试剂厂;
DEAE琼脂糖凝胶树脂:西安交大保赛生物技术股份有限公司;
葡聚糖凝胶G-15:上海西宝生物科技有限公司;
ABTS试剂盒、羟自由基试剂盒、超氧阴离子自由基:南京建成生物工程研究所有限公司;
其他试剂均为分析纯。
1.2 仪器与设备
冷冻离心机:CR3i multifunction型,美国Thermo Fisher公司;
层析住(带转换接头):#1.5$50 cm,上海厦美生化科技发展有限公司;
普通层析住:#1.6×100 cm,上海煊盛生化科技有限公司;
冷冻干燥机:ALPHA1-2 LD型,德国Christ公司;
紫外检测器:HD-3型,上海沪西分析仪器有限公司;
紫外分光光度计:SPECORD210plus型,德国 Analytikjena公司。
1.3 试验方法
1.3.1 黄豆酱的脱色及膜分离工艺 采用水法提取黄豆酱肽,通过预试验获得最佳提取条件为料液比1∶11.9(m∶m),提取温度56℃,溶液p H 6.0,提取时间61 min。采用活性炭法脱色,活性炭用量6%,脱色温度35℃,脱色时间40 min,溶液p H 5.0,对脱色液进行膜分离,收集分子量在3 000 Da以下的部分冻干用于进一步分离并测定其抗氧化活性[8]。
1.3.2 黄豆酱低聚肽的DEAE(二乙氨基乙醇)琼脂糖凝胶分离 用50 g DEAE琼脂糖凝胶作为填料灌装#1.5×50 cm层析柱(带转换接头),将收集的3 000 Da以下冻干粉用缓冲溶液配成一定浓度的溶液上样,采用NaCl的Tris—HCl缓冲液进行梯度洗脱,根据分离情况确定缓冲液的最佳p H并对各个峰的活性进行测定,收集活性最高峰冻干制粉用于下一步分离。
1.3.3 DEAEQ琼脂糖凝胶分离后各组分活性研究 评价抗氧化活性肽的指标为羟自由基清除率、铜离子清除率、超氧阴离子清除率和ABTS抗氧化活性的测定。
1.3.4 黄豆酱低聚肽的G-15葡聚糖凝胶分离 采用G-15葡聚糖凝胶灌装#1.6×100 cm普通层析柱(胶面距上液面距离小于5 cm)将上步试验收集的高活性峰的冻干粉配制成一定浓度的溶液上样,按分离情况确定其最佳上样浓度,最佳流速。对分离的峰进行活性测定,并收集活性最高峰。
1.3.5 黄豆酱抗氧化肽分子量测定 凝胶过滤层析技术可分离分子量大小不同的蛋白质并可粗略的估计其分子量的大小。Sephadex G-15最适分离范围是700~1 500 Da,适用于脱盐、肽与其它小分子的分离。对分子量大于1 500 Da的物质其洗脱液体积(Ve)与外水体积(V o)相等。
1.3.6 黄豆酱肽抗氧化活性的测定方法 采用南京建成试剂盒进行测定。
2 结果与分析
2.1 黄豆酱低聚肽DEAE琼脂糖凝胶分离的最佳p H
采用p H 为7.8,8.2,8.6的Tris—HCl缓冲液溶把样品配成50 mg/m L的溶液并上样,上样体积为3 m L,洗脱速度为2 m L/min根据分离情况确定缓冲液的最佳p H。分离情况见图1。
DEAE为阴离子树脂,故所采用的缓冲液p H最好在多肽的等电点附近,使多肽间作用力减弱,易于沉降,此时多肽与离子树脂发生离子交换的可能性增强,再用相同p H梯度浓度的NaCl去洗脱树脂,根据离子浓度不同可获得不同极性的肽段,达到较好的分离效果。由图1可知,黄豆酱样品在p H 为7.8时只在0.1 mol/L与0.4 mol/L的 NaCl洗脱液洗脱时出峰,分离效果不明显,可能是p H过小,负电荷化不够强,交换吸附不明显。在p H为8.2时黄豆酱肽洗脱出3个峰,而在p H为8.6时可以洗脱出4个峰,分离效果相对较好,故选用p H为8.6的缓冲液对样品进行处理。

图1 不同p H缓冲液黄豆酱肽紫外吸收曲线Figure 1 Different p H purification soybean paste peptide
2.2 DEAE琼脂糖凝胶分离后各组分抗氧化活性分析结果
分别对经DEAE树脂分离的4个峰进行收集并冻干,分别测定其抑制羟自由基能力、抗超氧阴离子能力、铜离子还原能力和ABTS清除能力,结果见表1。其中0.1 mol/L的NaCl洗脱出的峰F1活性最高,收集冻干,应用分子筛进一步分离。

表1 DEAE琼脂糖凝胶分离后各组分抗氧化指标Table 1 The antioxidant activity of different constituents
2.3 Sephadex G-15凝胶分离最佳上样浓度确定结果
在凝胶分离中样品的浓度也对分析效果有重要影响,在分析型凝胶过滤中,样品的浓度、带电性质对分离效果均产生影响[9]。结合图2的分离情况可知,在上样浓度为1.2 mg/m L时分离效果最好。
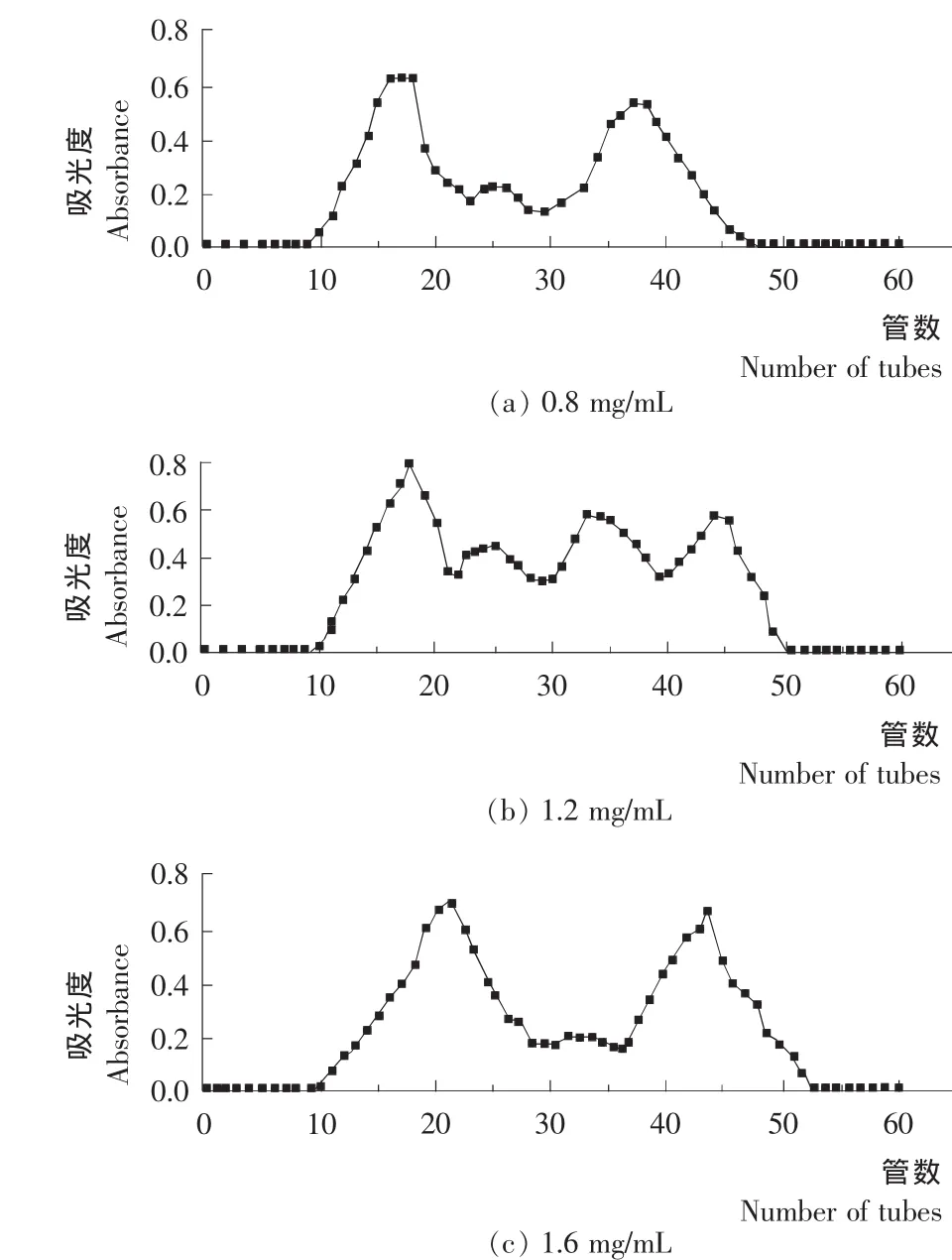
图2 不同浓度黄豆酱肽的纯化吸收峰曲线Figure 2 Different concentrations of purification soybean paste peptide
2.4 Sephadex G-15凝胶分离最佳流速选择
对于凝胶柱分离不同分子量的肽段,最佳流速的选择因分子量大小不同而存在差异,低流速时,大分子肽段传质时间长,洗脱分离效果明显,小分子肽段容易发生纵向扩散,分离不够明显,而高流速下则正相反[10]。结合图3可知,使用Sephadex G-15分离黄豆酱肽时最佳流速应为2 mL/min。
2.5 各部分肽段的分子量测定结果
将已知分子量标准品VB12、Angiotensin(高血压肽)和还原型谷胱甘肽分别配成一定浓度的溶液,经针式微孔膜过滤后上样,上样量为3.0 m L。各标准样品的分子量、分子量的对数及保留管数列于表2中,以保留管数为横座标,分别以吸光度值和标准品分子量对数为纵座标作图,见图4。
依据标准品线性回归方程,计算黄豆酱肽经葡聚糖凝胶分段后各段分子量范围为1 124~1 659,925~1 124,580~925,408~580 Da。
2.6 分离各组分活性结果
经DEAE琼脂糖凝胶分离得到的F1活性最强,通过Sephadex G-15凝胶分离所得4个峰分别测其抗氧化指标,结果见表3。
综合分析各峰抗氧化能力可知,F1-2与F1-3的活性相当,F1-1与F1-4的活性较弱,应选 F1-2、F1-3进行进一步分离研究。

图3 不同洗脱流速纯化黄豆酱肽的吸收峰曲线Figure 3 Flow rate of purification soybean paste peptide
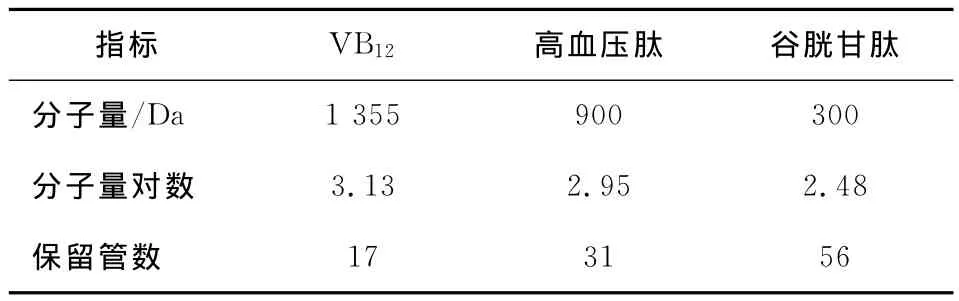
表2 标准物质分子量与保留管数Table 2 The molecular weight and elution pipe number

图4 黄豆酱肽段分子量分布图Figure 4 Different moleculair weight of soybean paste peptide
3 结论
采用黄豆酱为原料,利用超滤分离、色谱分离技术找到了一种研究黄豆酱中低聚肽抗氧化性质的方法,并确定了高抗氧化活性组分的分子量分布。最佳工艺参数:DEAE离子交换树脂处理黄豆酱肽的最佳p H为8.6,葡聚糖凝胶G-15分离最佳流速为2 m L/min,上样浓度为1.2 mg/m L,并确定了高抗氧化活性的两组黄豆酱低聚肽分子量范围为925~1 124,580~925 Da,为黄豆酱肽进一步的构效关系、吸收机制等研究提供了方法。

表3 经Sephadex G-15纯化后黄豆酱肽各组分抗氧化测定结果Table 3 The antioxidant activity of purification soybean paste peptide
1 刘颖,刘婧美,王佳瑞,等.传统发酵豆酱高β-葡萄糖苷酶活力制曲工艺研究[J].食品与机械,2009,25(6):134~137.
2 赵建新,顾小红,刘杨岷,等.传统豆酱挥发性风味化合物的研究[J].食品科学,2006,27(12):684~687.
3 孙常雁,孔保华.自然发酵黄豆酱中主要微生物酶系的形成及作用[D].哈尔滨:东北农业大学,2007.
4 Beermann C,Euler M,Herzberg J,et al.Anti-oxidative capacity of enzymatically released peptides from soybean protein isolate[J].Food Research and Technology,2009,229(4):637~644.
5 王层飞,李忠海,龚吉军,等.生物活性肽的保健功能及其在食品工业中的应用研究[J].食品与机械,2008,24(3):128~131.
6 Sarmadi B H,Ismail A.Antioxidative peptides from food proteins:a review[J].Peptides,2010,31(10):1 949~1 956.
7 曹亚兰,赵谋明.大豆抗氧化肽的制备、分离纯化及结构鉴定[D].广州:华南理工大学,2012.
8 关晴,阮长青.黄豆酱中水溶性肽的提取及抗氧化活性研究[D].大庆:黑龙江八一农垦大学,2012.
9 田亚平.生化分离技术[M].北京:化学工业出版社,2006:85~87.
10 田亚平,周楠迪.生化分离原理与技术[M].北京:化学工业出版社,2010:62~84.
