苯扎氯铵对单克隆抗体亲和层析填料的杀菌效果及其残留量的检测
2014-05-02阮乾坤韩志刚余军阳杜伊达杨大军
阮乾坤,韩志刚,余军阳,杜伊达,杨大军
单克隆抗体亲和层析(monoclonal antibodies affinity chromatography,mAb AC)是一种高度特异性的用于分离、纯化生物大分子的层析分离技术,但其填料在制备和使用的过程中易染菌,常规的杀菌剂,如强酸、强碱、高浓度的盐和有机溶剂容易对填料配基造成损伤或破坏[1]。本文经过一系列实验,最终从众多的杀菌剂中筛选出一种既能有效去除单克隆抗体亲和层析填料中污染的细菌,又能保证单克隆抗体亲和层析填料配基基本不被损伤或破坏的适宜的杀菌剂苯扎氯铵,并建立了苯扎氯铵在单克隆抗体亲和层析填料中的低量残留的有效检测方法。虽然现有技术中常用的苯扎氯铵含量的检测方法有多种,例如化学滴定法[2~4]、双波长紫外分光光度法[5]、毛细管电泳法(CE)[6]、高效液相色谱法(HPLC)[7]、示差分光光度法[8]、高效液 相色 谱 - 质谱 法 (HPLC⁃MC)[9]、免疫法[10]、离子选择电极法[11]和一、二阶导数光谱法[12,13]等。 但在众多方法中,化学滴定法和紫外分光光度法仅用于较高含量的测定,对于微量定量分析往往不够,且达不到快速分析的要求;示差分光光度法往往需要衍生后才能测定,方法极为繁琐费时;HPLC⁃MS法分析成本高,目前常用于水体、土壤及食品中化合物的残留分析;毛细管电泳法和一、二阶导数光谱法既繁琐,又不普及。因此,本文选择最常用而高效的液相色谱法,利用其灵敏、准确、简便的特点检测层析填料中杀菌剂苯扎氯铵的残留。
1 材料与方法
1.1 主要仪器与试剂
美国 Waters公司高效液相色谱仪,包括WatersTM600 Controller型泵、WatersTM486型紫外检测器和WatersTM2010数据处理机;采用美国Phenomenex公司 C18色谱柱 (250 mm×4.6 mm,5 μm)。
乙腈购自德国Merck公司;三乙胺(HPLC级)购自美国Tedia公司;庚烷磺酸钠购自美国Fluka公司;苯扎氯铵购自上海金山经纬化工有限公司。
1.2 杀菌剂的筛选
1.2.1 初筛(菌悬液定量杀菌实验) 备选杀菌剂包括:甲醛、苯扎氯铵、叠氮钠、硫柳汞钠、盐酸胍和红霉素6种。取染菌的亲和层析填料,用3 mL水充分浸泡后,4 000 r/min离心,取上清加入到90 mL LB液体培养基中,37℃、160 r/min条件下摇床培养18~24 h备用;分别取1 mL菌悬液,加入到129支装有9 mL LB液体培养基的无菌试管中,37℃、160 r/min条件下摇床过夜培养。将甲醛、苯扎氯胺、叠氮钠、硫柳汞钠、盐酸胍和红霉素分别加入到上述各试管中,使每种杀菌剂形成3.2%、1.6%、0.8%、0.4%、0.2%、0.1%和0.05%共7个浓度,每个浓度做3个重复。将上述加有不同浓度杀菌剂的试管继续37℃、160 r/min条件下摇床培养24 h,观察试管中菌悬液是否有澄清现象,并分别取0.1 mL菌液平铺营养琼脂平板,37℃恒温培养24 h后进行菌落计数,对各浓度的各杀菌剂的每一平板的菌落计数结果取平均值,得到该浓度该杀菌剂的杀菌后平皿菌落数。另取剩余3支未加杀菌剂的试管中的培养液各0.1 mL平铺营养琼脂平板,37℃恒温培养24 h后进行菌落计数,取平均值得杀菌前平皿菌落数。计算各浓度各杀菌剂的杀菌率。

1.2.2 复筛(亲和层析凝胶蛋白吸附量测定)
根据初筛的实验结果,综合考虑杀菌效果、杀菌剂的毒性和杀菌剂在药物制剂中的使用情况,初步选出杀菌效果较好的两种杀菌剂甲醛和苯扎氯铵,通过考察它们对亲和层析凝胶蛋白吸附量的影响,进一步筛选出理想的杀菌剂。取3根装有5mL单抗亲和层析胶的层析柱(层析柱规格为10mm×100mm),首先用 25mmol/L, pH 7.0 的PBS缓冲液平衡3根层析柱5CV,然后分别用0.1%的甲醛和0.1%的苯扎氯铵平衡层析柱5CV,使单抗层析柱中充满该两种杀菌剂,并静置2h;以不加任何杀菌剂处理的单抗层析柱作为空白对照。待分别用25mmol/L,pH 7.0的PBS缓冲液冲洗层析柱10CV,清除层析柱中的甲醛和苯扎氯铵后,再往层析柱中加入10 mg蛋白样品;然后依次用 25mmol/L,pH 7.0的 PBST和 PBS缓冲液冲洗层析柱5CV;采用25mmol/L,pH 2.5的Gly缓冲液洗脱蛋白,并记录洗脱体积,采用Lowry法测出蛋白质浓度,最后计算出蛋白质吸附量。与空白对照相比,蛋白吸附量越小,说明该杀菌剂对单克隆抗体亲和层析填料的破坏作用越大,不适合作为理想的杀菌剂。

1.3 杀菌剂苯扎氯铵的残留检测
1.3.1 色谱条件 流动相A为0.2 mol/L庚烷磺酸钠(含0.1%三乙胺,用磷酸调pH至3.0±0.1);流动相B为100%乙腈。流动相A∶流动相B=35∶65(V/V)。 色 谱 柱 采 用 Phenomenex C18(250 mm×4.6 mm,5 μm);流速为 1.0 mL/min,柱温25℃,进样体积40μL,检测波长210 nm。
1.3.2 标准液配制与标准曲线绘制 精确配制浓度分别为 0.25 ng/mL、0.5 ng/mL、1.0 ng/mL、2.0 ng/mL和4.0 ng/mL的苯扎氯铵标准液。将系列标准液分别进样40μL,每个浓度重复3次,并以苯扎氯铵的峰面积对浓度作图,考察其线性相关性,并确定检出限。
1.3.3 实际样品中苯扎氯铵的测定 用0.1%苯扎氯铵溶液处理亲和层析凝胶柱,然后用PBS冲洗,冲洗至15 CV时,取样,按照上述色谱条件,检测样品中苯扎氯铵的残留量,样品重复进样5次,计算出相对标准偏差RSD,考察本方法的精密度。
1.4 统计学分析
采用Design⁃Export.V8.06响应面数据分析软件进行分析处理,确定庚烷磺酸钠和三乙胺的最佳浓度比。
2 结果与分析
2.1 杀菌剂的筛选
2.1.1 杀菌剂的杀菌效果比较 通过对甲醛、苯扎氯胺、叠氮钠、硫柳汞钠、盐酸胍和红霉素6种杀菌剂进行初筛,不同浓度的杀菌剂杀菌效果如表1所示。在杀菌剂最低浓度为0.1%时,杀菌效果由强到弱依次为:盐酸胍=硫柳汞钠>苯扎氯铵>甲醛>红霉素>叠氮钠。从安全实用角度看,硫柳汞毒性较大且易残留,不宜作为药品生产用杀菌剂;盐酸胍会对亲和层析凝胶造成严重损坏,也不适合作为杀菌剂;苯扎氯铵因常用在滴眼液中作为防腐剂,毒性低[8],在本实验中杀菌效果比较理想,因此可选为备选杀菌剂;甲醛因在疫苗中常作为防腐剂,所以可选择甲醛作为备选杀菌剂。
2.1.2 杀菌剂对亲和层析凝胶蛋白吸附量的影响 分别用0.1%甲醛和0.1%苯扎氯铵处理亲和层析凝胶,通过杀菌剂处理前后亲和层析凝胶蛋白吸附量的变化,来进一步筛选理想的杀菌剂,实验结果见表2。亲和层析凝胶在经过0.1%甲醛处理后,蛋白吸附量降低了29.3%,初步分析,甲醛作为一种最小的含氧有机物,具有较高的反应活性,与亲和层析凝胶中的-OH(羟基)、-SH(巯基)、-NH2(氨基)发生分子亲和加成反应,使得亲和层析凝胶中的自由基被甲醛交联起来,部分失去了原来的生理功能,所以蛋白吸附量明显降低;而亲和层析凝胶在经0.1%的苯扎氯铵处理后,蛋白吸附量仅降低1.53%,这说明0.1%的苯扎氯铵对其蛋白吸附量没有明显影响,因此,我们选择0.1%苯扎氯铵作为最终的杀菌剂,来进行下一步的研究。
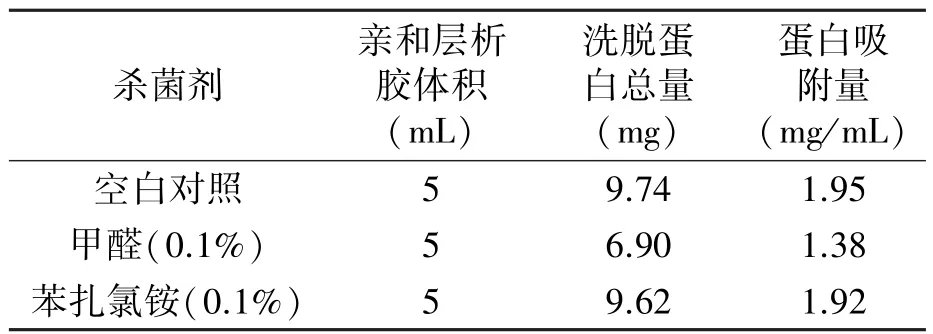
表2 蛋白吸附量实验Table 2 Protein adsorption capacity test.
2.2 苯扎氯铵残留量HPLC检测方法的建立
2.2.1 流动相的确定 流动相为乙腈-庚烷磺酸钠(含三乙胺)。其中,乙腈比例高于65%时,苯扎氯铵在色谱柱内的保留时间过短;低于65%时,峰保留时间则太长,且拖尾现象严重。从分离度和分析效率两方面综合考虑,将乙腈的比例定为65%。
流动相中庚烷磺酸钠溶液会对色谱柱有损伤,比较了 0.02 mol/L、0.04 mol/L、0.1 mol/L 和0.2 mol/L四种浓度下对苯扎氯铵的色谱分离效果,结果见图1。庚烷磺酸钠浓度为0.02 mol/L时,苯扎氯铵色谱峰严重拖尾,且对称性不好(图1a),随着浓度升高,保留时间逐渐拉长,且峰形逐渐改善。在庚烷磺酸钠溶液中添加三乙胺可以改善色谱分离效果,流动相中乙腈的比例为65%(水相中pH 3.0)时,改变庚烷磺酸钠中三乙胺的浓度,并采用Design⁃Export.V8.06响应面数据分析软件对数据进行统计分析,结果分见图2。综合考虑实验结果,最终将水相中庚烷磺酸钠的最佳浓度定为0.2 mol/L,三乙胺的最佳浓度定为0.1 mol/L,此时苯扎氯铵色谱图的对称性最高,色谱峰拖尾因子明显降低。

图1 庚烷磺酸钠浓度对苯扎氯铵色谱保留行为的影响Fig.1 Effect of concentration of sodium heptanesulfonate on chromatogram retention behavior of benzalkonium chloride.

图2 庚烷磺酸钠和三乙胺浓度对色谱图对称度的影响Fig.2 Effect of concentration of sodium heptanesulfonate and triethylamine on the symmetry of chromatogram.
2.2.2 流动相pH的确定 苯扎氯铵为中性或弱碱性化合物,在水溶液中发生解离,其pKa约为7~9。要想保证待测样品离子与离子对试剂完全形成中性离子对,必须使待测样品在流动相中完全电离,由于分子互换形式等量存在将导致峰展宽,所以要避免流动相的pH等于待测样品的pKa。当pH与pKa相差一个单位时,分子的解离度为95%,相差两个单位时,解离度为99%,要想使碱性化合物完全电离,其 pH<pKa⁃2。磷酸的pKa约为2.2,因此pH为0.5~3.2时,磷酸盐具有缓冲作用。鉴于反相色谱柱的耐酸性,本次实验流动相pH定为3.0。
2.2.3 检测波长的确定 苯扎氯铵在紫外波长为210 nm和262 nm具有最大紫外吸收峰,但262 nm处吸收强度远弱于210 nm处,鉴于庚烷磺酸钠与磷酸在210 nm处对苯扎氯铵紫外吸收无干扰,因此将检测的吸收波长定为210 nm。
2.2.4 标准曲线和检出限 常见苯扎氯铵主要有3种同系物(十二烷基二甲基苄基氯化铵、十四烷基二甲基苄基氯化铵和十六烷基二甲基苄基氯化铵)组成,由于原料的关系,本次实验样品所用苯扎氯铵只含有十二烷基二甲基苄基氯化铵,且成分约占99.9%。在1.3.1所述色谱条件下,苯扎氯铵对应的理论塔板数为8 803,色谱图如图3所示。以苯扎氯铵成分的峰面积对浓度作图,在浓度为0.000 25~0.002 mg/mL范围内,线性方程为 y=51 431x-3 650.5,R2=0.999 8。 检出限为0.000 25 mg/mL,与相关文献报道的检出限(0.05~0.2 mg/mL)[14]相比,灵敏度提高了 200~800 倍。

图3 苯扎氯铵液相色谱图Fig.3 Chromatograms of benzalkonium chloride.
2.3 HPLC法对实际样品中苯扎氯铵的测定
实际样品中苯扎氯铵含量测定结果如表3所示。实验结果表明,样品检测相对标准偏差为0.63%,精密度良好。与初始量相比,残留量为0.435 ng/mL,远低于中国药典要求的生物制品中苯扎氯铵残留量0.05 mg/mL。
3 讨论
药品在纯化过程中因亲和层析柱的染菌,可能会带来潜在的风险,本文在既保证能清除层析柱感染的细菌,又不使亲和层析凝胶遭受杀菌剂破坏的前提下,首次筛选出一种理想的杀菌剂苯扎氯铵。0.1%的苯扎氯铵的对填料的实验杀菌率达到100%,并且对亲和层析凝胶的蛋白吸附量没有明显影响;同时,苯扎氯铵还常用作滴眼液的防腐剂,具备用于生物制品生产所要求的安全性。随即本文又建立了利用反相离子对高效液相色谱测定层析柱中苯扎氯铵残留量的检测方法。苯扎氯铵是离子型化合物,在纯水-乙腈或纯水-甲醇的流动相中,保留时间短且峰型严重拖尾,因此采用反相离子对色谱,以庚烷磺酸钠为离子对试剂,可以改善色谱峰的拖尾现象,使得检测灵敏度有很大提高。本文所建立的方法采用C18柱,流动相为乙腈-0.2mol/L庚烷磺酸钠(含0.1%三乙胺,用磷酸调pH至3.0),210 nm紫外光检测。检测方法操作简单,灵敏度高,且表现出良好的重复性和精密度,适合作为清洗验证单克隆抗体亲和层析中苯扎氯铵残留量的检测,在测定低样品浓度时优势尤为明显。
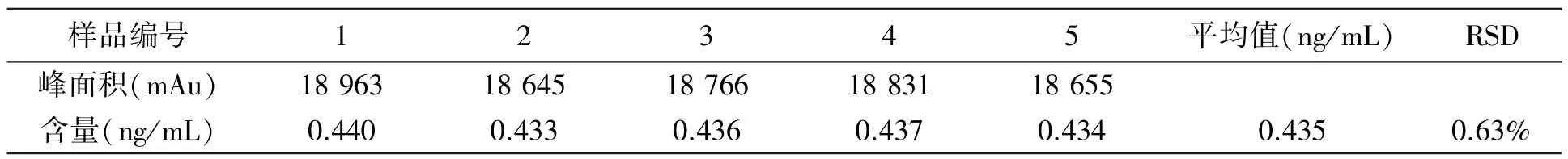
表3 实际样品中苯扎氯铵含量测定结果Table 3 The determination results of benzalkonium chloride in practical samples.
[1] Echan L A, Tang H Y, Ali-Khan N,et al..Depletion of multiple high-abundance proteins improves protein profiling capacities of human serum and plasm[J].Proteomics, 2005, 5(13): 3292-3303.
[2] 张文福.医学消毒学[M].北京:军事医学科学出版社,2002.
[3] 俞 斌,王 峰,栾承莲.微量十二烷基甲基苯甲基氯化铵的测定[J].南京化工大学学报:自然科学版,2001,23(1):61-64.
[4] Technical Committee ISO/TC 91.Surface active agents.Surface active agents⁃detergents⁃determination of cationic⁃active matter content⁃part 2: Cationic⁃active matter of low molecular mass(between 200 and 500) [S].ISO 2871-2:2010.
[5] 周密,段更利,刘 振.复方消毒剂中戊二醛和苯扎氯铵的含量测定方法研究[J].环境与职业医学,2002,19(5):308-310.
[6] Turtles⁃Carou I, Prieto⁃Blanco C, Ldpez⁃Mahfa P, et al..Simultaneous separation of amidoamines and benzalkonium chloride surfactants by capillary zone electrophoresis [J].Chromatographia,2002,56(9-10):605-609.
[7] van Bruijnsvoort M,Rooselaar J,Stern A C,et al..Determination of residues of quaternmy anlnlonium disinfectants in food products by liquid chromatography⁃tandem mass spectrometry [J].J.AOAC Int., 2004,87(4):1016-1020.
[8] Kovács⁃Hadady K, Fábián I.The determination of benzalkonium chloride in eye⁃drops by difference spectrophotometry [J].J.Pharm.Biomed.Anal., 1998, 16(5):733-740.
[9] FeiTer I,Furlong E T.Accelerated solvent extraction followed by on⁃line solid⁃phase extraction coupled to ion trap LC/MS/MS for analysis of benzalkonium chloride in sediment samples[J].Analyt.Chem., 2002, 74(6):1275-1280.
[10] Bull J P, Serreqi A N, Chen T, et al..Development of an immune assay for a quaternary ammonium compound,benzal⁃konium chloride[J].Water Res.,1998,32(12): 3621-3630.
[11] 刘亚强,王大伟.十二烷基二甲基苄基溴化铵离子选择电极的制备与性能[J].化学研究, 2005,16(2):56-59.
[12] 国家药典委员会.中华人民共和国药典(二部)[M].北京:中国医药科技出版社,2010,430-431.
[13] 邹汉法,张玉奎,卢佩章.反相离子对色谱法及其应用[J].色谱, 1992,10(6):329-333.
[14] 叶妙华.苯扎氯铵两种HPLC方法的比较与选择[J].亚太传统医药,2010,(6):23-24.
