假单胞菌中影响碳代谢的三种途径及其调控机制
2014-05-02战嵛华邓志平
谷 伟,战嵛华,邓志平,陆 伟
细菌已经进化出一些复杂的机制来适应环境的改变,碳代谢抑制就是其中之一。最早发现的碳代谢抑制现象是大肠杆菌中糖的分级吸收。碳代谢抑制是细菌重要的全局调控现象,当细菌处于多种碳源同时存在的条件时,碳代谢抑制允许其优先利用优势碳源,同时抑制劣势碳源的利用。碳代谢抑制也决定着细菌生长速度和碳源的选择性吸收,能够优化细菌自身代谢,提高其在自然环境中的竞争力。碳代谢抑制是一个复杂的调控过程,在不同菌种中的分子机制各异。大肠杆菌(Escherichia coli)和枯草芽胞杆菌(Bacillus subtilis)中的碳代谢抑制机制是诱发排斥和cAMP依赖的转录,但这些机制在假单胞菌(Pseudomonas)中并非主要作用。
研究表明,假单胞菌中涉及三种碳代谢抑制的调控系统,分别是CbrAB/Crc系统、CyoABCDE系统及PTSNtr系统。这些系统同时存在,各自独立同时系统间存在联系。这些系统已经在恶臭假单胞菌(P.putica)和铜绿假单胞菌(P.aeruginosa)中得到深入研究。本文将对假单胞菌中的三种涉及碳代谢抑制的调控系统的机制进行阐述。
1 Cbr AB/Crc系统
1.1 Cbr AB/Crc 系统的组成
CbrAB/Crc系统由维持细菌碳氮平衡的双组份CbrA/CbrB、非编码的sRNA以及全局调控子Crc组成。CbrA为感应蛋白,具有磷酸激酶功能,可感知环境因子的信号,并相应地催化自身以及CbrB的磷酸化。CbrB为效应蛋白,它正调控sRNA,如 CrcZ和 CrcY sRNA。 Crc是 CbrAB/Crc系统中的重要组成元件,是一种全局调控子,其表达水平依据于生长条件不同而变化,在后转录水平调控基因的表达[1,2]。 效应蛋白调控的 sRNA与细胞中自由的Crc结合,从而调节Crc在细胞内的水平,而Crc的水平直接影响到劣势碳源代谢基因的表达。
1.2 Cbr AB/Crc 系统的调控机制
Crc最早发现于铜绿假单胞菌中,其调控机制已经在恶臭假单胞菌OCT质粒的烷烃代谢途径中被揭示,即AlkS转录激活子诱导烷烃代谢基因的表达。当烷烃存在时,Crc结合编码AlkS蛋白的mRNA 5′末端,使其转录受到抑制,导致其不能完成翻译,这就使得碳代谢抑制发生[3]。这种机制同样存在于铜绿假单胞菌[4]和恶臭假单胞菌中[5],铜绿假单胞菌中amiE mRNA和恶臭假单胞菌中的 benR mRNA的转录都受到 Crc的抑制。
当Crc在细胞内维持高水平时,Crc能够结合目的基因转录起始位点前的Crc结合位点,从而阻止其转录表达来抑制碳源利用的作用,但当sRNA在细胞内高水平表达时,它们会结合自由的Crc,使得Crc的水平降低,劣势碳源代谢基因的转录抑制被解除。目前发现的一些受Crc抑制的劣势碳源代谢基因包括铜绿假单胞菌中涉及支链氨基酸吸收的基因bkd[6],恶臭假单胞菌中涉及吸收苯甲酸、4⁃羟基苯甲酸和4⁃羟苯基丙酮酸的基因[7],恶臭假单胞菌GPol中涉及烷烃降解的基因,恶臭假单胞菌pWW0质粒中涉及甲苯降解的基因[8]以及假单胞菌 EST1001中涉及石碳酸降解的基因[9]。
CrcZ sRNA的发现将CbrA/CbrB双组份的活性与Crc的功能串联起来。它首先在铜绿假单胞菌中被发现[10],全长 407个 nt,具有 6个特异的Crc识别位点,其表达受CbrA/CbrB双组份的调控。当铜绿假单胞菌在非优势碳源(如甘露醇或乙酰胺)中生长时,CbrA/CbrB双组份正调控crcZ基因并使其高效转录,高水平的CrcZ与自由的Crc结合,从而降低了其在细胞内的水平,Crc对非优势碳源代谢基因表达的抑制被解除,如图1所示[4]。 相反,当琥珀酸作为碳源时,CbrA/CbrB双组份的活性受到抑制,CrcZ在细胞内的水平较低,从而导致Crc蛋白抑制目标mRNA,非优势碳源不能被利用[4]。
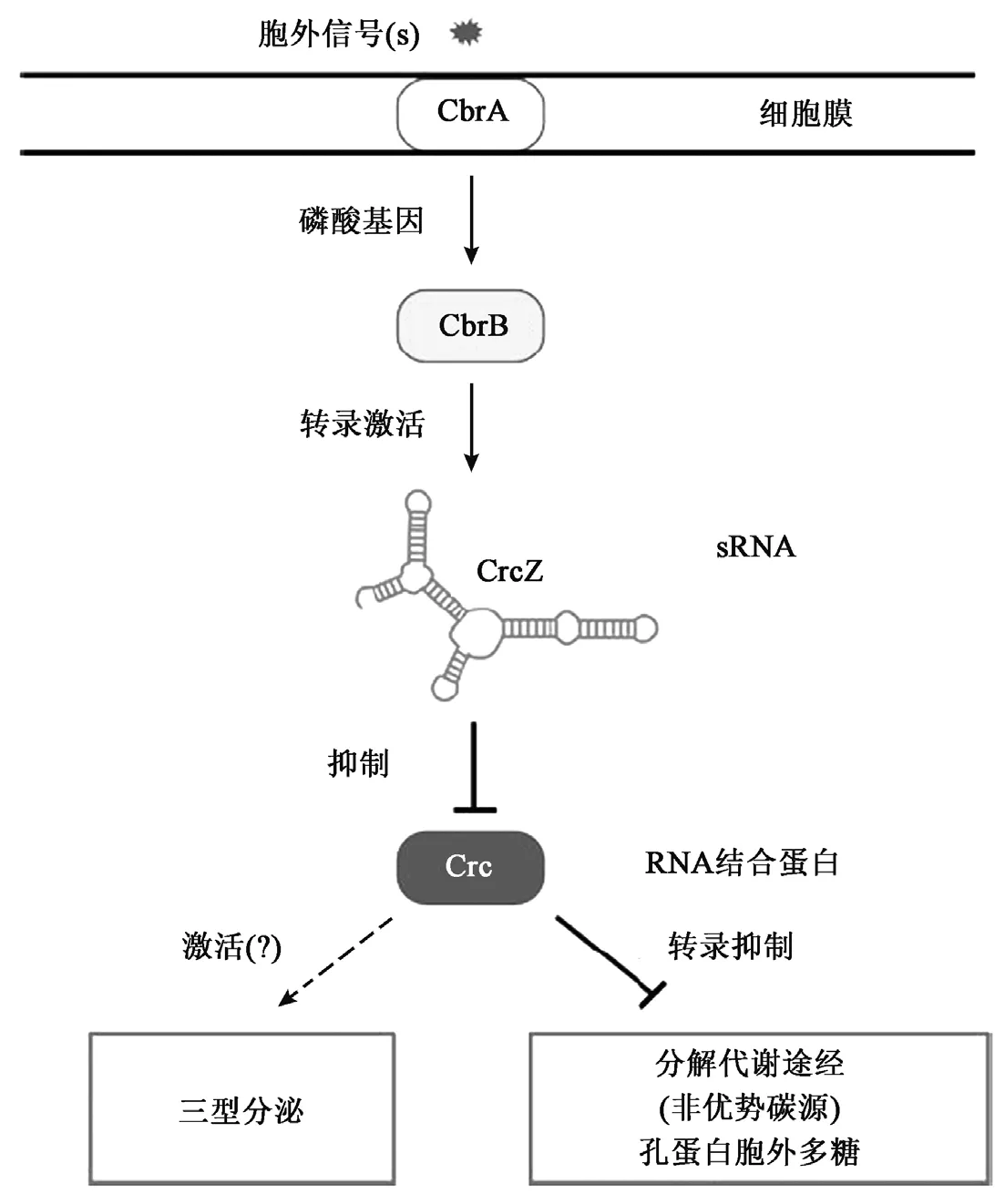
图1 降解物阻遏调控模型[4]Fig.1 Model of catabolite repression control[4].
1.3 Cbr AB/Crc 系统的其他相关蛋白
在恶臭假单胞菌中,除CrcZ sRNA外,还存在着另一个类似的sRNA,命名为CrcY[10]。它们具有相似的序列、二级结构及功能。在碳代谢抑制条件下,CrcZ与CrcY的水平低于非抑制条件下的水平。单独突变crcZ或crcY不会影响碳代谢抑制作用,因为当缺失crcZ或crcY后,剩下的另一个sRNA的表达量会大幅提高,来弥补缺失的sRNA,CrcZ与CrcY的功能互补使得缺失其中一个sRNA并不影响碳代谢抑制的发生[10]。但同时缺失crcZ与crcY后,碳代谢抑制作用明显。在LB培养基中,当细菌处在对数期时,过表达CrcZ或CrcY会明显减弱Crc依赖的碳代谢抑制,表明碳代谢抑制作用与sRNA关系紧密。当优势碳源存在时,CrcZ与CrcY的水平较低,而自由的Crc水平较高,它们能够结合目标RNA,抑制其翻译;相反,当无优势碳源存在时,CrcZ与CrcY的水平明显升高,从而抑制了Crc蛋白,无Crc蛋白结合抑制则目标mRNA可与核糖体结合进行正常翻译。
1.4 Cbr AB/Crc 系统涉及的其他功能
除了对碳代谢途径的控制,CbrAB/Crc信号传导途径还有许多功能。研究发现,在恶臭假单胞菌中,Crc调控一些氨基酸转运基因的表达,使得缬氨酸、亮氨酸、异亮氨酸、酪氨酸等氨基酸吸收基因的表达受到抑制[11]。在完全培养基中生长时,Crc抑制OprB1孔道蛋白表达,阻碍葡萄糖的吸收,同时葡萄糖和果糖的内膜运输蛋白和吸收这些糖所需的基因也被抑制。Crc的缺失导致葡萄糖酸和6⁃磷酸葡萄糖酸的吸收基因表达水平提高,这间接表明葡萄糖的吸收受Crc的抑制[11]。在铜绿假单胞菌中,蛋白质组学分析显示Crc抑制一些孔蛋白的合成,这解释了crc突变株对特定抗生素敏感性增强的原因[12]。同时Crc也抑制蓝色素和毒力因子绿脓菌素的产生,且Crc的缺失诱导编码胞外多糖的基因簇过表达,影响了蹭行运动、III型分泌器和生物质膜的形成[13]。在铜绿假单胞菌中,cbrB的突变导致生物质膜减少[14]。在恶臭假单胞菌中,CBrAB双组份系统不仅控制生长底物的吸收,而且还控制抗逆性和生物质膜的形成[15]。
2 CyoABCDE系统
2.1 CyoABCDE 系统的组成
CyoABCDE系统是由一些编码电子链末端氧化酶的基因簇组成,在恶臭假单胞菌中,存在一个至少含有5个末端转移酶的分支电子传递链,如图2所示[16],这个分支同样存在于铜绿假单胞菌中。(应把电子链上的主要氧化酶分别介绍一下,编码基因,酶的特性,信号传递的顺序等,至少要单独介绍一下cyo)这些氧化酶在氧充足条件下对细胞生长起着重要作用,而且每一个末端氧化酶通常对氧具有不同的亲和力,故具有不同的氧化还原能力,且作为质子泵具有不同的效率。

图2 恶臭假单胞菌中的好氧呼吸链[16]Fig.2 Aerobic respiratory chain of Pseudomonas putida[16].
2.2 CyoABCDE系统的调控机制
CyoABCDE系统通过假单胞菌好氧呼吸链中电子的转移来调控基因的表达[17]。由乳酸、琥珀酸等电子供体通过好氧呼吸链将电子传递给细胞膜上的泛醌,由泛醌传递给Cyo末端氧化酶,再由Cyo通过一系列的信号传导来调控非优势碳源代谢基因的表达,从而影响细菌对碳源的利用,但Cyo调控基因表达的信号尚不清楚。目前只知道在一些细菌中,双组份系统能够感应来自电子传递链的信号,例如处在氧化还原状态的醌或者是末端转移酶中的电子流[18,19]。通过磷酸化转录调控子来产生感应效应,它能够直接激活或抑制基因的表达。假单胞菌中很可能含有接受Cyo末端氧化酶信息的双组份,通过这一过程实现信号传递进而完成基因的调控,但是目前这种假设还没有实验来证明。
Cyo氧化酶基因的表达依据生长条件改变而变化。当细胞处于完全培养基对数期且氧充足条件时,它的表达量高;当氧被限制或细胞进入稳定期时,它的表达量降低[20,21]。 不仅如此,Cyo 氧化酶基因的表达也依赖于碳源。当细菌在能够诱导碳代谢抑制的碳源存在的培养基生长时(如琥珀酸或氨基酸),它的表达量高于细胞在柠檬酸中水平,柠檬酸在恶臭假单胞菌中不能抑制烷烃代谢途径[21]。Cyo不仅是电子传递链的末端氧化酶,而且还是全局调控系统的组成部分,它通过感应和转换电子传递链的活性的信号影响碳氮代谢,所以Cyo的水平可能与碳代谢抑制强度相关。
转录组分析表明,Cyo氧化酶的失活不仅影响烷烃或石碳酸降解基因的诱导表达,而且在丰富培养基中调控100多个基因的表达[20],这也表明Cyo参与了全局调控过程。大部分被Cyo影响的是编码质子泵的基因,包括有机酸、芳香化合物的运输子,各种转录调控子以及电子传递链的组成部分。Crc和Cyo的同源性很低,说明它们处于各自独立的全局调控系统。在恶臭假单胞菌中,Cyo氧化酶的失活影响了一些氨基酸、苯甲酸、果糖和各种有机酸作为碳源的利用以及氨基酸和尿素作为氮源的利用,这进一步表明在假单胞菌中碳氮代谢调控中,Cyo末端氧化酶具有重要作用。
3 PTSNtr系统
3.1 PTSNtr系统的组成与功能
在假单胞菌中,存在一类不涉及糖类摄取的PTS分支系统,叫做PTSNtr系统。它由PtsP、PtsO及PtsN蛋白组成,这些蛋白分别同源于EINtr、NPr和 EIINtr蛋白[22]。
目前PTSNtr系统中各蛋白的研究还还处于起步阶段。研究发现在一些革兰氏阴性菌中,并非pstP基因位于rpoN操纵子内部,而是pstN,且与rpoN 共转录[22,23]。 rpoN 基因编码选择性 δ 因子,它涉及碳源与氮源的代谢、鞭毛的合成和其它功能基因的表达[24]。PstN在PTSNtr系统中极为重要,PstN的磷酸化导致碳代谢抑制的产生。PtsN基因在不同菌中的缺失突变揭示了其在调控中的部分功能。例如在肺炎杆菌(Klebsiella pneumoniae)中,缺失突变pstN的会导致nifH的转录增强,nifH是一种涉及氮代谢的基因[25]。在铜绿假单胞菌中,缺失突变pstN后一些δ54依赖的基因不能被诱导[26]。大肠杆菌中,缺失突变pstN会影响其在含有劣势氮源的培养基中生长,但对含丰富氮源(谷氨酰胺或铵)的培养基影响不大[23]。缺失突变ptsN还会导致大肠杆菌对亮氨酸的生长抑制非常敏感[27]。这些缺失突变pstN后的现象都表明PTSNtr系统提供了一个细菌碳氮吸收调控连接。
3.2 PTSNtr系统的调控机制
PTSNtr系统通过系统内的磷酸基团转移来实现对碳源的调控,磷酸基团从PEP转移到PtsP上,然后再磷酸化PtsO,最终将磷酸基团转移到PtsN[22,28]。 与涉及糖类摄取的 PTS 系统不同的是,未磷酸化的PtsN也参与了一些代谢基因的调控,但具体调控机制尚不清楚。PTSNtr系统也没有相当于EIIBCA糖类转移系统的膜组分,它的磷酸化过程也不像糖类PTS系统那样依赖于磷酸基团的流动。目前无证据表明PtsN能够向底物转移磷酸基团,PtsP/PtsO/PtsN蛋白功能可能只传导信号,而磷酸化的PtsN提供调控信号,见图 3[16]。
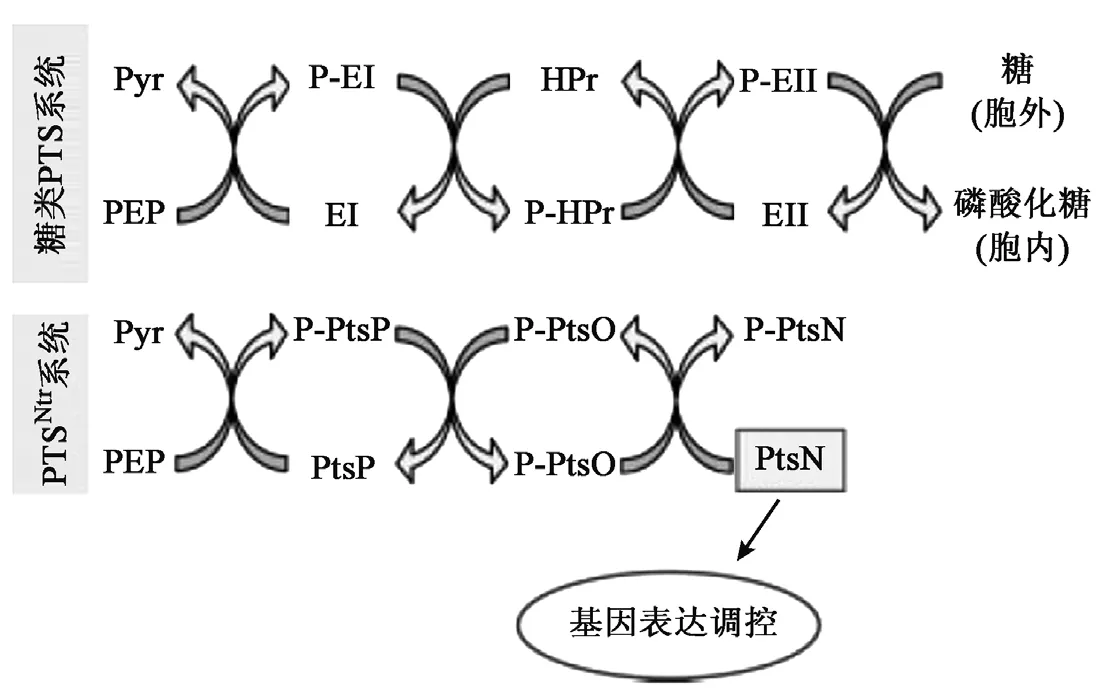
图 3 PTSNtr系统[16]Fig.3 The PTSNtr system[16].
近期研究也发现了一些能与PTSNtr系统中PtsN蛋白相互作用的新靶标,这些发现扩展了PTSNtr系统的调控范围。比如,大肠杆菌中未磷酸化的PtsN能与亲和力较低的钾离子转运子TrkA相互作用,抑制TrkA对钾离子的吸收[27]。此外,未磷酸化的PtsN也能刺激编码亲和力较高的钾离子转运子KdpFABC的基因表达[29]。这些发现表明PTSNtr系统可能在维持钾离子体内平衡方面发挥重要作用。PTSNtr系统还会影响一些响应碳代谢抑制信号的基因的表达。在恶臭假单胞菌pWW0质粒中,δ54依赖的Pu启动子涉及甲苯和二甲苯的吸收。当甲苯或二甲苯存在时,效应转录激活子XylR能够诱导Pu启动子转录。但当同时存在甲苯和某些生理信号(如葡萄糖或琥珀酸)时,XylR对Pu启动子转录的诱导作用会被减弱,诱导作用将下调到一定范围内[30,31]。 然而,PtsN的失活会使葡萄糖或琥珀酸对Pu启动子的抑制减弱[32,33],但不会影响葡萄糖的消耗。 这一现象表明减少糖类运输而能够间接影响由PtsN的失活产生的抑制减弱。
磷酸化对PTSNtr系统的调控作用十分重要。研究发现当ptsO基因失活后,无论培养环境中是否存在葡萄糖,Pu启动子的活性都被抑制。ptsO基因失活对Pu启动子影响与ptsN基因失活后相反[34]。这些都证明了磷酸化在PTSNtr系统调控中的重要性。ptsN与ptsO双突变株的表型与rpoN突变株的表型相同,即葡萄糖对Pu的抑制减弱[35]。PtsO可以作为磷酸基团的受体,因为定点突变PtsO蛋白保守的His残基会使其失活。所以磷酸化的PtsO可能需要葡萄糖对Pu调控的抑制。PtsN的活性也可能受 PtsO调控,因为PtsO可以作为PtsN去磷酸化过程中磷酸基团的受体。当葡萄糖存在时,PtsO接受磷酸基团,从而增加非磷酸化的PtsN的水平,这一过程可能是对Pu抑制的调控。而当葡萄糖耗尽时,磷酸基团会被转移回PtsN[34]。目前对引起PtsN的磷酸化或去磷酸化的生理信号还不完全了解。恶臭假单胞菌中存在一些葡萄糖代谢的诱导物,如2⁃酮基⁃3⁃脱氧⁃6⁃磷酸葡萄糖(KDPG),它对于葡萄糖调控的代谢抑制很重要,推测其可能直接或间接地影响了 PtsN 的磷酸化[35,36]。
4 讨论
在假单胞菌中,碳代谢抑制是一个复杂的调控过程,涉及到 CbrAB/Crc、CyoABCDE及 PTSNtr三种系统。它们同时存在,相互独立,可能也存在着联系。研究表明恶臭假单胞菌中可能存在接受Cyo末端氧化酶信息的双组份,而CbrAB/Crc系统中就包含维持细菌碳氮平衡的双组份CbrA/CbrB,它们之间可能存在联系来协同产生碳代谢抑制,但这种假设尚无实验来证明。而PTSNtr系统与糖转运PTS系统之间存在交集,PTSNtr系统中非磷酸化的PtsN也参与基因的调控,这些可能把PTSNtr系统对代谢的调控与前两个系统联系起来。细胞内可能存在三个系统同时发挥作用,协同调控碳代谢抑制。三个系统之间联系对于碳代谢抑制的研究意义重大,对其进行深入研究,会进一步提高我们对碳代谢抑制调控机制的认识。
[1] Moreno R,Rojo F.The target for the Pseudomonas putida Crc global regulator in the benzoate degradation pathway is the BenR transcriptional regulator[J].J.Bacteriol., 2008, 190:1539-1545.
[2] Zimmermann T, Sorg T, Siehler S Y, et al..Role of Acineto⁃bacter baylyi Crc in catabolite repression of enzymes for aromatic compound catabolism[J].J.Bacteriol., 2009, 191:2834-2842.
[3] Moreno R,Ruiz⁃Manzano A,Yuste L,et al. The Pseudomonas putida Crc global regulator is an RNA binding protein that inhibits translation of the AlkStranscriptional regu⁃lator[J].Mol.Microbiol., 2007, 64: 665-675.
[4] Sonnleitner E, Abdou L, Haas D.Small RNA as global regula⁃tor of carbon catabolite repression in Pseudomonas aeruginosa[J].Proc.Natl.Acad.Sci.USA, 2009, 106: 21866-21871.
[5] Moreno R,Rojo F.The target for the Pseudomonas putida Crc global regulator in the benzoate degradation pathway is the BenR transcriptional regulator[J].J.Bacteriol., 2008, 190:1539-1545.
[6] Hester K L, Madhusudhan K T, Sokatch J R.Catabolite re⁃pression control by crc in 2xYT medium is mediated by postt⁃ranscriptional regulation of bkdR expression in Pseudomonas pu⁃tida[J].J.Bacteriol., 2000, 182: 1150-1153.
[7] Morales G, Linares J F, Beloso A, et al.The Pseudomonas putida Crc global regulator controls the expression of genes from several chromosomal catabolic pathways for aromatic compounds[J].J.Bacteriol., 2004, 186: 1337-1344.
[8] del Castillo T, Ramos J L, Rodríguez⁃Hervá J J, et al..Con⁃vergent peripheral pathways catalyze initial glucose catabolism in Pseudomonas putida: genomic and flux analysis[J].J.Bac⁃teriol., 2007, 189: 5142-5152.
[9] Putrins M, Tover A, Tegova R, et al..Study of factors which negatively affect expression of the phenol degradation operon pheBA in Pseudomonas putida[J].Microbiology, 2007, 153:1860-1871.
[10] Moreno R, Fonseca P, Rojo F.Two small RNAs, CrcY and CrcZ,act in concert to sequester the Crc global regulator in Pseudomonas putida, modulating catabolite repression[J].Mol.Microbiol., 2012, 83: 24-40.
[11] Moreno R, Martínez⁃Gomariz M, Yuste L, et al..The Pseudo⁃monas putida Crc global regulator controls the hierarchical as⁃similation of amino acids in a complete medium:evidence from proteomic and genomic analyses[J].Proteomics, 2009, 9:2910-2928.
[12] Linares JF, Moreno R, Fajardo A, et al.The global regulator Crc modulates metabolism, susceptibility to antibiotics and vir⁃ulence in Pseudomonas aeruginosa[J].Environ.Microbiol.,2010, 12: 3196-3212.
[13] O’Toole G A, Gibbs K A, Hager P W, et al..The global car⁃bon metabolism regulator Crc is a component of a signal trans⁃duction pathway required for biofilm development by Pseudo⁃monas aeruginosa[J].J.Bacteriol., 2000, 182: 425-431.
[14] Müsken M, Di Fiore S, Dötsch A, et al.Genetic determinants of Pseudomonas aeruginosa biofilm establishment[ J].Microbi⁃ology, 2010, 156: 431-441.
[15] Amador C, Canosa I, Govantes F, et al..Lack of CbrB in Pseudomonas putida affects not only amino acid metabolism but also different stress responses and biofilm development[J].En⁃viron.Microbiol., 2010, 12: 1748-1761.
[16] Rojo F. Carbon catabolite repression in Pseudomonas:optimizing metabolic versatility and interactions with the envi⁃ronment[J].FEMSMicrobiol.Rev., 2010, 34: 658-684.
[17] Richardson D J.Bacterial respiration: a flexible process for a changing environment[J].Microbiology,2010,146(Pt3):551-571.
[18] Georgellis D, Kwon O, Lin E C.Quinones as the redox signal for the Arc two⁃component system of bacteria[J].Science,2001, 292: 2314-2316.
[19] Elsen S, Swem L R, Swem D L, et al..RegB/RegA, a highly conserved redox⁃responding global two⁃component regulatory system[J].Microbiol.Mol.Biol.Rev., 2004, 68: 263-279.
[20] Morales G, Ugidos A, Rojo F.Inactivation of the Pseudomonas putida cytochrome o ubiquinol oxidase leads to a significant change in the transcriptome and to increased expression of the CIO and cbb3⁃1 terminal oxidases[ J].Environ.Microbiol.,2006, 8: 1764-1774.
[21] Dinamarca M A,Aranda⁃Olmedo I,Puyet A,et al..Expression of the Pseudomonas putida OCTplasmid alkane deg⁃radation pathway is modulated by two different global control signals: evidence from continuous cultures[J].J.Bacteriol.,2003,185: 4772-4778.
[22] Powell B S, Court D L, Inada T, et al..Novel proteins of the phosphotransferase system encoded within the rpoN operon of Escherichia coli.Enzyme IIANtraffects growth on organic nitrogen and the conditional lethality of an eratsmutant[J].J.Biol.Chem., 1995, 270: 4822-4839.
[23] Deutscher J, Francke C, Postma P W.How phosphotransferase system⁃related protein phosphorylation regulates carbohydrate metabolism in bacteria[J].Microbiol.Mol.Biol.Rev., 2006,70: 939-1031.
[24] Cases I, López J A, Albar J P, et al..Evidence of multiple regulatory functions for the PtsN (IIANtr) protein of Pseudo⁃monas putida[J].J.Bacteriol., 2001, 183: 1032-1037.
[25] Merrick M J,Coppard J R.Mutations in genes downstream of the rpoN gene(encoding s54) of Klebsiella pneumoniae affect expression from s54⁃dependent promoters[J].Mol.Microbiol.,1989,3(12):1765-1775.
[26] Jin S,Ishimoto K, Lory S.Nucleotide sequence of the rpoN gene and characterization of two downstream open reading frames in Pseudomonasaeruginosa[J].J.Bacteriol., 1994,176(5):1316-1322.
[27] Lee CR, Koo B M, Cho SH, et al.Requirement of the de⁃phospho⁃form of enzyme IIANtrfor derepression of Escherichia coli K⁃12 ilvBN expression[J].Mol.Microbiol., 2005, 58:334-344.
[28] Rabus R, Reizer J, Paulsen I, et al..Enzyme INtrfrom Esche⁃richia coli.A novel enzyme of the phosphoenolpyruvate⁃depend⁃ent phosphotransferase system exhibiting strict specificity for its phosphoryl acceptor, NPr[J].J.Biol.Chem., 1999, 274:26185-26191.
[29] Lüttmann D, Heermann R, Zimmer B, et al.Stimulation of the potassium sensor KdpD kinase activity by interaction with the phosphotransferase protein IIANtrin Escherichia coli[J].Mol.Microbiol., 2009, 72: 978-994.
[30] Holtel A, Marqués S, Möhler I, et al.Carbon source⁃depend⁃ent inhibition of xyl operon expression of the Pseudomonas putida TOL plasmid [J].J.Bacteriol., 1994, 176: 1773-1776.
[31] Duetz W A, Marqués S, de Jong C, et al..Inducibility of the TOL catabolic pathway in Pseudomonas putida (pWW0)growing on succinate in continuous culture:evidence of carbon catabolite repression control[ J].J.Bacteriol., 1994, 176:2354-2361.
[32] Cases I, Pérez⁃Martín J, de Lorenzo V.The IIANtr(PtsN) pro⁃tein of Pseudomonas putida mediates the C source inhibition of the δ54⁃dependent Pu promoter of the TOL plasmid[J].J.Biol.Chem., 1999, 274: 15562-15568.
[33] Aranda⁃Olmedo I, Ramos J L, Marqués S.Integration of signals through Crc and PtsN in catabolite repression of Pseudo⁃monas putida TOL plasmid pWW0[J].Appl.Environ.Micro⁃biol., 2005, 71: 4191-4198.
[34] Cases I, Velázquez F, de Lorenzo V.Role of ptsO in carbon⁃mediated inhibition of the Pu promoter belonging to the pWW0 Pseudomonas putida plasmid[J].J.Bacteriol., 2001, 183:5128-5133.
[35] del Castillo T, Ramos J L, Rodríguez⁃Hervá J J, et al..Con⁃vergent peripheral pathways catalyze initial glucose catabolism in Pseudomonas putida: genomic and flux analysis[J].J.Bac⁃teriol., 2007, 189: 5142-5152.
[36] Kim J, Yeom J, Jeon CO, et al..Intracellular 2⁃keto⁃3⁃deoxy⁃6⁃phosphogluconate is the signal for carbon catabolite repression of phenylacetic acid metabolism in Pseudomonasputida KT2440[J].Microbiology, 2009, 155: 2420-2428.
