隐丹参酮对老年大鼠脑缺血再灌注损伤的保护作用及机制研究
2014-05-02黄菁菁冯美江
黄菁菁,冯美江
(南京医科大学第二附属医院 老年医学科,江苏 南京 210011)
隐丹参酮对老年大鼠脑缺血再灌注损伤的保护作用及机制研究
黄菁菁,冯美江*
(南京医科大学第二附属医院 老年医学科,江苏 南京 210011)
目的:探讨隐丹参酮(cryptotanshinone,CTN)对老年大鼠脑缺血再灌注损伤的保护作用及其可能机制。方法:Longa法制作大鼠中动脉缺血再灌注损伤模型。将SD大鼠随机分为正常对照组(CTL)、缺血再灌注组(I/R)、隐丹参酮低剂量治疗组(CTN1)(2.5mg/kg)和隐丹参酮高剂量治疗组(CTN2)(5mg/kg),对各组大鼠进行神经功能缺损评分,测定脑梗死体积,测定Caspase-3蛋白表达,检测SOD活性、GSH-Px、MDA及NO的含量变化,实时荧光定量PCR法检测脑组织中miR-210的表达。结果:与缺血再灌注组相比,隐丹参酮组可显著降低大鼠神经功能损伤评分、减少脑梗塞体积、显著降低脑组织内氧自由基的生成,提高SOD活性,并降低miR-210的表达, miR-210的表达量由(12.29±2.14)降至(6.91±0.53)(P<0.05)。结论:隐丹参酮对老年大鼠脑缺血再灌注损伤有明显的保护作用,其机制可能部分与减轻氧化应激损伤、抗凋亡和降低miR-210的表达有关。
隐丹参酮;缺血再灌注;氧自由基;miR-210
缺血性中风约占全部中风的3/4,是中老年人致死、致残的主要疾病之一,一半以上的存活者遗留偏瘫、失语、智能减退等残疾,且其发病率呈逐年上升趋势。所以提高缺血性中风治愈率、降低致残率已成为当今医学领域面临的重要课题之一。
氧稳态的维持是大脑正常工作的基础,而脑缺血缺氧性损伤所产生的自由基会对神经元细胞膜造成损伤[1]。自由基是机体氧化反应中产生的有害化合物,具有强氧化性,可损害机体的组织和细胞,进而引起慢性疾病及衰老效应。
microRNA(miRNA) 是由20~24个核苷酸组成的内源性非编码单链RNA。研究发现,miRNA也参与了生物机体氧稳态的调节,其中研究较多的miR-210就是一种在缺氧状态下,由缺氧诱导因子1α(hypoxia induced factor 1α,HIF-1α)诱导产生的miRNA[2]。缺血的成年大鼠脑皮质中miR-210表达明显上调,通过激活Notch1信号通路,调节缺血后的血管再生[3],而抑制miR-210表达可有效抑制缺氧诱导的血管形成与ephrin-A3的表达[4]。此外,外周血中的miR-210 有可能作为一个新的敏感的急性脑缺血临床诊断与预后判断的生物标记[5]。
隐丹参酮是从唇形科植物丹参根中提取分离出的二萜醌类有效单体。研究表明隐丹参酮对谷氨酸诱导的皮层神经元凋亡具有保护作用[6],但其对老年大鼠缺血再灌注损伤后的保护作用及对氧自由基和miR-210表达的影响尚未见报道。本研究采用栓塞大鼠大脑中动脉并再灌注模型,在2011年9月—2012年11月期间观察隐丹参酮对局灶性脑缺血再灌注损伤大鼠脑组织的保护作用,并对其可能作用机制进行探讨。
1 材料与方法
1.1 动物及试剂
Sprague-Dawley(SD)大鼠购自南京医科大学实验动物中心;隐丹参酮购自南京替斯艾么中药研究所;氯化三苯基四氮唑(TTC)购自北京化学试剂公司;SOD、GSH-Px、MDA和NO检测试剂盒购自南京建成生物工程研究所;用于RNA提取的Trizol为Invitrogen公司产品;反转录试剂盒、用于荧光定量聚合酶链反应(real time polymerase chain reaction, RT-PCR)的SYBR试剂为TaKaRa公司产品;miR-210、U6的反转录和PCR引物由上海生工生物有限公司提供;Caspase-3和β-actin的抗体为美国cell Signaling公司产品。
1.2 动物分组及模型制作
成年雄性SD大鼠48只,20月龄,体重300~400g,随机分为正常对照组(CTL)、缺血再灌注组(I/R)、隐丹参酮低剂量组(CTN1)(2.5mg/kg)和隐丹参酮高剂量组(CTN2)(5mg/kg),每组各12只。参照Longa法,制作大鼠缺血再灌注模型,缺血时间2h,再灌注72h。在缺血期间及再灌注后2h保持体温在(37±0.5)℃。CTN组分别在术后60min、24h及48h,将不同剂量的隐丹参酮溶于生理盐水中,行3次腹腔注射。根据以往相关研究,选取注射剂量分别为2.5mg/kg和5mg/kg[7]。CTL组和I/R组每次腹腔注射等量的生理盐水。
1.3 神经功能缺损评分
按照Zea Longa和Bederson的方法[8],对各组动物于苏醒后6h内进行评分:0分:无神经缺损症状;1分:右前肢不能完全伸直;2分:向右侧旋转;3分:向右侧倾倒;4分:不能自己行走或昏迷。
1.4 脑梗死体积的测定
每组随机选择6只大鼠,断头取脑,弃去嗅球、小脑及低位脑干。置-20℃冰箱中冷冻20min,距额极3mm切片,每片厚2mm,放入1.0%TTC水溶液中,37℃孵育30min,随即放入10.0%甲醛溶液避光保存24h,用计算机图像解析程序, 分别将所有脑切片图像扫描, 测定脑梗死区的体积。
1.5 Western blot 测定Caspase-3蛋白的表达
将梗死区组织研碎后加入裂解液匀浆,10 000r/min(4 ℃)离心10 min,分离上清液并使用BCA法测定蛋白总浓度后分装,保存于-20℃。取30μg蛋白样品100 ℃沸水加热5 min,在10.0% SDS-PAGE胶上进行电泳。蛋白质经电泳分离后,转移到PVDF膜(Amersham, Piscataway, NJ,USA)上。转移后取出印迹膜,漂洗后放入盛有用TBS配成的5.0%脱脂奶粉液内,放在摇床上封闭印迹膜1h,然后与Caspase-3抗体(1∶1 000)和β-actin抗体(1∶1 000)在4℃轻摇孵育过夜。漂洗后与辣根过氧化物酶标记的二抗(1∶5 000)(美国Bio-Rad公司)在常温下孵育30min,ECL法显色。蛋白条带使用Alpha Imager 2200 (Alpha Innotech,San Leandro,CA,USA)进行分析,以β-actin作为内参。
1.6 SOD含量测定
组织称重匀浆后,3 000×g离心15min,留取上清液。SOD的活性测定按照SOD测定试剂盒的使用说明进行。将500μL样品加于酶标板孔底部,用封板膜封板后置 37℃温育30min。小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30s后弃去,如此重复5次,拍干。每孔加入酶标试剂50μL,空白孔除外,温育并洗涤。每孔加入显色剂A50μL,再加入显色剂B50μL,轻轻震荡混匀,37℃避光显色15min,最后每孔加终止液50μL,终止反应。以空白孔调零,450nm波长依序测量各孔的吸光度。
1.7 GSH-Px含量测定
GSH-Px的活性测定按照GSH-Px测定试剂盒的使用步骤进行。依次加入检测缓冲液、待测样品和检测工作液,混匀。加入4μL 15mmol/L过氧化物试剂溶液后,反应开始。25℃条件下,使用培养板振荡器混匀。酶标仪测定A340,计算每毫克蛋白含GSH-Px的量。
1.8 MDA含量测定
MDA的含量测定按照试剂盒说明书进行操作。在离心管内加入0.1mL匀浆液、裂解液或PBS等适当溶液作为空白对照,加入0.1mL上述不同浓度标准品用于制作标准曲线,加入0.1mL样品用于测定;随后加入0.2mL MDA检测工作液。混匀后,100℃加热15min。水浴冷却至室温,1 000×g室温下离心10min。取200μL上清加入到96孔板中,随后用酶标仪在532nm测定吸光度,计算每毫克蛋白含MDA的量。
1.9 NO含量测定
NO的含量测定按照试剂盒说明书进行操作。取出Griess Reagent I和II,使回复室温。用待测样品所用溶液稀释标准品,按50μL/孔,在96孔板中加入标准品及样品;分别在各孔中加入室温Griess Reagent I和Griess Reagent II,在550 nm 测定吸光度。按公式计算可得每毫克蛋白含NO的量。
1.10 总RNA提取
按Trizol 试剂说明书抽提样品总RNA。DEPC 处理水溶解RNA,分光光度计测定260nm 及280nm处吸光度值,确定RNA溶液浓度和纯度。取2~5μg总RNA,以1.0%琼脂糖变性凝胶电泳检测RNA 的完整性。
1.11 逆转录反应和荧光定量PCR
用AMV逆转录酶(中国大连TaKaRa公司)和与其互补的反义引物逆转录成cDNA。再取2μg cDNA加入20μL Real-time PCR体系,扩增条件为:95℃预变性15min;95℃ 15s,60℃ 1min,测定荧光强度,重复40个循环;72℃延伸7min。使用U6为实验内参。miR-210 上游: 5’-ACACTCCAGCTGGGCUGUGCGUGUGACAGC-3’,下游:5’-CTC AACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGTCAGC CGC-3’;U6 上游: 5’-CTCGCTTCGGCA GCACA-3’,下游: 5’-AACGCTTCACGAATTTGCGT- 3’。
1.12 统计学分析
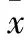
2 结果
2.1 神经功能缺损评分及脑梗死体积
与I/R组比较, CTN2组隐丹参酮可以明显降低实验大鼠的神经功能缺损评分(P<0.05),而CTN1组改善不明显。CTL组未见梗死。与I/R组比较,CTN1、CTN2均可减小实验大鼠的脑梗死体积 (P<0.05)。见表1。
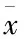
表1 四组大鼠行为学评分及脑梗死体积测定 (±s)
注:与CTL组比较,aP<0.05。
2.2 Caspase-3蛋白表达
使用western blot测定脑组织中caspase-3的含量。结果显示,脑组织缺血再灌注后caspase-3的含量显著增加,而隐丹参酮可以明显减少实验大鼠脑中caspase-3的表达(P<0.05),其中CTN2组比CTN1组更加显著减少了caspase-3表达(P<0.05)。
2.3 SOD活性、GSH-Px、MDA及NO含量
SOD具有抗氧化应激损伤作用,而GSH-Px是防止氧化性损伤的一种重要酶。缺血再灌注后与对照组相比,SOD的活性及GSH-Px含量明显降低,但使用隐丹参酮后,两者含量均有上升。在缺血再灌注过程中,抗氧化酶的减少会导致自由基产物的增加,从而可能对神经元细胞造成损伤。在缺血再灌注损伤时MDA和NO的含量明显升高,而使用隐丹参酮后,MDA和NO的含量有所下降,更进一步证明隐丹参酮可以抑制或者减少自由基的生成。
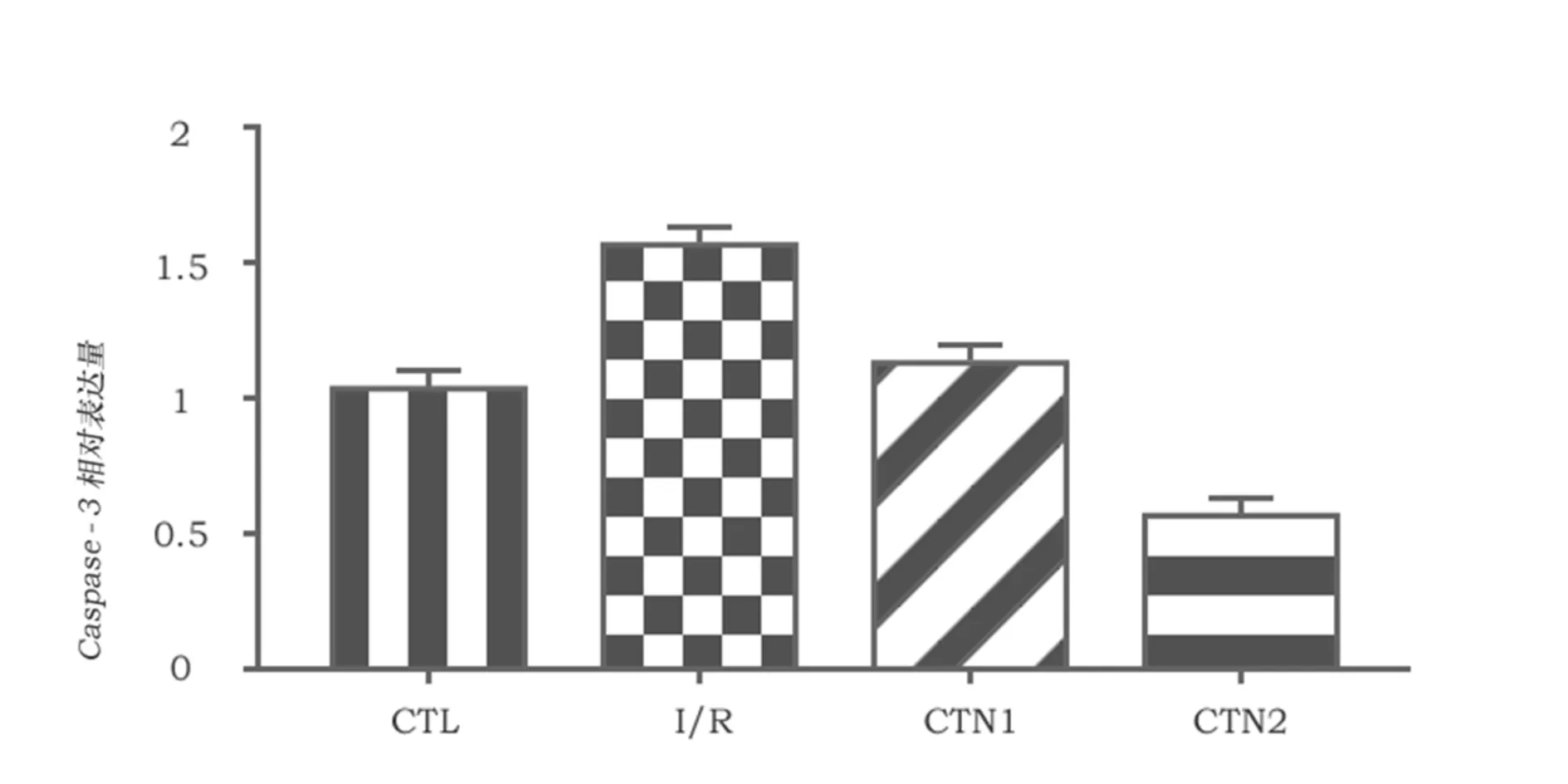
图1 四组大鼠脑组织中Caspase-3蛋白的表达
表2 四组大鼠脑组织SOD、GSH-Px、MDA、NO的含量 (±s)
2.4 miR-210的表达
CTL组、I/R组、CTN1和CTN2组中miR-210的表达水平分别为:5.51±0.41、12.29±2.14、9.13±1.16、6.91±0.53。与CTL组相比,I/R组miR-210的表达显著升高(P<0.05),CTN组则无明显差异(P>0.05)。CTN组相比I/R组,miR-210的含量显著降低(P<0.05),且高剂量组相较与低剂量组更有效,说明隐丹参酮参与了对miR-210表达的调节。

图2 miR-210的表达
3 讨论
缺血性中风又称脑梗死,多是在动脉粥样硬化基础上,由各种原因引起脑动脉血流量减少或中断,导致局部脑组织缺血、缺氧,从而引起相应神经功能受损[8]。现代医学证实,脑梗死发病机制极其复杂,其治疗也尚未有重大突破,延长脑细胞缺氧耐受时间、改善脑组织缺血缺氧状态成为治疗关键,而中医药在此方面具有独特优势。
隐丹参酮是从唇形科植物丹参根中提取分离得到的一种中药单体,具有抗氧化和抗衰老功能。研究发现,隐丹参酮可影响缺血再灌注后Bax和Bcl-2等相关凋亡基因的表达,对治疗冠心病、心绞痛和心肌损害具有一定疗效[9]。隐丹参酮还可抑制谷氨酸诱导的皮层神经元凋亡[10]。本研究表明,隐丹参酮可以显著降低缺血再灌注后老年大鼠的神经功能缺损行为学评分,降低大鼠脑梗死体积,显著减轻了缺血再灌注对大鼠脑组织的损伤,证明隐丹参酮具有一定的脑保护作用。
Caspase家族是一组存在于胞质溶胶中的结构上相关的半胱氨酸蛋白酶。在缺血性损伤中,Caspase-3的活化可以导致DNA的断裂和神经元的凋亡[11]。目前认为,Caspase-3是凋亡过程中最主要的蛋白酶,是细胞凋亡蛋白酶反应的必经之路[12]。本研究发现,隐丹参酮可显著减少脑缺血再灌注所诱导的Caspase-3表达上调,说明隐丹参酮具有一定的抗凋亡作用。
自由基是机体氧化反应中产生的有害化合物, ROS和NO是其中主要的自由基。在通常情况下,脑组织受到抗氧化酶(如SOD和GSH-Px)和抗氧化物质(如维生素C、维生素E和巯基蛋白)的保护,可以及时清除有害自由基[13]。但在缺血缺氧的情况下,自由基的产生会急剧增加,当所增加的自由基超过机体的清除能力时就会导致氧化应激损伤。多聚不饱和脂肪酸是对ROS最敏感的化合物,其降解会导致MDA的增加,而后者又可以破坏细胞膜基质的流动性,从而破坏细胞膜表面蛋白的结构与功能,甚至可影响某些基因的表达。与之相应的是,NO的增加会导致线粒体中细胞色素c的释放,激活细胞的凋亡信号通路,导致细胞死亡[14]。我们的实验结果表明,在缺血再灌注过程中,SOD活性的大幅度降低伴随着MDA和NO含量的迅速增加;而隐丹参酮则可部分逆转这一过程。
在缺氧状态下,miR-210 依赖于缺氧诱导因子1α( hypoxia induced factor 1α,HIF-1α)而诱导产生[15]。研究表明,在大鼠的缺血脑组织中,miR-210与Ephrin-A3 (EA3)和Neuronal Pentraxin 1 ( NPX1) 的mRNAs的3’非翻译区连接,增强 EA3 和NPX1蛋白的表达,调控脑缺血后血管的新生过程[16]。此外,抑制miR-210的表达可减少细胞中超氧化物的产生,而缺氧时生成的超氧化物也是造成神经损伤的一个重要来源[17-18]。我们研究发现,隐丹参酮可显著降低脑缺血再灌注损伤所诱导的miR-210表达上调。
本研究选取了2.5mg/kg及5mg/kg两个不同剂量的隐丹参酮进行疗效研究,研究发现,除了神经功能缺损行为学评分低剂量组无统计学意义外,其它各项指标差异均有统计学意义,且高剂量组疗效更佳。故考虑神经功能缺损行为学评分在低剂量组无意义可能与样本数量较小,存在一定的实验误差有关。当然,由于实验经费等限制,未设阳性对照药,但从近些年来其它隐丹参酮相关文献获知, 5mg/kg的隐丹参酮在脑缺血再灌注损伤中有一定疗效,亦可佐证其药物治疗的可行性。
总之,我们的研究结果表明,隐丹参酮对老年大鼠的缺血再灌注损伤可发挥确切的神经保护作用,其机制可能部分与其抗氧化应激、抗凋亡及降低miR-210的表达上调有关。但隐丹参酮对缺血再灌注后miR-210的具体调节机制及效应仍有待今后进一步研究。
[1] HOSSAIN MA, RUSSELL JC, O'BRIEN R, et al. Neuronal pentraxin 1: a novel mediator of hypoxic-ischemic injury in neonatal brain[J].J Neurosci,2004(24):4187-4196.
[2] PULKKINEN K, MALM T, TURUNEN M, et al. Hypoxia induces microRNA miR-210 in vitro and in vivo ephrin-A3 and neuronal pentraxin 1 are potentially regulated by miR-210[J].FEBS Lett,2008(582):2397-2401.
[3] LOU YL, GUO F, LIU F, et al. miR-210 activates notch signaling pathway in angiogenesis induced by cerebral ischemia[J].Mol Cell Biochem,2012(370):45-51.
[4] RINK C, KHANNA S. MicroRNA in ischemic stroke etiology and pathology[J]. Physiol Genomics, 2011(43):521-528.
[5] ZENG L, LIU J, WANG Y, et al. MicroRNA-210 as a novel blood biomarker in acute cerebral ischemia[J].Front Biosci(Elite Ed),2011(3):1265-1272.
[6] LONGA EZ, WEINSTEIN PR, CARLSON S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989(20):84-91.
[7] SONG M, HANG TJ,ZHANG Z,et al. Effects of the coexisting diterpenoid tanshinones on the pharmacokinetics of cryptotanshinone and tanshinone IIA in rat[J].Eur J Pharm Sci,2007(32):247-253.
[8] SIMARD JM, KENT TA, CHEN M,et al.Brain oedema in focal ischaemia: molecular pathophysiology and theoretical implications[J].Lancet Neurol,2007(6):258-268.
[9] 张代富,阮长武,刘中民,等.丹参对大鼠急性心肌缺血再灌注时心肌细胞凋亡相关基因表达的影响[J].上海医学, 2003, 26 (9): 669-670.
[10] ZHANG F, ZHENG W, PI R, et al. Cryptotanshinone protects primary rat cortical neurons from glutamate-induced neurotoxicity via the activation of the phosphatidylinositol 3-kinase/Akt signaling pathway[J]. Exp Brain Res, 2009(193):109-118.
[11] 李超,伏圣博.细胞凋亡研究进展[J].世界科技研究与发展, 2007,29(3):45-53.
[12] MILES AN, KNUCKEY NW. Apoptotic neuronal death following cerebral ischaemia[J]. J Clin Neurosci, 1998(5):125-145.
[13] TISCHKAU SA, COHEN JA, STARK JT, et al. Time-of-day affects expression of hippocampal markers for ischemic damage induced by global ischemia. Exp Neurol, 2007(208):314-322.
[14] YIN KJ, DENG Z, HUANG H, et al. miR-497 regulates neuronal death in mouse brain after transient focal cerebral ischemia[J].Neurobiol Dis, 2010(38):17-26.
[15] LIU CG, CALIN GA, MELOON B, et al. An oligonucleotide microchip for genome-wide microRNA profiling in human and mouse tissues[J].Proc Natl Acad Sci U S A, 2004(101):9740-9744.
[16] KIM J, INOUE K, ISHII J, et al. A MicroRNA feedback circuit in midbrain dopamine neurons[J].Science,2007(317):1220-1224.
[17] SELBACH M, SCHWANH USSER B, THIERFELDER N, et al. Widespread changes in protein synthesis induced by microRNAs[J].Nature,2008(455):58-63.
[18] DHARAP A, BOWEN K, PLACE R, et al. Transient focal ischemia induces extensive temporal changes in rat cerebral microRNAome[J]. J Cereb Blood Flow Metab, 2009(29):675-687.
(责任编辑:宋勇刚)
Protective Effects and Possible Mechanism of Cryptotanshinone in Cerebral Ischemia-reperfusion Injury in Aged Rats
Huang Jingjing,Feng meijiang*
(Department of Geriatrics, The Second Affiliated Hospital of Nanjing Medical University, Jiangsu 210011,China)
Objective:To explore the protective effects and possible mechanism of cryptotanshinone in cerebral ischemia-reperfusuion injury in aged rats.Methods:A model of rat cerebral ischemia-reperfusion (I/R) injury based on Longa method was made. The Sprague-Dawley(SD)rats were randomLy divided into normal control group(CTL), I/R group, cryptotanshinone Low-dose(CTN1) treatment group (2.5mg/kg) and cryptotanshinone High-dose(CTN2)treatment group (5mg/kg). Neurological deficit score was evaluated when rats were allowed to awaken at 6h after operation in each group. Cerebral infarct volume was also determined. Western blot was used to detect the expression of Caspase-3 protein level. The activity of SOD and the concentration of GSH-Px, MDA and NO in brain tissues were performed. The expression of miR-210 was detected by real-time PCR. Results:Compared with the I/R group, CTN group significantly reduced the neurological deficit scores and infarct volumes. The decrease of oxygen free radical production and the increase of SOD activity in the brain tissues were also observed. Real-time PCR showed that the expression of miR-210 was significantly reduced after cryptotanshinone treatment. CTN2 group ’s expression of miR-210 reduced from (12.29±2.14) to (6.91±0.53)(P<0.05). Conclusion:Results indicated that cryptotanshinone could protect against cerebral I/R injury in aged rats, which may partly attribute to alleviating the oxidative stress injury,anti-apoptosis and the reduction of miR-210 expression.
Cryptotanshinone; Ischemia-reperfusion Injury; Oxygen Free Radicals; miR-210
2014-08-02
江苏省自然科学基金资助项目(BK2008480)
黄菁菁(1983-),女,硕士,南京医科大学第二附属医院主治医师,研究方向为老年医学。
冯美江(1968-),男,南京医科大学第二附属医院主任医师,研究方向为老年医学。Email: mjfeng416@aliyun.com。
R285
A
1673-2197(2014)23-0004-04
