丹参酮ⅡA磺酸钠注射液不良反应的流行病学特征研究
2014-05-02王洪锐翁浩聪
王洪锐 ,李 东 ,翁浩聪 ,岳 萱
(1.广东省深圳市宝安区福永人民医院,广东 深圳 518103;2.暨南大学第二临床医学院·广东省深圳市人民医院,广东 深圳 518020;3.广东岭南职业技术学院,广东 广州 510663;4.广东药学院,广东 广州 510224)
丹参性微寒、味苦,具有活血祛瘀、养血安神、调经止痛、凉血消痈的功效,是临床常用的活血化瘀类中药。丹参我国传统医学中应用最早且最广泛的药物之一,经过长期的临床应用,对丹参的临床效果和适应证有了全面的认识。丹参也是采用现代医学方法进行研究的主要中药之一,经过化学、药理学以及医学等多学科工作者的共同努力,对丹参的生物学、化学、药理学以及临床效果等多方面进行了全面的研究和探索,取得显著进展并开发出一批以丹参为主要成分的临床应用制剂[1]。丹参的化学成分主要分为脂溶性成分和水溶性成分两大类。对丹参有效成分的研究早期主要集中在脂溶性成分方面,现已得到40余种化合物,其中丹参酮ⅡA是丹参脂溶性成分中的代表,表现出多种生物活性。研究表明,丹参酮ⅡA具有多种药理作用,能对抗心肌急性缺氧损伤、抗心律失常、改善血管平滑肌功能,对缺血-再灌注引起的组织损伤具有防护作用。丹参酮ⅡA通过对肿瘤细胞的杀伤、诱导分化和凋亡、抑制侵袭和转移的机制发挥抗肿瘤作用,此外还具有神经保护作用、抑菌抗炎作用[1-4]。
丹参酮ⅡA磺酸钠(tanshinoneⅡAsodium sulfonat,TanⅡA)是丹参酮ⅡA经磺化成盐后所得到的产物,水溶性明显增强,可将其直接制成注射液,目前已批准上市并用于治疗各类冠心病心绞痛、心肌缺血及老年肺原性心脏病[1]。随着其临床使用量的明显增加,与之相关的不良反应文献报道也有所增多。但其药品说明书上不良反应项无具体内容记载,仅在“注意事项及禁忌”项下作了有关提示,如“对本品过敏者禁用”等。在临床应用过程中,也常见该药药品不良反应(ADR)的发生。为全面了解TanⅡA不良反应发生的特点、规律,笔者采用文献学研究方法对2000年至2013年间国内正式出版的专业期刊文献中所报道的TanⅡA不良反应进行调查分析,以期为临床合理用药提供参考。
1 资料和方法
1.1 检索策略
采用计算机检索技术对“中国医院知识仓库(CHKD)”期刊全文库和“万方数据”数据库中收录的国内公开发行的期刊、会议论文、学位论文进行高级复合检索。以“丹参酮ⅡA磺酸钠”“丹参酮ⅡA”为检索词作第1次检索,在第2次检索时应分别用“不良反应”“副作用”“安全性”“致”“诱导”“引起”等为检索词在前面检索的结果中进行检索,获取TanⅡA不良反应病例报告及临床观察报告和文献综述。检索时间跨度为1994年至2013年。
1.2 文献筛选
纳入标准:使用TanⅡA后发生的不良反应病例对照研究、临床对照研究、病例报告(个案或系列病例报告),不限患者人口学资料、原发疾病及是否合并用药,均纳入分析范围。以完整的TanⅡA不良反应病例临床报道的个案和群案为有效资料。
排除标准:重复发表的文献、综述性文献、不良反应因果关系不明确或难以判断的文献予以排除;未报告基本的人口学资料、用药方案以及缺少临床观察或临床观察不完整的病例不采用;动物实验研究也排除在外。
1.3 数据处理与统计分析
根据筛选出的文献资料,描述性分析TanⅡA不良反应的发生情况,按患者性别、年龄、原患疾病、过敏史,不良反应累及器官或系统、临床表现、严重程度、评价与转归、给药方案(剂量、联合用药等)等数据,计算不良反应总例数与构成比。
2 结果
2.1 文献检索与筛选结果
实际检索到与TanⅡA不良反应的相关文献出版时间为2002年至2013年,实际检索时间跨度为12年。实际检索与其不良反应报道有关的期刊21种,包括药学杂志9种,医学杂志10种,护理杂志2种。根据文献检索策略及筛选标准,共收集到符合要求的文献22篇,发生不良反应病例27例。首篇公开报道的TanⅡA不良反应2例,发生时间为2003年,文献发表于2005年《海峡药学》第2期。文献出版时间与不良反应报道例数统计见图1。
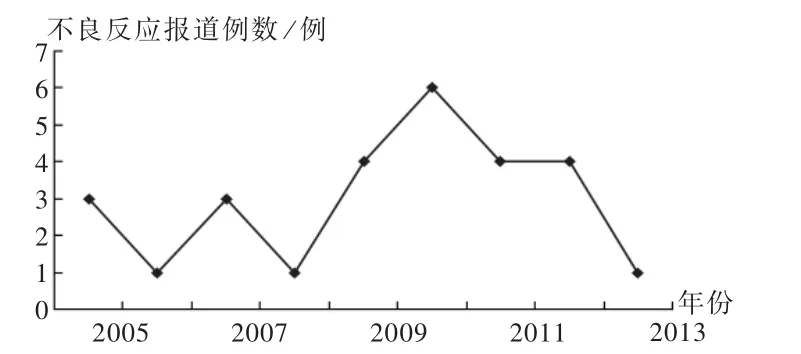
图1 2005年至2013年TanⅡA不良反应相关文献出版时间趋势图
2.2 患者情况
年龄与性别:27例患者中,年龄最小25岁,最大80岁,平均(55.92 ±14.30)岁。其中男 13 例(48.15% ),平均年龄(54.62 ±15.71)岁;女 14 例(51.85% ),平均年龄(57.14 ± 13.34)岁。患者年龄、性别分布及构成比见表1和图2。

表1 患者性别与年龄的频数分布(n=27)

图2 患者性别与年龄分布直方图
原患疾病:27例患者中,原患疾病主要为高血压、冠心病、心绞痛、骨折、糖尿病,具体见表2。

表2 患者原发疾病分布(n=65)
2.3 不良反应情况
因果关系、不良反应类型及转归:根据国家食品药品监督管理总局药品不良反应评价中心关于不良反应因果关系判断标准进行分析评价。27例不良反应中,因果关系为肯定6例(22.22% ),很可能 21 例(77.78% );转归为不良反应症状完全治愈 5 例(18.52% ),好转并符合出院标准 22 例(81.48% );按严重程度分类,一般不良反应 17例(62.96%),新的不良反应 3例(11.11%),新的严重不良反应 2例(7.41%),严重不良反应 5例(18.52% );无死亡病例,危及生命 6 例(22.22% )。对原患疾病的影响方面,27例不良反应对原患病疾影响均不明显,没有导致原患疾病病程延长、病情加重和产生后遗症的病例。
给药方案及联合用药:26例(96.29%)有给药方案的记录,均为静脉滴注,每日1次给药。单次给药剂量为30 mg 2例,40mg 8例,50 mg 5例,60 mg 8例,70 mg 1例,80mg 2例;40~80 mg共24 例(92.31% )。23 例(85.19% )有溶剂记录,其中 0.9% 氯化钠注射液 10 例(43.48% ),5% 葡萄糖注射液 13 例(56.52% );溶剂用量均为 250~500 mL。8例(29.63%)有滴速记录,其中每分钟20滴、30滴各 1例,40滴 3例,45滴 1例,50滴 2例。4例(14.81%)有联合用药记录,其中包括给予TanⅡA前静脉滴注甲氯酚酯,同时口服5-单硝酸异山梨酯缓释片,联用头孢哌酮舒巴坦、硝苯地平控释片、缬沙坦胶囊、精蛋白生物合成人胰岛素和阿卡波糖,同时口服氢溴酸西酞普兰(喜普妙)各1例。
发生时间:25例(92.59%)病例记录了发生不良反应时间,其中 17例(68.00%)为用药第 1天,最短为用药后 2 min;6例(24.00% )为用 药后 1~3 d;1 例(4.00% )为用药后 5 d;1 例(4.00%)为用药后42 d,此为最长时间。另外,不良反应发生在用药后 10 min及以内 8 例(32.00% ),30~40 min 4 例(16.00% )。涉及系统或器官及临床表现参照《WHO药品不良反应术语集》对累及器官或系统进行分类,见表3。
3 讨论
TanⅡA注射液是中药丹参中脂溶性成分提取物丹参酮ⅡA经磺化处理所得到的纯度较高的一种药物,已获得了国家化学药品批准文号。根据拟订的检索策略及筛选标准,共收集到符合要求的文献22篇,TanⅡA不良反应27例,时间跨度为12年。从公开文献报道的不良反应分析,相比其他由丹参提取物制备而成的中药注射剂,TanⅡA的不良反应相对要少[5],但由于临床使用TanⅡA的人群基数难以估算,故其总体不良反应发生率不明确。鉴于其在特定人群中的不良反应也可造成严重后果,应引起临床医生和患者的注意[6]。

表3 不良反应的分类及临床表现统计
文献所报道的27例患者中,男女性别比例基本无差异,与文献[7-8]分析类似;年龄分布主要集中在50~70岁人群,合计占55.56%。由于统计分析的TanⅡA不良反应样本数量有限,且根据该药的适应证,其临床应用对象主要是中老年人,使用频度高于其他年龄人群,因此使用TanⅡA所引起的ADR与患者的性别、年龄是否存在必然的关系有待观察。但是,由于老年人器官、系统的生理机能存在不同程度的衰退以及对药物的代谢能力减弱,药物剂量、浓度的个体差异较大,同时其对药物的敏感性和耐受性不同于青壮年,较易引起不良反应,故在用药时一定要注意老年人群不良反应的监测。
TanⅡA不良反应以变态反应为主,主要累及皮肤及其附件(约占30%),主要表现为皮疹、皮肤瘙痒以及注射给药局部反应;全身性损害以及循环系统反应主要表现为过敏性休克、寒战、发热、胸闷、血压下降等,而23例全身性反应中6例(26.09%)表现为过敏性休克,值得引起临床注意。国家食品药品监督管理总局《药品不良反应信息通报(第45期)》[9]曾提醒应警惕香丹注射液的严重不良反应,其主要症状涉及到全身性损害、循环系统,以过敏样反应和过敏休克为主。虽然两者不属于同一类药品,但TanⅡA衍生于丹参提取物,易水解游离出丹参酮ⅡA,基于过敏反应发生的原理,两者在不良反应的表现上可能存在相似之处。TanⅡA的不良反应经对症处理和治疗后,症状减轻或消失,对原患疾病几无影响,也未产生明显后遗症。虽然收集的文献中没有死亡病例报道,但有6例(22.22%)不良反应仍危及生命,这提示对于 TanⅡA的严重不良反应,应密切监测、及时救治,以免造成严重后果。
27例不良反应中,25例准确记录了不良反应发生时间,其中17例(68.00%)发生于用药第 1天,且主要(48.00% )发生于静脉给药30 min以内。临床使用TanⅡA时,应注意首次给药特别是给药30min内患者的反应。
依据药品说明书分析临床用药方案,收集的文献中用药剂量、浓度以及给药频率均在药品说明书要求范围以内,各剂量、浓度发生的不良反应数量也无明显差异。此外,由于记录滴注速度的报道少,从有限的数据中难以明确用药剂量、浓度以及滴注速度与不良反应发生率的关系。
联合用药特别是同瓶混合联用,是导致中药注射剂不良反应高发的一个重要因素。所收集的文献中只有4例报道了联合用药情况,且仅2例为接瓶联用其他注射药物,并没有记录TanⅡA与其他药物同瓶混合联用的情况。TanⅡA与很多注射剂药品有配伍禁忌,与其他药物输液配伍后,易发生氧化或聚合反应,或由于配伍引起 pH变化而析出,形成不溶性微粒[8,10]。
TanⅡA为丹参的提取物,存在自身成分复杂以及在药材炮制、提取等过程中有效单体纯度不够,易引起过敏介质产生的特点。此外,丹参酮ⅡA经磺化成盐后增加了水溶性,然而在药品贮存、使用过程中可能有不溶性的丹参酮ⅡA磺酸析出,产生的微粒进入体内,易导致变态反应[2]。因此在临床使用中,一定要严格按照药品说明书的规定进行溶解、稀释,尽量不与其他药物配伍使用。
《中国国家处方集》(CNF1 2010)记载的 TanⅡA适应证为“用于冠心病心绞痛心肌梗死的辅助治疗”[11]。从27例患者的原患疾病分析,对症用药仅7例(占25.93%),绝大多数为超适应证用药。大量文献以及国家不良反应信息通报警示,超适应证用药是导致不良反应的重要因素。在如何避免香丹注射液严重不良反应的警示中,国家食品药品监督管理总局要求医护人员要遵照《中药注射剂临床使用基本原则》,严格按照药品说明书,严格掌握功能主治和禁忌证,权衡患者的治疗利弊,谨慎用药[9]。
笔者建议:药品生产企业应尽快完善药品说明书的相关安全性信息;加强临床合理用药的宣传,确保将产品的安全性信息及时传达给患者和医生;开展相应的药品安全性研究,优化生产工艺,提高产品质量标准,以避免或减少不良反应的发生。
参考文献:
[1]杜冠华,张均田.丹参现代研究概况与进展[J].医药导报,2004,23(6):355-360.
[2]石 远,姜同英,王思玲.丹参酮ⅡA及其制剂开发[J].世界临床药物,2007,28(7):439-443.
[3]张萌涛,钱亦华,唐安琪.丹参酮ⅡA药理作用的研究进展[J].医学综述,2010,16(17):2 661-2 664.
[4]蔡丽萍,习志刚,杨 红.丹参酮的药理作用和临床研究进展[J].广东药学院学报,2008,24(3):321-324.
[5]王之羽,王友群,李 明.302例丹参注射液临床不良反应分析[J].中国药房,2010,21(32):3 035-3 037.
[6]江尚先.郑丽英.丹参酮ⅡA磺酸纳注射液致过敏性休克[J].药物不良反应杂志,2007,9(1):61.
[7]柳海琛,柳海环.18例丹参酮ⅡA磺酸钠注射液不良反应的临床特点分析[J].中国中西医结合杂志,2013,33(9):1 287-1 289.
[8]孔飞飞,谭兴起,郭良君,等.丹参酮ⅡA磺酸钠注射液不良反应文献分析[J].中国药房,2011,22(35):3 339-3 341.
[9]国家食品药品监督管理总局.药品不良反应信息通报(第45期)警惕香丹注射液的严重不良反应[EB/OL].(2012-03-23).http://www.sfda.gov.cn/WS01/CL0078/70155.htmL.
[10]张克斌.丹参酮ⅡA磺酸钠注射液引起不良反应原因分析[J].中国药师,2011,14(9):1 357-1 358.
[11]《中国国家处方集》编委会.中国国家处方集·化学药品与生物制品卷[M].北京:人民军医出版社,2010:44.
