基于Profinity eXact系统的可溶性egfp表达和纯化
2014-04-29冯金洪愉黄芬井申荣曾韦银
冯金 洪愉 黄芬 井申荣 曾韦银

摘要:为研究Profinity eXact系统在蛋白表达及纯化过程中的效果,利用PCR扩增绿色荧光蛋白基因egfp,定向克隆至表达栽体pPAL7上,转化BL21(DE3),荧光显微镜下观察诱导后的重组菌;取超声破碎的上清挂柱纯化,紫外下检测纯化后egfp发出荧光的特性,Western blot分析其免疫反应性。结果表明:诱导后的重组菌pPAL7-egfp/BL21(DE3)在紫外光下能够发出绿色荧光;一步纯化后的egfp蛋白同样也能在紫外激发下发出绿色荧光,同时egfp蛋白能和特异性抗体结合,具有良好的免疫反应性。实验结果说明Profinity eXacl系统对于可溶性蛋白的表达和纯化,方法操作简单、快捷,具有很好的应用价值。
关键词:纯化;Profinity eXact系统;egfp蛋白;原核表达
中图分类号:Q789
文献标识码:A
文章编号:1007-7847(2014)04—0310-05
蛋白纯化作为后基因组学时代研究蛋白质功能、结构最常用的手段,已被国内外研究人员所广泛运用。随着纯化技术的发展,逐渐形成了今天运用最为成熟和普遍的亲和纯化系统,如常用的以GST、Flag、His标签为基础的亲和纯化,即将目的蛋白与纯化标签进行融合表达,通过与标签结合的层析介质来纯化目的蛋白。然而,标签蛋白作为融合蛋白的一部分,其大小、带电荷性可能对目的蛋白的表达、成熟、分泌造成影响,其免疫原性可能对目的蛋白的功能研究带来屏障。因此,对于蛋白质的结构、功能等研究,我们期望纯化出不含标签的目的蛋白,以避免亲和标签可能存在的干扰。然而,如果在亲和纯化后,再对标签进行剪切则使得下游操作更为复杂。
美国Bio-Rad公司开发的Profinity eXact纯化系统是一套新型的亲和层析表达纯化工具,包含了表达载体和纯化介质,借助融合表达的亲和标签与同化在填料上突变的丝氨酸蛋白酶结合,并在卤素离子(F-或Cl-)或者叠氮离子(N3-)的作用下能精确地诱发亲和标签和目的蛋白之间的剪切,从而导致Profinity eXact标签被固定的蛋白酶滞留在纯化介质上,仅预期的目的蛋白从层析柱上洗脱,虽然该洗脱蛋白的N端存在多克隆位点处的一两个氨基酸,但基本不影响洗脱蛋白的下游应用。为了验证该系统,本文将egfp基因作为工具,通过该系统实现了蛋白egfp的高效表达,并获得了不带标签的功能性高纯度egfp蛋白。
1材料与方法
1.1材料
1.1.1菌株与质粒
原核克隆宿主E.coli DH5α;原核表达宿主E.coli BL21 (DE3);质粒pEGFP-N2购自美国Clon-tech公司;表达质粒载体pPAL7购自美国Bio-Rad公司。
1.1.2试剂与纯化柱
DNA聚合酶、dNTP、DNA Maker DL 5000购自天根生化科技(北京)有限公司;限制性核酸内切酶Spe I,Xho I及T4 DNA连接酶购自宝生物工程(大连)有限公司;一抗:鼠抗GFP单抗(天德悦北京生物科技有限公司),HRP标记的二抗:羊抗鼠IgG抗体(美国KPL公司);质粒小量快速提取试剂盒、DNA胶回收试剂盒购自北京庄盟生物技术有限公司;氯仿、乙醇、氟化钠等试剂均为国产分析纯;1mL空填装柱购自碧云天生物科技有限公司;Profinity eXact protein purification填料购自美国Bio-Rad公司。
1.1.3培养基及缓冲液
LB培养基:5g酵母粉、10g蛋白胨、10g氯化钠、蒸馏水1000mL (固体培养基添加2%的琼脂),121℃灭菌30min。
氨苄抗生素的浓度为:100mg/L。
平衡缓冲液:0.1mol/L磷酸钠,pH7.2;洗脱缓冲液:0.1mol/L磷酸钠,0.1mol/L氟化钠混合液,pH7.2;再生缓冲液:0.1mol/L磷酸。
1.2方法
1.2.1目的片段扩增及重组质粒构建
以pEGFP-N2为模板,设计引物(表1),并在上游引物5'端处添加酶切位点Spe I及保护性碱基,下游引物5'端处添加终止密码子TAA、酶切位点Xho I及保护性碱基,PCR扩增绿色荧光基因egfp。PCR扩增条件:预变性温度及时间为93℃ 10min;解链温度及时间为93℃ 30s;退火温度及时间为55℃ 30s;延伸温度及时间为72℃40s;循环数为35;最后72℃ 10min。扩增得到的产物经1%琼脂糖凝胶电泳进行纯化回收,再通过Spe I和Xho I双酶切、胶回收得到具有黏性末端的目的片段。提取质粒pPAL7,同样用Spe I和Xho I进行双酶切、胶回收得到具有黏性末端的载体骨架,与前面所获得的具有相同黏性末端的目的片段进行连接,转化至DH5α中,通过双酶切及测序进行鉴定。提取阳性重组质粒转化至BL21(DE3)中以进行下一步诱导表达。
1.2.2目的蛋白的诱导表达及鉴定
选取鉴定后的阳性重组菌pPAIJ7-egfp/BL21(DE3),接种于5mL含青霉素的液体LB培养基中,37℃摇床培养过夜,复苏菌种,按l%比例转接至10mL含青霉素的LB液体培养基中,37℃摇床培养至OD600约0.4左右加入终浓度为1mmol/L的IPTG开始诱导,16℃继续培养至OD600约为l左右,取诱导前及诱导后细菌超声破碎(300W,工作时间5s,间隔时间10s,工作30次,4℃,12000r/min离心10min)后上清和沉淀,加入等体积的2xSDS-PAGE上样缓冲液,混匀后煮沸10min,取10μL上样,进行SDS-PAGE电泳观察。同时,取诱导后菌液于荧光显微镜下观察,所用激发光波长为488nm,发射光波长为507nm。
1.2.3目的蛋白的纯化及Western-blot分析
诱导后10mL菌液离心,弃上清、平衡缓冲液重悬沉淀,超声破碎,离心取上清。10倍柱体积的平衡缓冲液对层析柱进行平衡处理后,以每滴间隔15s的流速将上清进行挂柱,收集流穿液;用3倍柱体积的平衡缓冲液漂洗柱子,收集漂洗液;用1倍柱体积的洗脱液进行洗脱,收集洗脱液;用2倍柱体积的平衡液置换残留的洗脱液,最后用1倍柱体积的再生液再生柱子,收集再生液。取纯化各阶段所收集样品进行SDS-PAGE电泳分析。同样,取洗脱过程所获的样品SDS-PAGE电泳后,根据蛋白Marker的大小,截取PAGE胶进行转膜,PVDF膜经10%脱脂奶粉4℃封闭过夜后用1:2000比例稀释的一抗37℃摇床孵育lh,用含0.1%吐温20的PBS缓冲液漂洗3次.每次15min,然后用1:15000比例稀释的二抗37℃摇床孵育1h,用上述的缓冲液漂洗6次,每次10min,最后,加入底物,暗室X-光片显影观察分析。
2结果
2.1目的片段及载体的双酶切回收
以质粒pEGFP-N2为模板扩增获得egfp基因,用限制性核酸内切酶Spe I和Xho I双切,胶回收获得约720bp目的片段;质粒pPAL7经限制性核酸内切酶Spe I和Xho I双切,胶回收得到约5900bp载体骨架,如图2所示。
2.2pPAL7-egfp的构建及鉴定
将上述双切回收的egfp与pPAL7连接转化DH5α,获得重组质粒pPAL7-egfp,经Spe I和Xho I双切鉴定如图3A。重组质粒测序证明序列正确。鉴定正确重组子转化至BL21(DE3),重组子的PCR鉴定结果如图3B,表明重组表达菌构建成功。
2.3目的蛋白的诱导表达及荧光观察
SDS-PAGE图如图4所示:重组菌pPAL7-egfp/BL21(DE3)诱导后较诱导前,36kD左右出现明显增粗的蛋白条带。诱导菌超声破碎后的12000r/min离心上清与沉淀中,同样可见相同大小的蛋白条带,由此可知目的蛋白有包涵体和可溶性两种表达形式。
取少量诱导后pPAL7-egfp/BL21(DE3)滴于载玻片上,覆加盖玻片,在荧光显微镜下观察,能观察到明显的荧光现象,说明egfp蛋白得以正确表达,结果如图5所示。
2.4目的蛋白的纯化
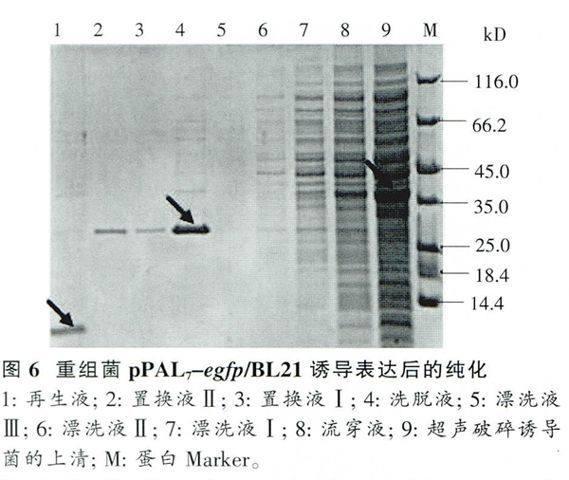
重组菌经诱导表达后,超声破碎,离心分离上清进行挂柱,收集纯化各阶段的样品进行SDS-PAGE电泳观察(图6)。在上清样中出现融合有标签的目的蛋白,在洗脱液中出现剪切掉标签的目的蛋白,大小与理论值相符,再生液中出现标签蛋白,大小与理论值相符。
2.5纯化后蛋白的荧光观察及Western blot分析
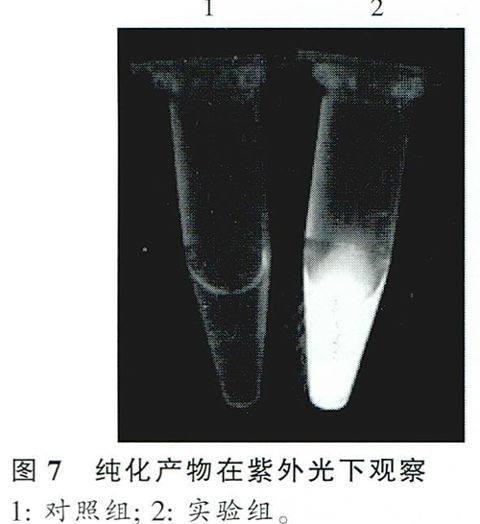
取纯化后所获得的洗脱样在紫外光下直接进行观察,实验组中能观察到荧光,对照组(pPAL7/BL21诱导后的超声上清)中无荧光,如图7所示。同样取洗脱样进行SDS-PAGE电泳,根据蛋白Marker选择性地截取25~35kD(egfp大小约为27kD)蛋白胶进行转膜,湿转后的PVDF膜经脱脂奶粉封闭,一抗、二抗孵育后,加底物于暗室X-胶片显影观察,结果在对照组泳道未检测到荧光条带,实验组泳道检测到了荧光条带即egfp蛋白的存在,结果如图8所示。
3讨论
利用亲和标签纯化蛋白作为最常用的蛋白质纯化手段,直接通过标签与层析介质上配体的结合特性,理论上就可纯化出任何带有标签的目的蛋白。目前国内外应用较多的亲和标签有GST、Flag、MBP、His等,以应用最为成熟的His标签为例,虽然很多蛋白的分离都来源于此纯化方法,但是这些蛋白的纯化条件都是建立在大量摸索经验之上的,对于一些初次研究的外源蛋白,前先,研究者需要反复摸索各缓冲液中盐离子、咪唑等浓度;其次,以His(多为连续的6个组氨酸)为标签,其类似构象经常出现在宿主杂蛋白中,这直接影响了目的蛋白的纯度;最后,考虑到纯化的终极目的是获取天然的目的蛋白,因此使用MBP、GST等标签时,还需要切除相应标签,这极大地加重了纯化后的操作。
Profinity eXact系统的作用原理是将外源目的基因插入至表达载体pPAL7标签下游的多克隆位点,诱导表达就能产生带有标签的目的蛋白,固定在纯化介质上的突变丝氨酸蛋白酶能特异性地与标签结合,致使目的蛋白被纯化介质所截留,宿主的本底蛋白则通过漂洗过程去除,最后加入氟离子或叠氮离子就能精准地诱发亲和标签与目的蛋白之间的剪切,目的蛋白被洗脱,而标签仍结合在柱上。纯化后,通过再生液将标签洗下再生纯化介质,以备循环使用。此纯化系统将蛋白纯化和标签去除高效地整合至一个过程,从而一步解决了亲和纯化中,洗脱蛋白转变至目的蛋白的障碍,简化了纯化流程,提高了工作效率。
本实验中,我们选取了大小适中,利于检测活性的egfp蛋白作为外源蛋白,进行表达纯化。诱导后的细菌,在紫外光的激发下发出绿色荧光,说明融合标签并不影响egfp蛋白产生绿色荧光的特性。从诱导表达图可看出,带有融合标签的egfp蛋白以可溶性和包涵体两种形式存在,考虑到可溶性形式较包涵体更接近蛋白的天然特性,因此本研究中取可溶性的融合蛋白进行挂柱纯化,整个过程由于绿色荧光蛋白在自然光下存在颜色,因此能够直接观测到纯化介质对融合蛋白的特异性捕获,以及切割后洗脱下的egfp蛋白。蛋白电泳结果显示该纯化操作在洗脱液获得了高纯度的egfp,再生液中仅含有标签蛋白。纯化获得的egfp在紫外光下能产生强烈的绿色荧光。免疫印迹实验表明,egfp具有良好的免疫反应性,能够被特异性抗体识别。这些都说明纯化获得的egfp蛋白保留了其天然蛋白的生物学特性。在接下来的实验中,我们还证实了该填料经再生可反复使用,且具有很好的稳定性和重复性。
总之,通过我们的实验说明,Profinity eXact系统作为一种新型亲和纯化手段,极大地简化了蛋白纯化步骤,缩短了纯化时间,具有较高的应用价值。
