微囊藻毒素生物合成基因及其功能研究进展
2014-04-29黄鑫魏晓璐冯悦张阿梅夏雪山刘丽
黄 鑫 魏晓璐 冯 悦 张阿梅 夏雪山 刘 丽
摘 要:水体富营养化加剧,导致了蓝藻水华在世界范围内频发。蓝藻产生的微裳藻毒素是最常见的一种藻毒素,对人类和动物造成了很大的危害甚至导致死亡。微囊藻毒素经非核糖体合成途径由多肽合成酶合成。对微囊藻毒素的结构与性质、微囊藻毒素合成基因的功能及其生物合成、微囊藻毒素的分子生物学检测技术进行了评述,对未来的研究方向进行了展望。
关键词:微囊藻毒素;蓝藻:基因;检测
中图分类号:Q89
文献标识码:A
文章编号:1007-7847(2014)05--0445-08
随着社会的发展,生活及工农业生产中大量含氮、磷的废污水未经有效处理被排入水体中,导致水体富营养化,蓝藻等藻类成为水体中的优势种群,大量繁殖形成水华,蓝藻水华暴发带来的微囊藻毒素(microcystin, MC)污染已经成为全球关注的环境问题。微囊藻毒素造成了众多中毒事件,对人类和动物的健康造成了很大的威胁。深入认识微囊藻毒素,了解微囊藻毒素的结构、编码基因及其合成,有助于对微囊藻毒素进行有效的监测,对微囊藻毒素的合成进行干预,从而在监测、控制和消除等方面有效解决微囊藻毒素的危害问题,对水体环境的保护具有重要的现实意义。
1
微囊藻毒素的结构与性质
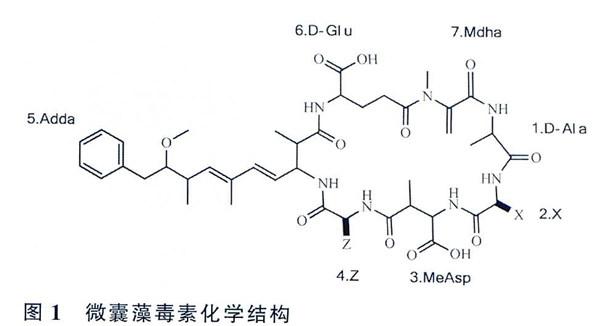
微囊藻毒素是一种单环七肽肝毒素,一般结构为环(D-Ala-X-D-MeASp/D-Asp-Z-Adda—D-Glu-Mdha)(图1)。分子结构1位上是D-丙氨酸(D-Ala);2、4位上的X和Z分别代表不同的氨基酸;3位上是D-赤-β-甲基天冬氨酸(MeAsp);5 位上是(2S,3S,8S,9S) -3-氨基—9—甲氧基一2,6,8-3甲基-10-苯基-4,6-_烯酸(Adda);6位上是D一谷氨酸(D-Glu);7位上是N一甲基脱氢丙氨酸(Mdha)。其中.Adda是一种特殊氨基酸,是毒素活性表达所必需的基团,其结构改变会导致毒性减弱或丧失。因为结构中存在可变氨基酸,所以微囊藻毒素有多种异构体,目前发现的已经超过90种。其中最普遍、毒性较大的是MC-LR、RR和YR(L、R、Y分别代表亮氨酸、精氨酸和酪氨酸)。
微囊藻毒素对蛋门磷酸酶1和2A的活性具有抑制作用及多种毒效应。肝脏是微囊藻毒素主要的靶器官,微囊藻毒素会引起肝脏炎症、肝损坏甚至坏死,另外其还与肿瘤促进作用有联系。腹腔注射小鼠实验发现MC-LR半致死率(lethal dose 50% LD50)为50 μg/kg, MC-RR和MC-YR毒性相对较低。世界卫生组织(WoI-ld Health Or-ganization,WHO)规定饮用水中微囊藻毒素的含量不得超过为1μg/L。微囊藻毒素具有较好的水溶性,在水中的溶解度大于1g/L,另外还能溶解于丙酮和甲醇。微囊藻毒素还具有很高的耐热性,加热煮沸都不能将其去除。由于微囊藻毒素的这些性质,常规的水处理工艺不能将其有效去除,因此对微囊藻毒素的检测以及预防显得尤为重要。
2 微囊藻毒素的合成基因及基因功能
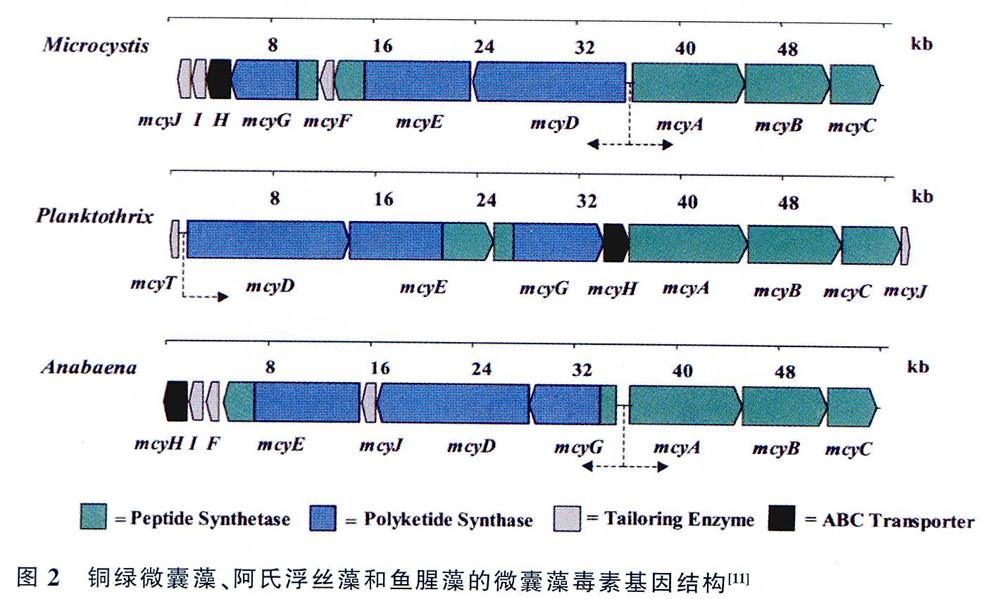
微囊藻毒素由聚酮合酶(polyketide synthase,PKS)和非核糖体合成酶(non-ribosomal peptidesynthetase,NRPS)等特殊的酶利用氨基酸或者化合物,绕开核糖体,通过非核糖体合成途径完成合成,微囊藻毒素合成基因(microcystin syn-thetase genes,mcy),是第一个被完全测序的蓝藻代谢物合成基因。Tillett等最先解析了微囊藻属(Microcystis) PCC7806的mcy基因,基因全长55kb,包含mcyA -C和mcyD -J两个操纵子,共有10个开放阅读框,主要编码PKS和NRPS。mcyD-j操纵子,编码PKS、NRPS和PKS混合的杂交酶、剪裁酶、以及转运酶;mcyA -C操纵子,主要编码3个NRPS。
微囊藻毒素的主要产毒藻种为微囊藻、鱼腥藻(ANABAENA)和浮丝藻(Planktothrix),3个藻属的mcy基因均已测序和鉴定出来,各个藻属mcy基因的基因单元在结构上是相似的,但是在基因的排列上略有不同(图2)。在基因单元方面,对比3个藻属可以发现,浮丝藻属无mcyF和mcyl基因,而多了mcyT基因。在基因排列上,微囊藻属和鱼腥藻属的两个操纵子呈相反方向排列,而浮丝藻属的操纵子呈单向排列(mcyT除外)。
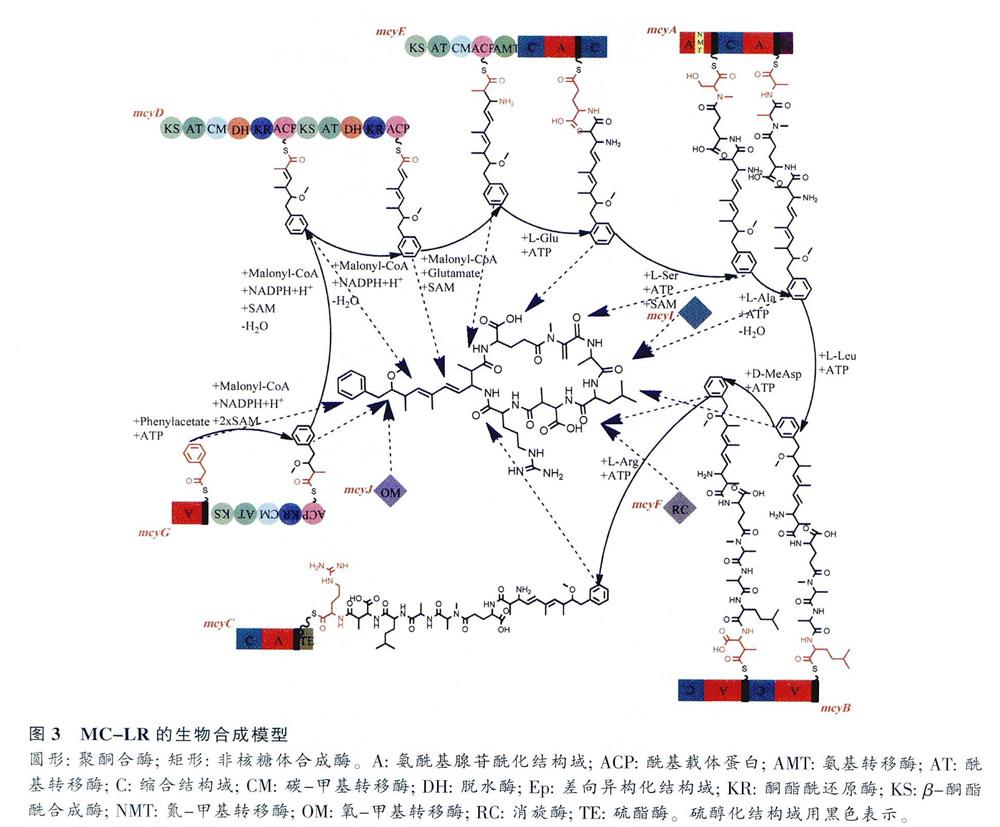
下面以微囊藻PCC7806合成微囊藻毒素(MC-LR)为例,根据mcy基因参与合成的顺序详细介绍这10个基因以及它们在合成中的作用(图3)。mcyG、mcyD和mcyE共同完成Adda的合成;mcyE还参与D—谷氨酸和L-丝氨酸的加入;mcyA参与Mdha的加入;mcyB参与L一亮氨酸和MeAsp的加入;mcyC参与L-精氨酸的加入,并完成环化,最终完成MC-LR的合成。
2.1 mcyG
Adda是微囊藻毒素毒性表达所必需的基团,根据相关酶的同源性和生物信息学的分析,Adda在,mcyG、mcyD、mcyE和mcyJ的共同作用下合成,mcyG完成其第一步合成。mcyG位于mcyF上游,全长7 896 bp,编码294 266 D的多肽,为PKS和NRPS。mcyG氨基末端的NRPS模块含有氨酰基腺苷酰化结构域(amiinoacyl adenylation,A),利用ATp,活化苯丙素,活化的苯丙素被转移至硫醇化结构域(thiolation),之后进入PKS通路。活化的苯丙素单元随后在丙二酰辅酶A (malonyl-CoA)的延伸作用以及mcyD、E、G的PKS通路的修饰下逐渐延伸。PKS含有β一酮酯酰合成酶(β -keloacyl synthase,KS)、酰基转移酶(acyltransferase,AT)、C-甲基转移酶(C-methyltransferase,CM)、酮酯酰还原酶(β-ketoacyl reductase,KR)和酰基载体蛋白(acyl carrier protein,ACP)结构域。Moore等研究发现,AT结构域可能与丙二酰辅酶A的接收有关。在AT结构域的作用下,丙二酰辅酶A上的丙二酰基团被转移到ACP结构域上,依次经KS结构域进行脱羧缩合反应、CM结构域编码C-甲基转移酶对S-腺苷甲硫氨酸(S-adenosyl-L-methionine, SAM)进行甲基化作用、KR结构域进行州还原作用,完成第一个丙二酰辅酶A延伸,从而完成Adda的第一步合成。
2.2 mcyJ
mcyJ与mcyG的PKS协同完成Adda第一步合成,位于mcyI上游,全长837 bp,编码31 904D的多肽。mcyJ包含一个O-甲基转移酶(O-melllyltransferase,OM)结构域。该结构域编码O-甲基转移酶,将SAM上的甲基催化转移到Adda的侧链上。
2.3 mcyD
mcyD进行Adda合成的第二步,是mcyD-J中第一个开放阅读框,位于mcyA上游,全长11 721 bp,编码435 714 D的多肽,具有PKS的功能。mcyD上有着两组PKS模块,都包含KS、AT、KR、脱水酶(dehydratase,DH)和ACP结构域,另外在第一个PKS模块上还有一个CM结构域。第一个PKS模块中,第一步合成产物被运送至ACP结构域上,AT结构域进行丙二酰基团的添加,KS、DH和KR结构域分别进行脱羧、脱水和酮还原作用.再加上CM结构域对SAM进行的甲基化作用,完成这一阶段的修饰。之后产物被转移至第2个PKS模块的ACP结构域卜,经AT、KS、DH和KR域的再次作用,完成在mcyD上链的延伸步骤,完成Adda的第二步合成
2.4 mcyE
mcyE完成对Adda的合成,并将D-谷氨酸结合到Adda上。mcyE位于mcyD上游,全长10 464 bp,编码392 703 D的多肽,具有PKS和NRPS的功能。mcyE的氨基端带有一组含有KS、AT、CM和ACP结构域的PKS模块,以及mcyE所特有的氨基转移酶(aminotransferase,AMT)结构域。mcyE上还有一个NRPS模块,包含两个A结构域、一个C结构域和一个硫醇化结构域。mcyD上合成的产物转移至mcyE上ACP结构域,在AT结构域作用下完成最后一次的丙二酰集团的添加,加上KS结构域的脱羧反应,以及CM结构域对SAM的甲基化作用,完成Adda的合成AMT结构域大约430个氨基酸,主要作用是将氨基运送到Adda 上,将Adda 由L一酮酯酰链经转氨反应转换成L-氨酰基硫酯链,定位于NRPS模块的硫醇化结构域。对NRPS模块的A结构域进行分析,发现其类似于脂肽和地衣芽孢杆菌索合成酶中的谷氨酸激活域。第一个C结构域催化了Adda和D-谷氨酸上α-氨基之间肽键的形成,从而使D -谷氨酸和Adda结合;第二个C结构域与mcyA上的结构域合作,是用来催化D一谷氨酸和N-甲基化丝氨酸之间肽键的形成,使L一丝氨酸加到合成链上。mcyE上带有整个mcy基因簇上独有的AMT结构域,与其他部位的同源性较低,在PCR扩增时不容易导致错配情况的发生,因此微囊藻毒素分子检测常针对mcyE设计引物。
2.5 mcyF
mcyF完成对MeAsp的异构化,位于mcyE上游,全长756 bp,编码28 192 D的多肽。mcyF包含一个消旋酶(racemase,RC)结构域,最初认为其编码谷氨酸消旋酶,负责L-谷氨酸的异构化。然而,后期研究发现其编码的是天冬氨酸消旋酶,作用于MeAsp的异构化。而L一谷氨酸的异构化被确认是由mcy基因簇外的一个谷氨酸消旋酶完成的,此谷氨酸消旋酶存在于所有的蓝藻之中。
2.6 mcyA
mcyA使Mdha加入合成链,是mcyA -C操纵子中第一个开放阅读框,全长8 388 bp,编码315 717 D的多肽,具有NRPS功能,包含两个A结构域和硫醇化结构域,一个C结构域,一个mcyA特有的N-甲基转移酶(N-methyltransferase,NMT)结构域,以及一个差向异构化结构域(epimerization,Ep)。NMT结构域在一些真菌和细菌中也存在,比较发现微囊藻毒素的NMT域与它们有着高度同源性。NMT结构域编码N-甲基转移酶.使L-丝氨酸和L-丙氨酸甲基化,成为N -甲基化丝氨酸和N一甲基化脱氢丙氨酸,另外其还作用于SAM。第1个A结构域作用是活化L-丝氨酸,NMT结构域对其进行N-甲基化作用,L-丝氨酸变为N-甲基化丝氨酸,再由第一个硫醇化结构域转运,最后经mcyE的C结构域作用,加入合成链;第2个A结构域参与L一丙氨酸的活化,经Ep结构域的异构化作用成D一丙氨酸,再经NMT域的甲基化作用,mcyl的脱氢作用,由第2个硫醇化结构域转运,最后mcyA的C结构域完成对N-甲基化脱氢丙氨酸的缩合,Mdha加到合成链上。NMT结构域与mcyE的AMT结构域情况类似,也是分子检测中选择比较多的检测区域。但是由于真菌和细菌中也存在NMT结构域,因此一般在利用分子技术检测微囊藻毒素的初期较为常见,近年来针对mcyE的AMT结构域的分子检测更为普遍。
2.7 mcyI
mcyI位于mcyH上游,伞长1 014 bp,编码36 838 D的多肽,其对mcyA上N-甲基化丙氨酸的进行脱氢作用。
2.8 mcyB
mcyB使L-亮氨酸和MeAsp加入合成链,位于mcyA下游,全长6 318 bp,编码242 334 D的多肽,具有NRPS功能,包含两个NPRS模块,每个模块都有一个A、硫醇化和C结构域。微囊藻PCC7806产生的MC-LR在可变氨基酸的位置是L-亮氨酸和L-精氨酸,在mcyB的作用下L-亮氨酸加入到合成链上。第1个A结构域的作用就是激活L-亮氨酸,第1个C结构域接收来自mcyA的D-丙氨酰基中间体,催化L-亮氨酸和D-丙氨酰基中问体之问肽键的形成,从而使L-亮氨酸加入到合成链上。第2个A结构域激活MeAsp,而第2个C结构域完成对MeAsp的缩合,使其加到多肽链上。正是由于mcyB作用下加入到合成链上的氨基酸有所不同,微囊藻毒素的异构体高达90多种。而不同的异构体也给微囊藻毒素的检测带来了很大的麻烦,高效液相色谱法(high performance liquid chromatography, HPLC)检测微囊藻毒素,一般只是针对毒性较大且常见的MC-LR、RR和YR 3种异构体进行的。
2.9 mcyC
mcyC使L-精氨酸加入合成链,并完成环化步骤。mcyC位于mcyB下游,全长3 876 bp,编码147 781 D的多肽,具有NRPS功能,包含C、A和硫醇化结构域,另外在羧基末端还有mcyC所特有的约240个氨基酸的硫酯酶(thioesterase,TE)结构域。A结构域活化L-精氨酸,C结构域将其最终连接到多肽链上。最后在TE结构域作用下,进行缩合反应,完成最后环化的步骤,从而完成MC-LR的合成。
2.10 mcyH
mcyH位于rncyG上游,全长1 617 bp,编码67 100 D的多肽,为跨膜蛋白,属于ABC转运蛋门家族。mcyH的作用仍不明确,推测其可能在类囊体定位方面或者是在微囊藻毒素的的释放上起着重要作用。
微囊藻毒素合成基因以一定的顺序排列,每个基因由不同作用的结构域组成,通过一步步的反应,协同作用最终完成微囊藻毒素的合成。微囊藻毒素的生物合成共需要48个反应,其中45个反应是由mcyA-E和mcyC完成的,另外的4个mcy基因也各自起着重要的作用。其中mcyD-J操纵子主要完成毒性基团Adda的形成,而mcyA一C操纵子主要完成氨基酸的加入以及环化的步骤。对微囊藻毒素合成基因以及基因功能的充分研究,为利用PCR技术检测微囊藻毒素奠定了坚实的基础。
3 微囊藻毒素的分子检测
目前,微囊藻毒素的检测方法主要有HPLC和酶联免疫吸附法(enzyme linked immunosorbentassay,ELISA),两者都能有效地检测出微囊藻毒素的情况,但是对设备、技术以及资金的要求较高。随着聚合酶链式反应(polymerase chain reac-tion,PCR)技术的发展,同时微囊藻毒素的毒基因mcy也已经被研究分析得比较透彻,数据库中存在各个产毒藻属mcy基因的序列,为运用分子生物学的方法研究产毒蓝藻提供了很好的基础利用PCR技术检测微囊藻毒素的研究已经有很多,并取得了一定的成果。该方法能够迅速、灵敏可靠的完成对微囊藻毒素的检测,相较于HPLC和ELISA方法,PCR方法更经济,且对技术的要求较低。综合诸多优势,运用PCR技术榆洲微囊藻毒素具有良好的发展前景,但还需要更深入的研究。
3.1 普通PCR检测方法
PCR技术是一种体外快速扩增特定DNA片段的方法,已经广泛运用于产毒蓝藻的检测中,相比于HPLC和ELISA等方法,该技术灵敏度更高,检测速度更快,还能够在毒素释放前进行预测。通过对mcy基因片段设计特异性引物,运用PCR技术扩增目的片段,根据是否能够得到目的片段来定性检测蓝藻是否具有产毒能力。运用PCR技术检测产毒蓝藻是从检测产毒微囊藻开始的,后运用到产毒鱼腥藻和产毒浮丝藻的检测,以及多种产毒蓝藻的同时检测。Tillett等研究了微囊藻产毒和进化之间的关系,分别针对mcyA的NMT结构域、16S rRNA和PC-IGS设计引物,对纯培养的37株微囊藻进行PCR扩增,发现其中18株包含产毒基因。将NMT基因与l6S rRNA和PG-IGS基因扩增出的序列分别建树分析,发现产毒蓝藻和非产毒蓝藻无规律分布于树上。Kurmayer等对澳大利亚Irrsee和Mondsee湖分离纯培养的浮丝藻进行PCR扩增,发现49株红色浮丝藻(Planktothrix Rubescens)都包含mcy基因,而23株阿氏浮丝藻(Planktothrix agardhii)中,有的包含mcy基因,有的没有。在PCR检测结果阳性的情况下,进行HPLC、MALDI-TOF质谱以及蛋白磷酸酶抑制实验,发现在两个藻种中都存在假阳性情况,即PCR检测阳性,而实际并未产生微囊藻毒素。这种情况的出现可能是基因存在部分缺失,或者是环境因素对基因表达造成了抑制,从而无法完成微囊藻毒素的合成。Hisbergues等针对mcyA的缩合结构域设计引物,对52株纯培养的蓝藻进行扩增,包含24株微囊藻、8株鱼腥藻、11株浮丝藻、2株念珠藻和7株节球藻。结果发现11株微囊藻、6株鱼腥藻、8株浮丝藻和1株念珠藻,共26株蓝藻PCR检测结果为阳性,其方法适用于同时检测微囊藻属、鱼腥藻属以及浮丝藻属中的产毒情况。在方法上,除了常规的PCR方法,还有多重PCR和全细胞PCR的方法运用到产毒蓝藻的检测上。潘卉等针对mcyB设计引物.对30株纯培养的微囊藻进行全细胞PCR扩增.其中18例阳性,与HPLC和ELISA检测结果一致。该实验在方法上进行了创新,水样不进行任何前处理,不需要提取藻的DNA,直接进行全细胞PCR。同时,该研究发现在每毫升微囊藻细胞数在2 000左右时该方法仍能灵敏检测:Rinta-Kanto等运用微囊藻16S rDNA、mcyB和mcyD的引物,对来自美国Erie湖以及加拿大共16个采样点的水样进行多重PCR,检测微囊藻以及产毒微囊藻的存在情况,发现所有水样3个基因的检测结果都为阳性。
3.2 定量PCR检测方法
定量PCR,是在普通PCR的基础上,在反应过程中加入荧光染料或荧光标记的特异性探针,通过对荧光信号的监测,根据荧光信号来精确定量起始模板数。运用定量PCR的方法,不仅能够定性检测蓝藻是否产毒,还能够对产毒蓝藻进行定量分析.预测水体的产毒能力。Vaitomaa等通过定量PCR的方法研究芬兰的Tuusulanjarvi和Hiidenvesi湖中产毒藻属和mcy的拷贝数。研究发现.Tuusulanjarvi湖的主要微囊藻毒素生产者是微囊藻属.微囊藻属的mcyE基因拷贝数在鱼腥藻属的30倍以上,而Hiidenvesi湖中产毒微囊藻和产毒鱼腥藻的拷贝数比较接近。两湖的微囊藻毒素浓度与微囊藻和鱼腥藻mcyE基因拷贝数呈正相关.因此,认为mcyE基因拷贝数能够用来表示产毒微囊藻和产毒鱼腥藻的数量。Ha等研究鱼塘中产毒微囊藻以及微囊藻总体的变化,分别针对mcyA和16S rRNA基因进行定量PCR。通过细胞显微计数以及定量PCR的方法,对铜绿微囊藻(Microcystis aeruginosa) NIES 102进行纯培养研究发现,两种基因拷贝数与细胞数量有一定对应关系。因此.通过16S rRNA和mcyA 基因拷贝数预估了鱼塘中的微囊藻和产毒微囊藻数量,发现微囊藻毒素的浓度与mcyA的拷贝数有着高度联系,产毒微囊藻大约占微囊藻总体的80%,.Fortin 等运用定量PCR方法研究2006年和2007年夏天加拿大Missisquoi湾的产毒蓝藻情况,发现2006年8月mcyDKS基因为6.5 xl0 4copies/mL,9月为4.Oxl0 4 copies/mL,而此时微囊藻毒素浓度分别为4μg/L和2μg/L。2007年的水样中mcyDKS只有3x10 2 copies/mL,而微囊藻毒素浓度通过HPLC几乎检测不到。由此可见,当微囊藻毒素浓度低于HPLC的检测限度时,HPLC很难完成对湖水情况的分析.而此时定量PCR方法依然能够很好地检测到产毒蓝藻的情况-Sipari等在Tuusulanjarvi湖的水样中鉴定出产毒微囊藻和产毒鱼腥藻,针对mcyE基因运用探针法的定量PCR技术进行检测,提取藻样DNA检测产毒蓝藻存在情况,提取藻样RNA检测产毒蓝藻的表达情况。结果发现,在8、9月份微囊藻毒素浓度达到最大,同时水体中mcyE的拷贝数也达到最大,并且mcyE在表达水平上也是如此。在7月初,微囊藻毒素浓度最低时,末发现mcyE的表达。
3.3 基因芯片检测方法
基因芯片将大量探针分子同定于支持物上,再与样品分子进行杂交,通过检测每个探针分子的杂交信号强度从而得到样品分子的数量和序列信息。由于基因芯片技术同时固定了大量的探针分子,因此其可以一次性对样品中大量的基因序列进行检测。Rantala等针对微囊藻、鱼腥藻、浮丝藻以及念珠藻(No.s toc)的mcyE基因和节球藻的ndaF基因设计多对探针,将其固定在基因芯片上。检测10个湖泊的水样,发现6对探针能够可靠地检测出对应的产毒蓝藻基因,并且具有很高的灵敏度。基因芯片的特异性、灵敏度以及同时检测多种产毒蓝藻的能力使其能够加快对大样本量水样的检测,能够用于同时检测大量的产毒蓝藻,为产毒蓝藻检测提供了高通量平台。
4 展望
微囊藻毒素由于其危害巨大,受到国内外广泛关注和研究。微囊藻毒素合成基因的成功测序,为产毒藻的生态研究提供了理论基础,并为新检测技术的开发奠定基础。微囊藻毒素的分子检测已经从最初的PCR检测技术,发展到基因芯片进行高通量的检测。分子检测相对于HPLC和ELLSA检测有很多优势,即使在产毒蓝藻浓度很低的情况下,也能够灵敏可靠检测到产毒蓝藻的情况,实施对水体的实时监控,从而对微囊藻毒素进行提前预警,对微囊藻毒素进行有效的预防。目前利用分子检测只能量化产毒微囊藻的数量以及其在种群中所占比例.预测的是潜在的产毒能力。如何利用分子生物学技术,进行水体中微囊藻毒素浓度的检测,还需要进一步的研究。微囊藻毒素的分子检测方法目前还多应用于实验室研究阶段,我们需要发展一种快速、简便、高通量、低成本的微囊藻毒素的检测方法,能够很好地应用于各水质监测中心,这将是未来研究努力的方向。另一方面,微囊藻毒素合成机制已经研究得很透彻,针对这方面设计出相应的阻断方法,比如破坏合成酶的活性,沉默合成基因等,从而控制甚至消除微囊藻毒素,是未来研究的新方向。这都需要更多科研工作者的努力,从而能够更好地监测水体微囊藻毒素的情况,为微囊藻毒素的治理奠定更好的基础。
