成花素FT的调控运输及生理功能的研究进展
2014-04-29胡帅肖文君张骋王萍常洪平王育袁聪颖陆秀涛万捷郭新红
胡帅 肖文君 张骋 王萍 常洪平 王育 袁聪颖 陆秀涛 万捷 郭新红


摘 要:开花作为植物从营养生长到生殖生长的转折点,受外界环境变化影响,对植物发育和繁殖有着至关重要的作用。成花素(flowering locus T FT)蛋白作为拟南芥开花信号核心分子,在开花调控中扮演重要角色。拟南芥叶片在感应外界温度光照等因素变化后,通过生理钟(constants,CO)等蛋白及部分Mico-RNA正负协调调控筛管伴胞中的FT基因表达,FT蛋白通过筛管从叶片运输到茎顶端分生组织后,与一个碱性亮氡酸拉链(basicleucine zipper,bZIP)蛋白FD结合调控茎顶端分生组织(shoot apical meristem,SAM)中的花组织形成相关基因表达.继而诱导开花对近年来FT基因在叶片中的调控、FT蛋白的运输及其在顶端分生组织中的开花诱宁机理进行综述,为进一步完善FT表达调控及功能研究提供参考。
关键词:拟南芥;开花调控;生理钟(CO);成花素(FT)
中图分类号:Q943.2
文献标识码:A
文章编号:1007-7847(2014)06-0527-06
大部分植物的开花具有季节性,这主要因为植物能够感受外界环境变化,包括光周期、温度等这些囚素能调控FT蛋白的表达量,而拟南芥主要通过FT蛋白促进开花,该蛋白在筛管伴胞中合成通过筛管运输到茎端分生组织并促进花原基分化。当然一些受植物生长发育自主调控的相关开花信号分子在顶端分生组织中的表达量发生变化也对花组织诱导形成起重要作用。
1 叶片感应外界环境变化调控FT基因表达
叶片能感受外界光照的变化和温度的变化激活或抑制一些基因的表达调控F1基因表达,从而植物感受因季节变更引起的光周期和外部温度变化而保持白身在合适的时间开花,保证正常的发育和繁殖。
转录激活因子CO与FT基因结合直接诱导其表达并且强烈影响开花时间,CO的转录调控主要受光周期影响。光周期调控的FKFl (flavin-binding, kelch repeat, f-box l)、GI (gigantea)和CDF (cycling dof factor)蛋白在CO转录调控中扮演主要角色。转录因子CDF(包括CDFl、CDF2、CDF3、CDF5)在上午抑制CO基因转录。大分子核蛋白GI和光受体E3泛素化连接酶KFKI蛋白在长日照条件下在下午同步表达,但在短日照中不同步,两者通过蓝光依赖途径形成复合体,这种复合体分解CDF蛋白,从而在长日照白天促进CO基因表达。GI蛋白在核中的分布情况也影响CO基因的表达,晚上ELF4 (edrly flower-ing 4)蛋白与GI直接结合并定位GI在核的亚核隔间,ELF4依赖的GI亚核隔问定位使GI与CO启动子分离而降低CO表达量。除了FKF1之外还有两个E3泛素转移酶参与CO转录调控。环指型E3泛素连接酶DNF (day neutral flowering)在短日照条件下白天抑制CO基因表达量负调控开花。bHLH (basic helix-loop-helix)转录因子家族成员Flowering hHLH (FBH1、FBH2、FBH3和FBH4)全天激活CO转录,FBH蛋白与靠近CO转录起始点的E -box结合促进其转录,而光周期调控途径能影响FBH蛋白活性。
除了转录方面而受多种光信号调控,C0蛋白的稳定性也受到光信号的影响j白天两种光敏素拮抗调控CO蛋白的稳定性,光敏索PHYB (phy-tochrome B)在上午促进C0蛋白的分解,而光敏素PHYA (phvtochrome A)在长日照中下午维持CO蛋白稳定性(图1)。在晚上一个环指型E3泛素连接酶COPl (constitutive photomorphogenesis1)和 supressor of PHYA (SPA1、SPA3和SPA4)结合高效地分解CO蛋白。而白天蓝光受体隐花素cryptochrome (CRY1和CRY2)优先结合SPAI抑制COPI-SPAI功能,但CRY1和CRY2的抑制机理不同。 CRY1与SPA1的C端域结合阻止COPI-SPA1复合物的形成。而CRY2与SPA1结合促进CRY2-COP1-SPAl三聚物的形成,从而抑制COPI-SPA1的活性,促进CO的稳定(图1)。另一个环指型E3泛素连接酶HOSl (higll ex-pression of osmotically responsive gene l)也调控CO蛋白稳定。与COPI和SPA1相似,HOSI与CO蛋白的CCT元件结合,但是HOS1在上午降低CO蛋白而在晚上升高CO蛋白。另外HOSI在4℃冷胁迫下通过降解CO蛋白减少对FT基因表达起重要作用,而且光敏素B(PHYB)也在冷胁迫下影响HOST1的活性。KFK1在蓝光的激发下通过LOV域与CO蛋白结合,这种结合决定了CO蛋白的稳定时间(图1)。除了本身结合FT基因诱导表达,CO蛋白还通过其两个结合域(CCT元件和B-box域)与其他蛋白形成复合物调控FT表达。CO蛋白通过CCT元件与HAP3(heme activator pratein 3)和HAP5形成的复合物结合,而且HAP3和HAP5调控FT表达影响开花时间。CO蛋白还通过B-box域与TCA4 和ASl(asymmetric leaves l)结合,而ASI在筛管伴胞高表达,能与FT启动子直接结合,并参与CO蛋白依赖的FT诱导表达。
CO基因在叶片中的表达高控研究取得显著的成就,其除了促进FT基因的表达及开花,也有报道表明CO能在花粉中独立于FT基因调控开花。作为FT基因的转录因子,C0蛋白除了在叶脉维管束中表达还在顶端分生组织中表达,而FT基因不在顶端分生组织中表达,这说明CO还存在其他功能能在茎顶端分生组织中促进相关开花基因的表达。
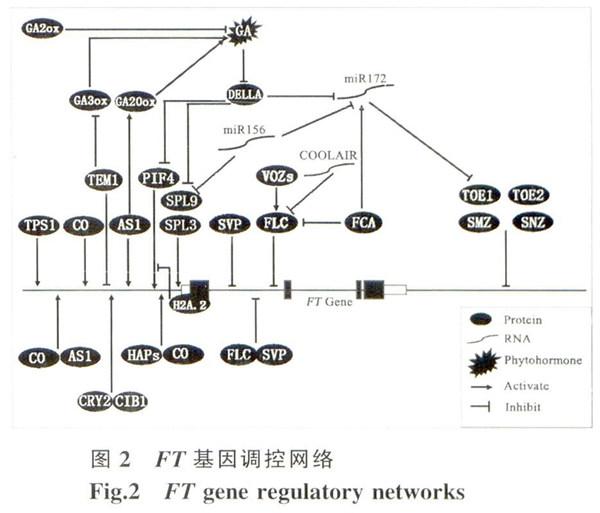
具有活性的赤霉素GA (gihherellic aicd)住长日照和短日照也促进FT表达。叶脉中的GA能够通过抑制DELLA蛋白来调控FT表达。DELLA在叶中抑制FT激活子SPL3 (squanlosa promloterbinding protein-like 3)的表达。DELLA在长日照下通过减少叶片中miR172水平延迟开花,而miR172诱导分解FT抑制因子的转录物。RGA (repressor of GA1-3)是DELLA蛋白中的一个,能与SPL蛋白的C端结合,并且这种相互作用很可能能减弱SPL9蛋白的活性,而SPL9能促进miR172。DELLA蛋白还可能调控FT激活子PIF4 ('phytochrome interacting Factor4)的结合活力。通过这些DELLA依赖机制,活性GA直接影响FT表达水平(图2)。
PHYB信号途径组分也可能调控激活FT基因表达。PIF4、VOZ1 (vascular pIant one-zinc fin-gerl)和VOZ2是PHYB结合转录因子,能诱导FT表达。近期研究表明PIF4是高温诱导形态学变化(包括开花转变)的主要调控因子。在27 ℃短日照下PIF4蛋白与FT基因启动子结合直接激活FT表达,并且PIF4的表达量随温度增加而增加。组蛋白H2A变体H2AZ在高温条件与FT基因启动子结合减少,从而解除PTF4与FT基因结合抑制。另一类PHYI3转录因子vOz蛋白通过降低FLC基因表达量而不是通过CO途径调控间接促进FT表达。
6-磷酸海藻糖信号途径蛋白TPS1(tre-halose-6- phosphate synthasE 1)也是FT基因表达激活所必须的。TPSl独立CO调控FT基因表达,是FT表达所必须的激活因子。但目前TPS1的调控机理尚不清楚。另一个FT激活子CIB1(cryptochrome interacting bHLH 1)和CRY2的复合物与FT基因位点直接结合并诱导其表达。但CIBl持续过表达导致FT表达在下午到上半晚这段高峰期受到抑制。
FLC、SVP
(short vegetative phase)、TEM1(tempranillo 1)和SMZ(schlafmutze)能与FT基因的特异顺式元件结合抑制其转录。这些抑制子以及它们的转录因子在不适宜开花条件下和幼苗时期抑制FT表达防止过早开花 。FLC基因表达一个MADS-box转录抑制因子,并抑制一些开花相关基因的活性。FLC蛋白通过CArG盒与FT基因的启动子区及第一个内含子结合抑制其表达。春化、自我调控等途径均会调控FLC的表达低温等条件能诱导VOZ1和VOZ2表达而抑制FLC的表达量。一个RNA结合蛋白FCA也负渊控FLC表达(图2)。春化作作中FLC反义RNA COOLAIR调控使得FLC基因染色体H3组蛋白甲基化修饰( H3K27me3)。从而抑制FLC基因的转录。因此春化作用也被广人实验室接受以缩短拟南芥培养周期。FLC还与SVP互作通过CArG盒与FT结合作长期低温条件下抑制其表达。TEM1能直接在FT基因5端结合抑制其转录,还通过GA途径间接抑制FT表达TEM1和TEM2在短日照下抑制CA4 的生物合成基因CA20oxl和 GA 3ox2 的表达。但AS1蛋白在叶片中止调控GA20oxl的表达,这说明ASl和TEMl均可能部分参与叶筛管伴胞中活性GA量变化控制FT表达(图2)。另一个FT基因抑制因子SMZ能与FT基因结合抑制其表达。SMZ的表达受microRNA172 (m1R172)的调控,m1R172靶标基因包括SMZ、SNZ、TOE1、TOE2和TOE3。SNZ.TOE1和TOE2也会抑制FT的表达,但这3个蛋白如何抑制还有待研究。
值得一提的是拟南芥中一些microRNA也影响FT或其同源基因TSF (sister of FT)表达而调控开花。miR172能通过诱导分解AP2相关转录因子基因(SMZ、SNZ、TOEI和TOE2)的转录物影响FT基因的表达。miR172的含量随着植物发育而减少,其含量在长日照下比在短日照下高,而GI参与这种光周期miR172感应。SVP蛋白直接与MIRI72α启动子的CArG元件结合抑制MIR172α的表达。低温降低miR172水平主要通过pri-miR172(转录后含有5帽子和3'Ploy-A尾巴产物)和pre-miR172(从pri-miR172切割得到的约70 bp的片段)调控。miR172随温度降低而减少,而pri-miR172的表达量不随温度的改变而改变,但过表达的pre-miR172植株的m1R172不随温度变化而变化,这说明pri-miR172到pre-miR172的过程是被温度调控的。其中,FCA蛋白直接与pri-miR172转录物以不连续特异方式结合,并正调控miR172生成(图2)。miR399在16 ℃下减少,并且也被FCA调控。miR399的靶基因PH02(Phosphate2)维持磷酸化平衡并通过控制TSF表达调控开花。miR156某种程度上与miR172具有拮抗作用,miR156能负调控miRl72。miR156水平在16℃下比23 ℃下高几倍,而miR172的含量在16℃下是23℃下的一半。两种micoRNA在温度改变后共同改变FT调控因子的表达量而影响开花。miR156过表达植株在16℃下比23 ℃下开花更晚,同时伴随着叶中FT表达量降低。值得注意的是,16℃下在miR156过表达植株中其靶基因,SPL3特异性下调。SPL3蛋白与FT启动子转录起始位点附近的GTAC元件结合,感应到SPL3转录量降低后,FT和另一个SPL3已知靶标FUL (Fruitfull)的表达量增加。这些发现支持了叶片中miR156-SPL3-FT模式在拟南芥年龄和外界温度变化影响的开花调控中起重要作用。
2 FT蛋白的运输
FT mRNA在筛管伴胞中存在,并在该处合成FT蛋白,FT蛋白通过筛管运输到SAM调控开花。近期的研究表明FT蛋白的运输与FTIP1(FT-interacting protein l)有很大关系。FTIPI蛋白在筛管伴胞中与FT蛋白相互作用,而且不影响FT基因的转录和蛋白稳定,但FTIP1缺失突变体ftipl在长日照下与野生型相比有明显的晚花表型,这表明FTIP1很可能与FT蛋白相互作用保证FT在筛管中运输到SAM(图3)。另外,FT同源基因TSF的碱基序列与FT高度同源,而且TSF功能缺失会进一步加剧ft缺失突变体的晚花表型,但FTIP1基因缺失不会加剧tsf和ft缺失突变体的晚花表型,这些结果支持了TSF的运输也受FTIP1的调控。FT及TSF是一类20 kD左右的亲水球蛋白开花信号分子,这些小型亲水开花信号分子在筛管中主要通过共质体途径运输到SAM。通过FTIP1的作用,FT和TSF能够从筛管伴胞进入筛管,并通过共质体的胞间连丝从一个细胞转移到另一个细胞的形式进入到SAM中调控下游开花基因表达。
3 茎顶端分生组织(SAM) FT蛋白行使的功能
FT蛋白通过筛管从叶片运输到SAM后与bZIP转录因子FD蛋白相互作用形成复合体共同诱导开花。FT与FD的复合物在SAM中直接激活一些关键的花组织形成基因,如APETALA1(APl),AP1蛋白是一种MADS域转录因子在拟南芥花组织分化中发挥关键作用。FT-FD复合物还通过促进转录因子SOCl (suppressor of overex-pression of constans l)表达激活花形成相关分生组织标记基因LEAFY (LFY)基因,SOC1能与LFY启动子直接结合激活转录。另外SOC1与另一个MADS域转录因子AGL24 (agamouS-like24)相互作用共同激活LFY的转录。LFY又激活AP1的转录,而AP1反过来有可以促进LFY的表达(图3)。另外最新研究显示LFY还直接激活FD表达。这种相互激活表达放大了开花信号,保证开花相关基因的高水平表达水平。FT-FD复合体的FD能与SPL基因家族成员启动子结合促进其表达,SPL家族成员是一类与年龄相关的开花信号转录因子基因,受miR156负调控。FT-FD复合体还通过促进SOC1表达问接促进SP/的表达,因为SOC1蛋白能直接与SP/3、SPL4和SPL5基因的启动子结合促进这些基因的表达。SPL3蛋白能直接促进LFY、FUL和AP1基因表达。通过SPL3、FT-FD复合体间接促进LFY表达,这补充了FT-FD通过SOCl促进LFY表达的途径。
成花同源基因AG(agamous)在顶端分生组织中编码一种MADS域转录因子,该转录因子在雄蕊的形成中起重要作用。AG表达需要LFY和转录激活因子WUS(wuschel)蛋白同时与其第二个内含子结合才能激活表达.由于LFY缺乏,AG在SAM中几乎不表达。而在花原基中LFY表达,该蛋白和WUS与AG基因的第二内含子结合共同诱导AG表达,从而促进花组织的分化形成。AG在雄蕊的形成调控中发挥重要作用,而LFY在AG表达中不可缺乏,这是以说明AG和LFY是花器官形成基因。
FT-FD复合物也会受到抑制而延迟花原基的形成时间BFT (brother of FT and TFL l)在高盐条件与FT竞争结合FD从而阻止这种复合物的形成而延迟开花。最近研究显示一个侧枝调控因子BRCI (branched 1)会与FT蛋白结合抑制FT-FD的活性并抑制下游开花基因的表达从而阻碍原基形成。另外,与FT氨基酸序列高度同源的TFLl (terminal flower 1)也会对这些促进开花基因有负调控作用,TFLl的mRNA只分布在SAM 的中心位置,而其蛋白几乎分布在SAM所行部位,这说明TFL1发生了转移,而LFY可促进这种蛋白的迁移。TFL1在SAM中与FD结合导致FD依赖的基因转录受到抑制,如AP1,并且间接抑制LFY。反过来AP1至少与TFL1基因3端的两个位点结合抑制其表达,而且TFY也会抑制TFL1表达。
4 展望
目前对FT的转录调控研究较多,但对FT蛋白在叶片中调控却知之甚少。作为成花素,FT蛋白含量的高低直接影响开花的早晚,因此对FT蛋折在叶片中的调控的研究具有重大意义。逆境电影响开花时间,但目前对于逆境中FT基因调控的研究不多,对FT基因在逆境中的调控研究也具有一定实用性。对于FT蛋白的运输,FTIP1与FT互作辅助FT的转移,FT蛋白在FTIPl的作用下以怎样的形式进入到筛管中也不十分明了。顶端分生组织中开花相关基因的调控仍存在一些问题,比如FT蛋白需结合FD后发挥作用,是否FT还与其他因子作用完成花原基的诱导TFL1作为盯的拮抗蛋白,其氨基酸序列高度同源,甚至存在与FT蛋白功能相似的结构域,那TFL1是如何受其上游基因的调控,这些上游基因又是什么,是否与FT一样受外界温度和光照等因素的影响?另外,广泛分布于韧皮部的CO蛋白也能独立于C0- FT途径调控开花,但机理尚不明了,该问题值得研究。如果知道植物的开花机制,就有操控开花的工具,就能调控开花时间,通过加速或延迟开花来增加农作物产量,有利于培育出高产、优质的作物新品种。
