睾酮通过抑制Rab13表达影响支持细胞屏障通透性
2014-04-29宿文辉孟晓娜贾晓宇
宿文辉 孟晓娜 贾晓宇


摘 要:探讨Rah13 GTPase对血睾屏障(blood testis barrier, BTB)通透性的调节机制。体外分离培养20d龄大鼠睾丸支持细胞,睾酮处理后测定跨上皮电阻(transepiihelial electrical resistance,TER), FITC-鬼笔环肽染色分析F-actin分布,并采用Western印迹检测Rad13在睾酮处理前后的表达变化;siRNA干扰培养支持细胞中Rab13的表达。Western印迹检测沉默效果并检测连接蛋白表达变化;TER测定Rab13沉默前后上皮屏障功能改变,F-actin染色分析Rah13沉默对肌动蛋白丝分布的影响。结果显示,睾酮处理可使体外支持细胞屏障TER值升高.F-actin在膜下聚集增强,且Rab13在睾酮处理后表达量明显降低;Rab13 siRNA处理不影响连接蛋白质的表达,但可引起F-actin在细胞连接处的分布增强,导致体外BTB屏障功能增强。表明Rab13可通过调节F-actin的排布影响体外BTB通透性。
关键词:血睾屏障:支持细胞:Rabl3:肌动蛋白丝
中图分类号:R339.2+I
文献标识码:A
文章编号:1007-7847(2014)06-0500-05
血睾屏障(blood-testis barrier, BTB)是睾丸中血管和曲细精管之间的物理屏障,是由曲细精管支持细胞(Sertoli cell)、血管内皮基膜、结缔组织和曲细精管基膜组成的屏障结构。其中,支持细胞间的各种细胞连接,如紧密连接、缝隙连接和特化的黏着连接等,是构成BTB的主要结构基础,创造了相对稳定的生精内环境,既为精原细胞的发育提供营养,又阻止细胞毒性物质进入管腔,防止精子与免疫系统接触。构成BTB的各种细胞连接具有特征性的微丝束分布,这些肌动蛋白丝(F-actin)垂直于生精上皮内两相邻的支持细胞膜,使BTB的细胞连接较其他各种生理屏障具有更强的粘附力。
在生精细胞穿越生精上皮的过程及精子释放入生精小管腔过程中,紧密连接复合体必须不断地解聚和重新绀装,这就需要相关的连接蛋白快速地在细胞膜进行内吞和再循环。Rab GTPase是一族相对分子质量为20~30 kD的GTP结合蛋白,属于Ras超家族。Rab GTPase主要参与细胞内不同细胞器间的蛋白转运、蛋白质的循环利用、内吞、胞吐等过程。我们在前期研究中已经验证了 Rab13在大鼠睾丸绀织中的表达,并且发现Rab13的表达是随着生精上皮周期的变化而变化;本研究利用体外BTB模型,即原代培养的大鼠睾丸支持细胞,进一步验证Rab13在调节血睾屏障通透性过程中发挥的作用。
1 材料与方法
1.1 实验动物与试剂
20 d雄性SD大鼠(40~50 g)山中国医科大学实验动物部提供。兔抗Rab13抗体购自Abcam公司(英国);兔抗Occludin、兔抗ZO-l、小鼠抗β-catenin购自 Invitrogen(美国):兔抗N-cadherin、山羊抗actin抗体、牛抗兔、牛抗山羊lgG均购自Santa Cruz公司(美国):FITC-鬼笔环肽、DMEM培养基为Sigma公司(美国)产品;靶向干扰Rab13的小RNA及对照组小RNA购自GenePharma(中国);ReboJuice转染试剂购自Novasgen公司(美国);Prolong Gold Antifade封片齐0pti-MEM购自In-vitrogen公司(美国);ECL显色试剂盒购自Tnermo公司(美国);PVDF膜为Millipore公司(美国)产品;其他常规试剂均为Sigma公司(美国)产品。
1.2 主要仪器设备
细胞培养板和transwell培养板为CorningCostar公司(美国)产品;荧光倒置显微镜为Olvmpus公司(日本)产品;台式低温超速离心机购自Sigma公司(美国);数字电阻仪购自上海加佳电子仪表厂(中国);电泳仪、电泳槽均购自Bio-Rad公司(瑞典)。
1.3 实验方法
1.3.1 大鼠支持细胞原代培养
按本实验室常规方法分离培养大鼠支持细,胞。取出生20 d雄性SD大鼠睾丸,去被膜,在DMRM培养基中剪碎至1 mm3用胰蛋白酶、胶原酶、透明质酸酶依次在37℃进行消化,消化产物经多次低速离心(<700 g)后接种于涂有 Matrigel的培养平板(0.5×10 6/cm2)、双室模型(1.2×10 6/cm2)或盖玻片(置于培养板中,0.05xlO 6/cm2)中,于35℃、5%C02培养箱中进行培养,每日更换无血清DMEM培养液(含表皮生长因子、转铁蛋白、胰岛素及杆菌肽等营养因子)。培养48 h后,用20 mmol/LTris (pH 7.4)对培养细胞进行低渗处理以上除混杂的生精细胞。该方法分离培养的睾丸支持细胞纯度可达98%,极少有各级生精细胞、肌样细胞和Leydig细胞的污染。
1.3.2 跨上皮电阻(TER)测定
在双室培养皿上层接种的支持细胞,于培养1~7 d每日用数字电阻仪(DT-9208,上海)测量并记录TER值,以反映上皮细胞间紧密连接的功能。
1.3.3 睾酮处理培养细胞
为检测Rab13在睾酮增强支持细胞上皮功能过程中的作用,于培养第4 d用睾酮(0.2 moI/L)处理支持细胞,每日测定TER值,并于处理后不同时间点检测睾酬处理组Rab13的表达量及F-actin的分布。
1.3.4 F-actin染色
培养第6d,4%多聚甲醛于室温固定接种于盖玻片上的支持细胞10 min, O.l% Triton X-100通透处理4 min,随后用含FITC-鬼笔环肽(l:150)的l%BSA避光室温孵育1 h,Prolong gold antifade封片剂(含DAPI)封片.Olympus BX60荧光显微镜下观察记录结果。
1.3.5 免疫印迹
NP-40裂解液(50 mmol/L Tris、150 mmol/LNaCl、2 mmol/L EGTA、lO% glycerol、l%, NonidetP-40、pH 8.0)处理睾丸或体外培养Sertoli细胞,提取总蛋白,BCA定量法测定蛋白浓度后制备蛋白样品。不同处理组蛋白(30 μg)经SDS-PAGE电泳后,转印至PVDF膜,5%脱脂奶粉封闭,依次经一抗、二抗孵育后进行ECL显影,Scion Image软件扫描。β-actin做为蛋白内参照。
1.3.6 siRNA转染
由上海GenePhama公司合成大鼠Rab13 siR-NAs,预实验确定干扰效果。所用序列如下:Rab13 siRNA,5-CAUCJUAAGUGCUCUUGAAGtt-3,5'-CUUCAACAGCACUUACACCtt-3';对照组sjRNA,5 -AGGAGAUGJUGAUAUUGGCUtt-3 ,5 -AGCCAAUAUCACAUCUCCUtt-3。BLAST排除与其他基因序列的同源性。于培养第4d进行siRNA转染:在Opti-MEM中混匀siRNA及Re-boJuice转染试剂,根据预实验及培养密度确定siRNA浓度(TER测定实验150 nmol/L, Western及细胞染色100 nmol/L):转染24 h后更换正常无血清培养液,继续培养48 h后收集细胞。
1.3.7 统计学分析
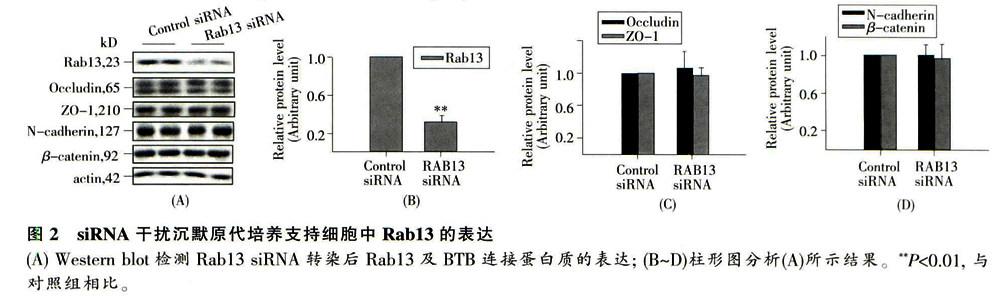
本研究中所涉及TER及Western印迹等实验结果采用GB-STAT分析软件(版本7.0; Dy-namlc microsystems)进行双因素方差分析及Dun-nett's检验,P<0.05为差异显著,P 2 结果 2.1 Rab13参与睾酮对体外BTB屏障功能的调节 体外分离大鼠支持细胞,于双室培养系统中培养,建立体外BTB模型,培养l~7 d测定跨上皮电阻(TER),结果显示在培养第4 d TER值达到最高(图1A)。于培养第4d用睾酮(0.2 mol/L)处理,TER测定显示睾酮可以显著提高支持细胞屏障功能(图1A); F-actin染色显示,睾酮处理组肌动蛋白丝在细胞皮质处的分布增强(图1 B); Western印迹检测睾酮组Rab13的表达在处理后12~48 h与对照组相比明显下降(图IC、D),提示睾酮可能通过调节Rahl3的表达影响支持细胞上皮通透性,即Rabl3参与调节体外BTB屏障功能。 2.2 体外siRNA干扰支持细胞Rab13的表达 为确定睾酬处理后支持细胞上皮通透性变化与Rab13表达量变化之间的关系.于培养第4 d在Sertoli细胞中通过siRNA干扰Rab13的表达24 h。继续培养48 h后,Western印迹显示Rab13表达量经干扰后与对照组相比可降低至70%,且对上皮屏障功能相关的紧密连接蛋白 (occludin、ZO一1)及粘附连接蛋白(N -cadherin、β-Catenin)的表达无靶外效应.即Rab13沉默并未引起连接蛋白的表达量变化。 2.3 Rab13 siRNA通过影响F-actin分布调节支持细胞屏障功能 siRNA干扰沉默支持细胞Rab13表达后,TER测定结果显示Rab13 siRNA处理组细胞的屏障功能明显高于对照siRNA处理组(图3A);F—actin染色亦发现Rab13沉默可引起与睾酮处理后相类似的改变,即F-actin在支持细胞膜下的聚集(图3B)。这些结果表明,Rab13可通过影响F-actin在支持细胞中的排布影响体外BTB上皮的通透性。 3 讨论 精子发生过程依赖于稳定的生精内环境,BTB使循环系统中的有害物质被支持细胞的连接复合体阻挡而不能进入生精上皮内的近腔小室.保证了其中精母细胞的减数分裂和精子变态在稳定的微环境进行。BTB中,支持细胞紧密连接处的细胞膜与膜下内质网池之间有大量平行排列的微丝束,这些微丝束与生精上皮周期中连接复合体组成蛋白的组装和解聚密切相关。肌动蛋白结合蛋白(aCtin-binding protein,ABP),如Eps8 、Arp3、drebrin E、filamin A等,可以通过调节F-actin在支持细胞中的分布影响BTB中连接复合体的组装,进而影响血睾屏障周期进程及精子发生过程。 在研究上皮细胞的紧密连接组装的过程中,人们发现了多种Rab GTPase在连接复合体中的定位,并发现有多种Rab GTPase参与调节紧密连接的动力学变化。例如:Rab3B在PC12细胞中的过表达可以引起ZO-l的定位变化和肌动蛋白丝的重新组织,Rabl0在MDCK细胞胞内物质转运过程中发挥作用。目前,对睾丸中Rab GTPase的研究还很少,其中,Rab8B被证明在睾丸支持细胞中可以与E-cadherin以及γ-catenin等连接复合体分子发生免疫共沉,Rab4A也被证明通过与catenin相互作用参与支持细胞与生精细胞间粘附连接的解聚过程。在前期研究中,我们检测了Rab13在大鼠睾丸中的表达分布,发现Rab13在生精小管内的分布随生精上皮周期的变化而变化,为进一步阐明Rab13在生精上皮屏障中的作用,我们在本研究中采用体外分离培养的大鼠睾丸支持细胞,建立体外BTB研究模型。在该模型培养条件下,TER测定显示支持细胞间建立了功能性的紧密连接屏障,电镜下具有紧密连接、缝隙连接、桥粒、基底特化的粘着连接等体内BTB的特征性结构,即可以模拟体内BTB进行功能性研究。 由于已知睾酮可以加强支持细胞BTB的屏障功能,我们存本研究中用睾酮处理培养的支持细胞,建立紧密连接屏障增强的体外BTB模型与以往研究结果一致,TFR测定结果显示睾酮处理可显著提高体外BTB的完整性,且F-actin染色亦显示睾酮处理后F-actin在细胞膜下分布增多;进一步免疫印迹检测Rab13的表达,结果发现在睾酮处理支持细胞12 h后,Rab13的蛋白水平开始下降,提示Rab13可能参与BTB的完整性调节。 为明确Rab13对BTB功能的影响,我们采用siRNA 干扰沉默培养支持细胞中Rab13的表达,结果显示Rab13的蛋白表达水平可沉默至对照组的30%左右.此时紧密连接蛋白occludin、ZO-l及粘着连接蛋白N-cadherin、β-Catenin的蛋白水平均未发生明显改变,即Rab13沉默对连接蛋白的表达量无影响。而TER测定显示Rab13siRNA处理24 h后,体外BTB的屏障功能显著提高;进一步F-actin染色,结果显示Rab13表达受到干扰后,F-actin与睾酮处理后相类似,即在细胞皮质处的分布显著增强。以上结果说明,Rab13 可通过调节F-actin在细胞连接处的排布,而不是连接蛋白质的表达,来影响睾丸支持细胞屏障的通透性,而这种影响亦参与睾酮对BTB完整性的调控过程中。研究表明,睾酮可以通过调节支持细胞膜连接蛋白的循环利用,并且通过影响肌动蛋白调节蛋白的功能,加强细胞连接处的肌动蛋白丝的分布并增强BTB完整性。在本研究中,支持细胞经睾酮处理后,F-actin在膜下聚集强度明显强于Rab13被沉默后F-actin在膜下聚集强度.说明Rab13不是睾酮起作用的唯一途径.而Rab13与其他参与睾酮作用的因素之间是否存在相互作用,还需进一步研究确定。
