抑郁大鼠电休克治疗后认知功能与突触可塑性研究☆
2014-04-28黎平郝学超律峰魏珂罗洁曹俊董军闵苏
黎平 郝学超 律峰 魏珂 罗洁 曹俊 董军 闵苏
抑郁大鼠电休克治疗后认知功能与突触可塑性研究☆
黎平*郝学超*律峰*魏珂*罗洁*曹俊*董军*闵苏*
目的 评价自噬及突触素在抑郁大鼠电休克(electroconvulsive shock,ECS)治疗后认知功能损害中的作用。方法选择抑郁模型大鼠24只,接受行为学实验评估抑郁行为和学习记忆能力后,随机分为ECS组和抑郁组,每组12只。ECS组连续7 d给予ECS处理,抑郁组给予伪ECS处理。干预结束后再次进行行为学实验。之后各组随机选取6只大鼠取脑组织,采用免疫组化法检测海马区自噬标记蛋白Beclin 1和LC3Ⅱ,另外6只取海马组织,采用ELISA法检测突触素含量。结果干预前,两组抑郁行为和学习记忆成绩差异无统计学意义(P>0.05)。干预后,ECS组与抑郁组相比或与自身干预前相比,糖水偏好百分比(68.2%±8.7%)、直立次数(7.0±1.9)和水平活动距离[(569.5±70.0)cm]增加,逃避潜伏期[(21.9±5.3)s]和空间探索时间[(20.5±3.9)s]延长(均P<0.05);而抑郁组干预前后的变化无统计学意义(P>0.05)。与抑郁组相比,ECS组CA1、CA3、DG区和海马旁Beclin 1和LC3Ⅱ蛋白表达均上调(P<0.05),海马区突触素蛋白含量增加(P<0.05)。结论抑郁大鼠ECS治疗后认知功能损害与ECS激活海马区自噬增加突触素表达有关。
自噬 突触素 抑郁症 电休克治疗 认知功能
电休克治疗(electroconvulsive therapy,ECT)是目前治疗抑郁症最快速有效的措施,但具有学习记忆功能损害等副反应[1-3]。ECT引起海马区神经突触大量生长及长时程增强样改变,被认为是其引起学习记忆功能损害的病理基础[4-5]。最近动物实验发现,自噬对于突触发育至关重要[6],且动物模型中模拟的重复电休克(electroconvulsive shock,ECS)可致健康成年大鼠海马区神经细胞自噬水平明显升高[7]。但ECS是否能引起抑郁大鼠神经细胞自噬的激活,从而导致海马区神经突触形态及功能的改变,尚不清楚。本研究以抑郁大鼠为研究对象,探讨ECS对其海马区神经细胞自噬标记蛋白Beclin 1、LC3Ⅱ及反映突触数量和功能的标记蛋白突触素(synaptophysin,SYP)的影响,评价自噬和突触素在ECS所致学习记忆功能损害中的作用。
1 材料与方法
1.1 动物选择及分组本研究遵守《实验动物使用和管理指南》,研究方案通过重庆医科大学附属第一医院伦理委员会审查批准后实施。清洁级健康成年雄性SD大鼠(体重200~250 g,2~3月龄)由重庆医科大学实验动物中心提供,于标准实验环境(自由采食摄水,12 h/12 h昼夜规律交替,温度22±2℃)中适应性饲养7 d后,进行糖水偏好实验(sucrose preference tests,SPT)和旷场实验(open field tests,OFT)。之后持续28 d采用孤养与慢性轻度不可预见性应激(chronic unpredicted mild stress,CUMS)法建立抑郁模型,建模完毕再次接受SPT和OFT,选择建模成功(行为学评分比建模前下降30%)的抑郁大鼠24只。大鼠随机分为ECS组和抑郁组,每组12只,分别给予ECS和伪ECS处理。
1.2 CUMS法建立抑郁模型每只大鼠单笼饲养,将禁食24 h、禁水24 h、夹尾1min、4℃冰水游泳5 min、45℃热水游泳5min、鼠笼倾斜45°持续24 h、鼠笼水平摇晃1次/s持续15min、潮湿垫料24 h、昼夜颠倒等10种轻度刺激随机安排处理大鼠,所有大鼠每天随机接受其中一种刺激,同种刺激不连续出现,共持续28 d。
1.3 ECS干预ECS组大鼠腹腔注射10mg/mL丙泊酚(KB895,AstraZeneca,英国)80mg/kg,麻醉满意后,应用改良电休克治疗仪(Niviqure-SA型,印度Niviqure公司)实施ECS,将电极夹于大鼠双耳,以双相矩形波(频率125 Hz,波幅0.8 A,波宽1.5 ms)进行电刺激,以诱发大鼠强直—阵挛抽搐发作为成功标准。抑郁组给予伪ECS处理,即大鼠双耳钳夹电极但不通电。干预1次/d,连续7 d。干预前和结束后各进行一次SPT、OFT及Morris水迷宫实验(Morriswatermaze,MWM)。
1.4 抑郁行为评价
1.4.1 SPT评价抑郁行为 第一次实验前训练大鼠适应糖水,每笼放置2瓶1%(g/g)蔗糖溶液24 h。之后禁食、禁饮23 h后,同时放置1%蔗糖溶液和纯水各1瓶,0.5 h后将纯水和蔗糖溶液位置调换,以避免位置偏好引起的测量误差,继续放置0.5 h。分别测量每只大鼠糖水和纯水的消耗量,参照如下公式计算糖水偏好百分比:糖水偏好百分比=糖水消耗量/(糖水消耗量+纯水消耗量)×100%。
1.4.2 OFT评价抑郁行为 按预定的随机顺序,放置大鼠于旷场箱(ZH-ZFT型,淮北正华生物仪器设备有限公司)中央,通过置于上方1m处的摄像头及电脑轨迹追踪系统,记录大鼠3min内水平活动距离(cm)及直立次数(以双前肢抬起,仅以后肢支撑身体为标准)。每只大鼠实验后,用酒精纱布彻底清扫旷场箱,以免大鼠排泄物对后续实验大鼠的活动产生干扰。
1.5 MWM评估学习记忆能力在ECS干预前和干预后各进行一次MWM以评估大鼠学习记忆能力。MWM实验持续6天,实验的第1~5天进行定位巡航实验,平台置于水迷宫东南象限中心处水面下1.5 cm,随机从东、南、西和北4个象限起点处将大鼠面对池壁轻柔放入水中。记录大鼠自下水到登上平台的时间为逃避潜伏期(escape latency,EL)。若60 s时大鼠仍无法找到平台,则用木杆将大鼠轻柔引导至平台,其逃避潜伏期计作60 s。大鼠登上或被引导至平台后,让其在平台上停留15 s,再进行下一次实验。取第3~5天逃避潜伏期的平均值作为最终成绩。第6天进行空间探索实验,撤去平台,将大鼠于原平台所在的相反象限(西北象限)中央处投入水中,记录60 s内大鼠在原平台所在象限的游泳时间,即空间探索时间(space exploration time,SET)。
1.6 免疫组化检测Beclin 1、LC3Ⅱ蛋白表达水平各组随机选取6只大鼠,灌注固定取脑组织,石蜡切片常规脱蜡至水;滴加双氧水灭活内源性过氧化物酶活性;滴加山羊封闭血清工作液;分别滴加Beclin 1(3738,Cell Signaling美国)、LC3Ⅱ(2775,Cell Signaling美国)蛋白一抗,4℃过夜;滴加二抗,37℃孵育30min;滴加辣根标记物,37℃孵育30 min;滴加DAB工作液,立即观察显色效果;冲洗DAB工作液,复染苏木精,中性树胶封片。
每只大鼠随机选择1张切片,于显微镜下观察照相,高倍镜下在海马CA1、CA3、DG区和海马旁随机选取7个视野拍照。采用Image-Pro Plus 6.0图像分析系统,分析阳性表达的平均光密度值,去掉光密度最大和最小的视野,取剩余5个视野数据的平均值纳入分析。
1.7 ELISA检测SYP表达水平各组剩余的6只大鼠处死后采集新鲜海马组织,离心取上清液用于ELISA检测,操作按试剂盒(E-EL-R0932,上海恒斐生物科技公司)使用说明书进行。每块96孔板按SYP标准品浓度(横坐标)和光密度(optical density,OD)值(纵坐标)绘制对应的标准曲线,拟合线性方程,标本的SYP浓度通过其OD值计算而得。
1.8 统计学方法所有统计分析采用SPSS 16.0进行。两组ECS干预前后抑郁行为、学习记忆成绩的比较采用重复测量方差分析,组间比较采用独立样本t检验,ECS前后比较采用配对样本t检验;自噬标记蛋白和SYP的组间比较采用独立样本t检验。检验水准α为0.05,双侧检验。
2 结果
2.1 抑郁行为学成绩重复测量方差分析结果显示,糖水偏好百分比(F=5.221,P=0.027)、直立次数(F=54.350,P<0.001)和水平活动距离(F=30.735,P<0.001)的时间与分组交互效应均具有统计学意义;其组间效应、时间效应也均具有统计学意义(均P<0.01)。ECS前,各评分的组间差异无统计学意义(均P>0.05),ECS后与抑郁组相比,ECS组糖水偏好百分比升高(t=-5.013,P<0.001),直立次数增加(t=-11.662,P<0.001),水平活动距离延长(t=-6.035,P<0.001);与ECS前相比,干预后ECS组糖水偏好百分比升高(t=-6.220,P<0.001),直立次数增加(t=-14.600,P<0.001),水平活动距离延长(t=-6.715,P<0.001),抑郁组各评分变化均无统计学意义(P>0.05)。见表1。
2.2 MWM学习记忆成绩重复测量方差分析结果显示,逃避潜伏期(F=4.972,P=0.031)和空间探索时间(F=21.976,P<0.001)的时间与分组交互效应有统计学意义,其组间效应、时间效应也均具有统计学意义(均P<0.05)。ECS前,各评分的组间差异无统计学意义(均P>0.05),ECS后与抑郁组相比,ECS组逃避潜伏期(t=-6.471,P<0.001)和空间探索时间(t=2.403,P=0.025)延长;与ECS前相比,干预后ECS组逃避潜伏期(t=-11.052,P<0.001)和空间探索时间(t=3.945,P=0.002)延长,抑郁组各得分变化均无统计学意义(P>0.05)。见表2。
2.3 海马区Beclin 1、LC3Ⅱ和SYP蛋白如图1和图2所示,两组大鼠海马CA1、CA3、DG区和海马旁可见棕色的Beclin 1、LC3Ⅱ阳性表达(图中箭头所示),主要在神经元胞浆、轴突可见。与抑郁组相比,ECS组CA1(t=-4.402,P=0.001)、CA3(t=-3.514,P=0.006)、DG区(t=-2.366,P=0.040)和海马旁(t=-4.095,P=0.002)Beclin 1蛋白表达上调;ECS组CA1(t=-3.443,P=0.006)、CA3(t=-6.615,P<0.001)、DG区(t=-2.501,P=0.031)和海马旁(t=-3.407,P=0.007)LC3Ⅱ蛋白表达也上调;海马区SYP蛋白含量增加(t=-3.543,P=0.005)。见表3。
3 讨论
本研究发现,ECS改善大鼠抑郁行为的同时引起抑郁大鼠学习记忆功能损害,在分子生物学方面,ECS激活抑郁模型大鼠海马区神经细胞自噬,上调突触素表达。
表1 两组大鼠ECS前后抑郁行为学评分(±s)
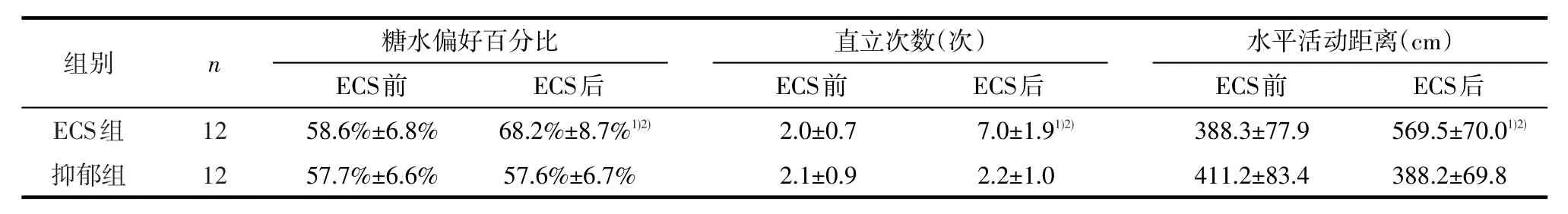
表1 两组大鼠ECS前后抑郁行为学评分(±s)
1)与抑郁组比较,经独立样本t检验,P<0.05;2)与ECS前比较,经配对样本t检验,P<0.05
组别ECS组抑郁组ECS后569.5±70.01)2)388.2±69.8n12 12糖水偏好百分比ECS前58.6%±6.8% 57.7%±6.6% ECS后68.2%±8.7%1)2)57.6%±6.7%直立次数(次)ECS前2.0±0.7 2.1±0.9 ECS后7.0±1.91)2)2.2±1.0水平活动距离(cm)ECS前388.3±77.9 411.2±83.4
表2 两组大鼠ECS前后MWM学习记忆成绩(±s)
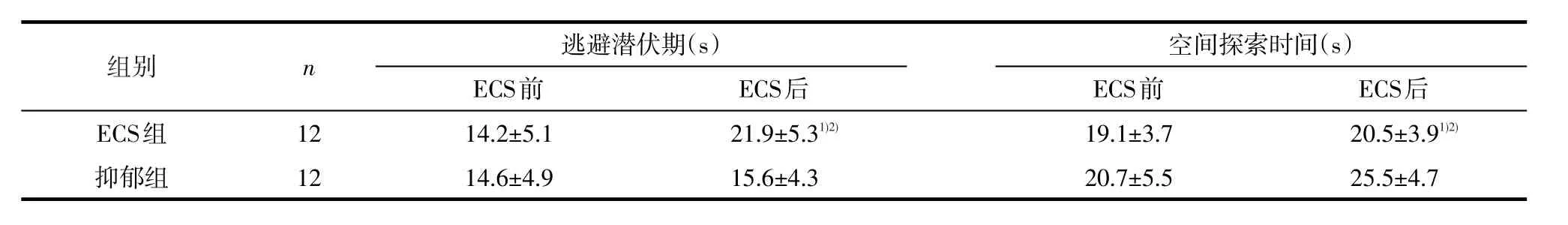
表2 两组大鼠ECS前后MWM学习记忆成绩(±s)
1)与抑郁组比较,经独立样本t检验,P<0.05;2)与ECS前比较,经配对样本t检验,P<0.05
组别ECS组抑郁组n12 12逃避潜伏期(s)ECS前14.2±5.1 14.6±4.9 ECS后21.9±5.31)2)15.6±4.3空间探索时间(s)ECS前19.1±3.7 20.7±5.5 ECS后20.5±3.91)2)25.5±4.7
表3 两组大鼠ECS后海马区Beclin 1、LC3Ⅱ和SYP蛋白表达(±s)

表3 两组大鼠ECS后海马区Beclin 1、LC3Ⅱ和SYP蛋白表达(±s)
1)与抑郁组比较,经独立样本t检验,P<0.05
组别ECS组抑郁组SYP(μg/mL)0.77±0.131)0.54±0.09n6 6 Beclin 1 LC3 CA1 0.27±0.021)0.23±0.01 CA3 0.28±0.021)0.24±0.01 DG 0.27±0.061)0.20±0.04海马旁0.29±0.021)0.25±0.01 CA1 0.26±0.021)0.22±0.02 CA3 0.26±0.021)0.20±0.01 DG 0.25±0.031)0.20±0.04海马旁0.31±0.031)0.26±0.02
Beclin-1是启动自噬的关键分子,被认为是自噬的“看门人”[8];LC3Ⅰ通常存在于细胞浆中,自噬激活时其向LC3Ⅱ转化并转移到自噬体膜上,常被作为自噬激活的标志物。本研究结果示,ECS处理后,抑郁大鼠海马区Beclin-1和LC3Ⅱ/Ⅰ表达增加,提示海马区神经细胞自噬水平明显升高。与Otabe等[7]在正常成年大鼠经ECS处理后观察到的效应一致。
突触素蛋白是反映突触数量和功能的常用标记蛋白。ECS引起的突触素过度表达可能是其导致学习记忆损害的分子基础。本研究发现,ECS处理后抑郁大鼠海马区突触素表达明显增加,这与前期关于ECS对海马区神经突触增强效应的研究报道一致[4]。生理水平的突触数量是维持神经传导功能及可塑性的基础,过度增长的神经突触可损害突触可塑性[9]。ECS损害抑郁大鼠学习记忆功能,可能与其过度上调突触素的表达,打破了海马区神经突触调控的稳态有关。

图1 ECS组、抑郁组大鼠海马CA1(图A、B)、CA3(图C、D)、DG区(图E、F)和海马旁(图G、H)Beclin 1蛋白表达(SP法免疫组化染色,DAB显色,400×,标尺20μm,箭头指示目标蛋白)

图2 ECS组、抑郁组大鼠海马CA1(图A、B)、CA3(图C、D)、DG区(图E、F)和海马旁(图G、H)LC3Ⅱ蛋白表达(SP法免疫组化染色,DAB显色,400×,标尺20μm,箭头指示目标蛋白)
本研究发现ECS可以显著激活抑郁大鼠海马区神经细胞的自噬水平。研究表明,自噬参与突触发生的调控,激活自噬可以通过对抑制性突触发生的信号通路分子highwire蛋白的抑制作用而间接上调激活性信号通路JNK-AP-1,而引起神经肌肉接头处的突触过度生长[10-11]。鉴于自噬是一种高度保守的细胞活动过程,在不同物种、个体、器官组织水平差异并不大,推测在抑郁大鼠中ECS激活自噬后可能通过类似的机制引起神经突触过度发生,增生的大量突触可引发“突触可塑性的可塑性”发生改变[9],从而损害学习记忆功能。
ECS引起谷氨酸能系统的兴奋可能是其激活自噬的主要机制之一。本课题组前期研究发现,多次ECS处理后,大鼠脑内谷氨酸水平及其NMDA受体NR2B亚基表达量明显升高[12]。Kumari等[13]发现,在细胞水平用谷氨酸处理神经细胞可以引起神经细胞线粒体损伤并伴随细胞自噬的激活,硒可以抑制谷氨酸引起的自噬激活并减轻谷氨酸的损伤作用。激活δ2谷氨酸受体可以明显上调细胞自噬水平并导致细胞发生谷氨酸兴奋性毒性损伤[14]。
Otabe等[7]认为自噬可能是ECS抗抑郁效应的机制,抑郁症导致自噬下调、突触减少,ECS激活自噬、上调突触素表达可能发挥抗抑郁效应。本研究结果提示海马区自噬和突触素参与ECS后抑郁大鼠认知功能损害,推测自噬过度激活致突触素过表达,损害突触可塑性,从而导致认知功能损害,确切机制还有待进一步研究。
综上所述,ECS后抑郁大鼠认知功能下降与其过度激活海马区神经细胞自噬并促进突触素过表达有关。
[1] Li X,LiW,Luo J,et al.Effects of prop of ol on the activation of hippocampal CaMKI Ialpha in depressed rats receiving electroconvulsive therapy[J].JECT,2012,28(4):242-247.
[2] 李晓,闵苏,李炜,等.异丙酚联合电休克对抑郁大鼠海马卡配因1-细胞周期依赖性蛋白激酶5通路的影响[J].中国神经精神疾病杂志,2013,39(1):11-16.
[3] Sedighinejad A,Nabi BN,Haghighi M,et al.Electroconvulsive therapy-related cognitive impairment and choice of anesthesia:the tipping point[J/OL].JECT,2014[2014-09-26]..
[4] LiW,Liu L,Liu YY,et al.Effects of electroconvulsive stimulation on long-term potentiation and synaptophysin in the hippocampus of ratswith depressive behavior[J].JECT,2012,28(2): 111-117.
[5] Gombos Z,Spiller A,Cottrell GA,et al.Mossy fiber sprouting induced by repeated electroconvulsive shock seizures[J].Brain Res,1999,844(1-2):28-33.
[6] Chen Y,Wei G,Nie H,et al.Beta-Asarone prevents autophagy and synaptic loss by reducing ROCK expression in asenescence-accelerated prone 8 mice[J].Brain Res,2014,1552: 41-54.
[7] Otabe H,Nibuya M,Shimazaki K,et al.Electroconvulsive seizures enhance autophagy signaling in rat hippocampus[J].Prog Neuropsychopharmacol Biol Psychiatry,2014,50:37-43.
[8] ZhangW,He C.Regulation of plasmamembrane receptors by a new autophagy-related BECN/Beclin familymember[J].Autophagy,2014,10(8):1472-1473.
[9] Mimura K,Kimoto T,Okada M.Synapse efficiency diverges due to synaptic pruning following overgrowth[J].Phys Rev E Stat Nonlin S of tMatter Phys,2003,68(3 Pt1):031910.
[10] Shen W,Ganetzky B.Autophagy promotes synapse development in Drosophila[J].J Cell Biol,2009,187(1):71-79.
[11] West RJ,Sweeney ST.Oxidative stress and autophagy:mediators of synapse growth?[J].Autophagy,2012,8(2):284-285.
[12] Dong J,Min S,Wei K,et al.Effects of electroconvulsive therapy and prop of ol on spatialmemory and glutamatergic system in hippocampus of depressed rats[J].JECT,2010,26(2):126-130.
[13] Kumari S,Mehta SL,Li PA.Glutamate induces mitochondrial dynamic imbalance and autophagy activation:preventive effects of selenium[J].P LoS One,2012,7(6):e39382.
[14] Yue Z,Horton A,Bravin M,etal.A novel protein complex linking the delta 2 glutamate receptor and autophagy:implications for neurodegeneration in lurcher mice[J].Neuron,2002,35(5): 921-933.
The study of cognitive function and synaptic p lasticity in depressed rats follow ing electroconvulsive shock.
LI Ping,HAO Xuechao,LV Feng,WEI Ke,LUO Jie,CAO Jun,Dong Jun,MIN Su.
Department of anesthesiology,the first affiliated hospital of Chongqing medical university,Chongqing 400016,China.Tel:023-89011068.
ObjectiveTo investigate the role of autophagy and synaptophysin(SYP)in cognitive impairment in depressed rats receiving electroconvulsive shock(ECS).MethodsClean and healthy adultmale Sprague-Dawley ratswere acclimatized to a standard laboratory environment for 7 days.The chronic unpredictablemild stress(CUMS)was used to establish the ratmodel of depression.Behavior tests were conducted before and after CUMS to evaluate the depression and cognition level of rats.After establishment of themodel,24 ratswere randomly divided into ESC group(group E)and depression group(group D)with 12 rats in each group.The rats in group Ewereadministered 80mg/kg of prop of ol(10 mg/mL)by intraperitoneal injection,followed by ECS treatment.The rats in group D were administered prop of ol by intraperitoneal injection,followed by sham-ECS treatments.The above interventions were conducted daily for 7 consecutive days.After the interventions,rats underwent behavior tests as before.Subsequently,ratswere killed and specimenswere collected formeasurements.Immunohistochemistry was performed to examine autophagymarkers such as Beclin 1 and LC3Ⅱand ELISA was used to detect SYP in the hippocampus.ResultsGroup Eafter ECS significantly increased the percentage of sucrose preference(68.2%±8.7%),rearing times(7.0±1.9),total horizontal distance[(569.5±70.0)cm],escape latency[(21.9±5.3)s]and space exploration time[(20.5±3.9)s]compared with group D or group Ebefore ECS.There was no significant difference in these index between groups before EC Sor in group Ebetween before and after ECS(P>0.05).Compared with group D,group E had upregulated protein expression levels of Beclin 1 and LC3Ⅱin CA1,CA3, DG aswell as the area near the hippocampus and increased SYP contents(P<0.05).ConclusionsCognitive impairment in depression rats following EC Scorrelateswith activated autophagy and increased SYP by ECS.
Autophagy Synaptophysin Depression Electroconvulsive Therapy Cognition
R749.4
A
2014-06-29)
(责任编辑:肖雅妮)
10.3936/j.issn.1002-0152.2014.12.003
☆国家临床重点专科建设项目(编号:财社【2011】170号);重庆市医学重点学科建设项目(编号:渝卫科教【2007】2号);重庆市科委自然科学基金(编号:cstc2013jcyjA0433)
*重庆医科大学附属第一医院麻醉科(重庆 400016)
