敲低S100A4表达对胶质瘤细胞系SNB19侵袭和迁移的影响☆
2014-04-28赵鹏飞杨学军张辰陈磊周华朱蒙王垒垒赵恺于圣平林雨海龙刘波周星辰李帅
赵鹏飞 杨学军 张辰 陈磊 周华 朱蒙 王垒垒 赵恺 于圣平 林雨 海龙 刘波 周星辰 李帅
敲低S100A4表达对胶质瘤细胞系SNB19侵袭和迁移的影响☆
赵鹏飞*杨学军*张辰*陈磊*周华*朱蒙*王垒垒*赵恺*于圣平*林雨*海龙*刘波*周星辰*李帅*
目的 观察siRNA敲低S100A4的表达后对胶质瘤细胞系SNB19侵袭和迁移能力的影响。方法S100A4干扰RNA(siRNA)敲低SNB19细胞中S100A4的表达(n=3),同时设control组(空白对照组,n=3)和siRNA-NC组(阴性对照组,n=3),采用RT-PCR和western blot方法分别检测S100A4被有效敲低,划痕实验和Transwell实验分别检测细胞的迁移和侵袭能力的变化,western blot法检测基质金属蛋白酶2(MMP-2)、基质金属蛋白酶9(MMP-9)和E-cadherin的表达变化,倒置相差显微镜观察细胞片状伪足变化情况。结果siRNA技术可显著下调SNB19细胞中S100A4mRNA和蛋白的表达水平,siRNA-NC组和siRNA-S100A4组的mRNA较control组的表达量分别是0.97±0.07和0.21±0.04(P<0.01),三个组的蛋白相对表达量分别为78.12%±2.63%、77.16%± 3.00%和37.95%±2.71%(P<0.01);干扰成功后,siRNA-S100A4组与control组相比,细胞的迁移和侵袭能力分别降低了46%和55%,MMP-9和MMP-2的蛋白表达水平分别下调了62%和68%,E-cadherin的表达水平上调了154%,细胞片状伪足较对照SNB19细胞相比明显变小,差异均有统计学意义(P<0.01)。结论敲低S100A4表达可降低胶质瘤细胞系SNB19的侵袭和迁移能力,提示S100A4可能成为抗胶质瘤侵袭迁移治疗的有效靶点。
S100A4 胶质瘤 RNA干扰 侵袭 迁移
作为最常见的原发性中枢神经系统肿瘤,胶质瘤现阶段的临床治疗原则是以手术为主并辅以放、化疗,但恶性胶质瘤颅内播散性的生长方式,使其治疗效果并不理想,患者的中位生存期仅为14个月[1]。而针对侵袭性生长特点的分子靶向治疗为恶性胶质瘤的治愈提供了可能,其中S100A4就是可供选择的潜在靶点之一。S100A4是S100蛋白超家族的成员之一,其阳性表达定位于细胞质、细胞核或者胞质胞核共存,在肿瘤、炎症和心肌疾病等疾病中该蛋白的表达水平会发生变化[2]。相关研究表明,S100A4在食管癌、胰腺癌、结直肠癌等多种肿瘤中高表达并与肿瘤的生长、转移、播散以及不良预后相关[3-5]。因此,本实验以胶质瘤细胞系SNB19作为研究对象,探究S100A4对促进胶质瘤侵袭、迁移行为的影响及其作用机制。
1 材料与方法
1.1 研究对象人胶质瘤细胞系SNB19购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所细胞库,由天津市神经病学研究所冻存。S100A4干扰RNA序列5'-CGAGGUGGACUUCCAAGAGTT-3',无义序列5'-UUCUCCGAACGUGUCACGUTT-3',均由上海吉玛公司设计合成。实验所用引物购自苏州金唯智公司。lipo3000转染试剂购于美国invitrogen公司。S100A4抗体为abcam公司产品。E-cadherin抗体为santacruz公司产品。MMP-2、MMP-9抗体均购自武汉博士德公司。小鼠抗GAPDH单抗、辣根酶标记山羊抗小鼠IgG和山羊抗兔IgG二抗均购于中杉金桥公司。RT-PCR逆转录试剂盒购自Promega公司。SYBR Green PCR MasterMix为罗氏公司产品。Transwell小室购自美国corning公司。Matrigel基质胶购自于美国BD公司。
1.2 细胞培养和siRNA的转染细胞采用含10%胎牛血清DMEM培养液,于37℃、5%CO2、饱和湿度的恒温培养箱培养。将处于对数生长期的SNB19细胞(1×106个)接种到6孔板中,于第2天进行转染。实验分空白对照组(control)、无义序列组(siRNA-NC)和RNA干扰组(siRNA-S100A4)。筛选出siRNA与lipo3000转染试剂的最适配比,将其孵育于500μL无血清培养基中,对应的加入siRNA-NC组和siRNA-S100A4组,control组只加入同等量的lipo3000转染试剂。
1.3 RT-PCR检测S100A4基因m RNA表达水平分别提取转染24h后control组、siRNA-NC组和siRNA-S100A4组细胞的总RNA,进行逆转录和Real-time PCR扩增,以GAPDH作为内参照。PCR扩增体系20μL,扩增条件:95℃预变性5min;95℃20s,退火60℃40s,延伸72℃20s,共40个循环;最后延伸72℃10min。S100A4上游引物:5'-TCA GAA CTA AAG GAG CTG CTG ACC-3';下游引物:5'-TTT CTT CCT GGG CTG CTT ATC TGG-3'。GAPDH上游引物:5'-AAT CCC ATC ACC ATC TTC CAG GAG-3';下游引物:5'-GCA TTG CTG ATG ATC TTG AGG CTG-3'。实验结果以GAPDH为内参照,采用2-△△ct计算S100A4 mRNA的相对表达水平。各组均设复孔3个,重复实验3次。
1.4 western blot检测S100A4、MM P-9、MM P-2和E-cadherin的表达分别收集转染48h后的control组、siRNA-NC组和siRNA-S100A4组细胞,用4℃预冷的PBS液洗涤细胞3次,每个6孔板的孔加入200μL裂解液(PMSF:RIPA=1:100),置于冰上裂解30min;将裂解液转移至离心管内在4℃离心机中离心,12000r/min,15min;吸取上清并测量蛋白浓度,与含DTT的上样缓冲液(DTT:上样缓冲液=1:4)等体积混合后煮沸;分装存储于-20℃。取同组样品蛋白,行SDS-聚丙烯酰胺凝胶(SDS-PAGE)电泳,冰浴下电转移至醋酸纤维素(PVDF)膜,膜封闭液室温封闭2h,剪膜后分别加入小鼠抗GAPDH(1:1000)、小鼠抗E-cadherin(1:250)、兔抗S100A4(1:1000)、兔抗MMP-9(1:200)和兔抗MMP-2(1:200)一抗4℃孵育过夜,次日复温1h,相应加入辣根酶标记山羊抗小鼠二抗或抗兔二抗(1:1000)室温孵育1 h。结果采用凝胶成像分析系统扫描,检测蛋白条带的表达。
1.5 划痕实验检测细胞迁移能力于6孔板中将转染24h后的3组SNB19细胞,用200μL无菌枪头顶端垂直于板底部划十字痕,用PBS洗涤细胞3次,加无血清培养基放入培养箱培养,分别于0h和48h时于倒置相差显微镜下观察细胞迁移的情况,随机选取3个视野(×100),计算间隙的融合面积(以百分比来表示,0h时为0,全部融合为100%)。实验重复3次。
1.6 Transwell实验检测细胞侵袭能力Transwell上室中加入1:2(Martrigel胶:无血清培养基)稀释后的Martrigel胶50μL,37℃放置30min使其聚合成凝胶。在下室中加入含血清培养液500μL。用胰酶消化未转染细胞和转染后培养24h的细胞,制成无血清细胞悬液,计数调整细胞密度为3×105个/mL。在上室加入上述细胞悬液200μL,将装有小室的24孔板放于培养箱培养48h,取出小室后放于多聚甲醛固定5min,结晶紫染色5min,倒置显微镜下观察迁移到膜下的细胞数量。分别于每张膜的中央和周围部分随机选取5个不重复视野(×100),计数每个视野中的细胞数目。实验重复3次。
1.7 倒置相差显微镜下观察细胞片状伪足的变化情况将处于对数生长期的不同处理组(转染后24h)的SNB19胶质瘤细胞分别接种到6孔板中,加入含10%胎牛血清的DMEM培养液培养24h后,置于倒置相差显微镜下(×200)进行拍摄,随机选取3个不重复视野,以观察不同处理组间细胞伪足的变化情况。实验重复3次。
1.8 计算方法实验中siRNA-S100A4组与control组的数据比较计算公式:抑制率=(control组平均值—siRNA-S100A4组平均值)/control组平均值× 100%;上调率=(siRNA-S100A4组平均值—control平均值)/control组平均值×100%。
1.9 统计学处理所有实验数据经SPSS18.0分析。计量资料以均数±标准差(±s)表示,比较采用单因素方差分析,进一步两两比较采用SNK检验,检测水准α=0.05。
2 结果
2.1 S100A4 m RNA和蛋白的表达情况RT-PCR检测siRNA-NC组和siRNA-S100A4组S100A4的mRNA较control组的倍数变化(2-△△ct值)分别是0.97±0.07和0.21±0.04,说明siRNA-NC组mRNA的表达无明显降低(P>0.05),siRNA-S100A4组mRNA表达明显降低,差异有统计学意义(F= 235.28,P<0.01)(图1A)。Western blot检测显示三个组的蛋白相对表达量分别为78.12%±2.63%、77.16%±3.00%和37.95%±2.71%,siRNA-S100A4组与control组、siRNA-NC组相比,S100A4蛋白的表达量显著降低(F=203.68,P<0.01)(图1B)。
2.2 转染S100A4干扰RNA对细胞侵袭和迁移能力的影响划痕实验中,与control组和siRNA-NC组相比,siRNA-S100A4组细胞的迁移能力下降,间隙融合率明显减少(F=529.99,P<0.01)(表1,图2)。Transwell实验中,与control组和siRNA-NC组相比,siRNA-S100A4组细胞的侵袭能力下降,侵袭至Transwell小室滤膜下表面的平均每个视野细胞数明显减少(F=57.27,P<0.01)(表1,图2)。
2.3 Western blot检测相关蛋白的表达情况Western blot检测结果显示,与control组和siRNA-NC组相比,siRNA-S100A4组E-cadherin的表达明显升高(F=109.32,P<0.01),MMP-9(F=339.81,P<0.01)、MMP-2(F=169.74,P<0.01)的表达明显降低(表2,图3)。与control组相比,siRNA-S100A4组MMP-9和MMP-2的蛋白表达水平分别下调了62%和68%,E-cadherin的表达水平上调了154%。
2.4 转染S100A4干扰RNA对SNB19细胞片状伪足的影响倒置相差显微镜(×200)下观察细胞片状伪足,与control组和siRNA-NC组相比,siRNA-S100A4组细胞前端的片状伪足明显变小甚至不再向前伸出(图4)。
3 讨论

表1 划痕和Transwell实验分别检测不同处理组SNB19细胞的迁移、侵袭能力
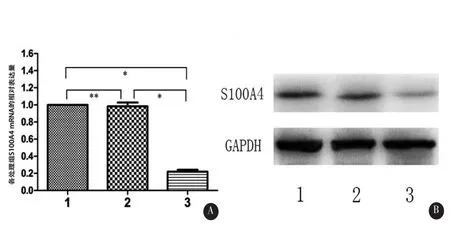
图1 不同的SNB19细胞处理组S100A4mRNA和蛋白的表达A: RT-PCR检测S100A4的mRNA表达;B:Western blot检测S100A4蛋白的表达。1.control组2.siRNA-NC组3.siRNA-S100A4组。**P>0.05,*P<0.01
S100蛋白家族是一类低分子量(10~12kDa)、钙离子依赖性的蛋白,作为其中一员,S100A4蛋白与其他家族成员一样通过调控其他蛋白的表达和直接与靶蛋白结合两种方式发挥生物学功能[2,6]。研究表明,S100A4蛋白与许多恶性肿瘤的发生、发展密切相关,Wang[7]等发现在乳腺癌细胞中转染并高表达S100A4蛋白,促进了肿瘤的生长并促进肿瘤向淋巴结等器官转移;Zhang[8]等研究结果显示在高侵袭性的人骨肉瘤细胞中,敲低S100A4蛋白的表达,有效抑制了肿瘤生长和向远处转移。

图2 A:划痕实验检测3个处理组的SNB19细胞迁移(×100)的能力;B:Transwell实验检测3个处理组SNB19细胞侵袭(×100)的能力

图3 Western blot检测SNB19细胞的不同处理组MMP-9、MMP-2和E-cadherin的表达量。1.control组2.siRNA-NC组3.siRNA-S100A4组
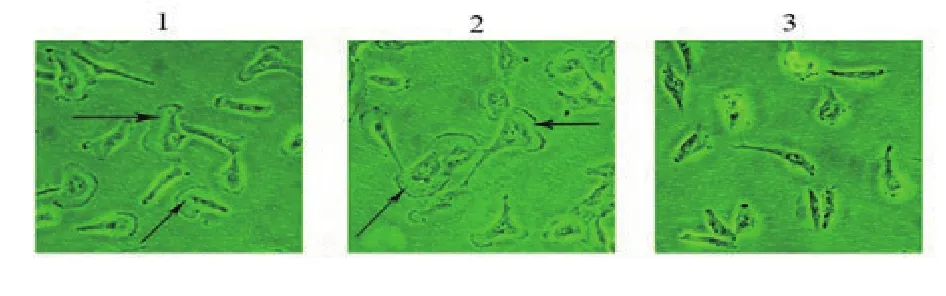
图4 倒置相差显微镜观察SNB19细胞的不同处理组细胞片状伪足的大小(×200)。1.control组2.siRNA-NC组3.siRNA-S100A4组。箭头所指为伸出的片状伪足
胶质瘤属于人类预后极差的肿瘤之一,其颅内播散是其难以治愈的关键所在。本研究证明了S100A4在胶质瘤侵袭、迁移中的作用,并发现了其表达水平对E-cadherin、MMP-9和MMP-2的调控作用以及对细胞片状伪足的影响,阐明了其在胶质瘤颅内侵袭过程中的作用机制。

表2 不同处理组MMP-9、MMP-2和E-cadherin的表达量
首先我们采用RNA干扰技术敲低S100A4的表达,通过RT-PCR、western blot分别验证siRNA-S100A4组SNB19胶质瘤细胞中S100A4 mRNA和蛋白的表达明显降低。然后通过划痕实验和Transwell实验检测siRNA敲低S100A4表达后细胞运动能力的变化,结果显示siRNA-S100A4组SNB19细胞的侵袭、迁移能力明显下降,说明S100A4对胶质瘤的侵袭、迁移起到促进作用。
然而,S100A4在胶质瘤的侵袭过程中又是如何发挥作用的呢?我们知道,胶质瘤在颅内侵袭可大体分为四个步骤:①肿瘤细胞脱离原发肿瘤团块;②肿瘤细胞粘附于细胞外基质;③肿瘤细胞降解细胞外基质;④细胞改变自身形状,胞体向前运动[9]。因此,胶质瘤发生播散首先要削弱细胞间的粘附能力,而E-cadherin是一类主要介导细胞同质粘附的蛋白,增强同种细胞间的粘附能力[10]。我们观察到E-cadherin的表达在S100A4被敲低后明显升高,说明S100A4可以通过下调E-cadherin来减少细胞间的粘附能力,使具有高侵袭性的胶质瘤细胞脱离原有的肿瘤团块,向远处播散。
基质金属蛋白酶(matri xmetalloproteinases, MMPs)可介导细胞外基质降解,是肿瘤细胞发生侵袭和转移的关键蛋白[11]。MMP-9和MMP-2作为胶质瘤侵袭行为的标志分子蛋白,与胶质瘤的分级和预后相关[12],因此,我们检测了S100A4与MMP-9和MMP-2表达的关系,并发现MMPs表达在S100A4下调后也明显降低,说明S100A4可以上调胶质瘤细胞中MMPs的表达从而促进细胞外基质的降解和重塑,破坏胶质瘤细胞侵袭的组织学屏障,为细胞的运动提供更加良好的外环境。
最后,肿瘤细胞向前运动,需要改变自身形态,向前伸出的片状伪足在细胞运动中的作用非常重要,失去伪足后细胞的运动能力下降[13]。本研究发现,敲低S100A4的表达后,细胞的片状伪足明显变小或不再向前伸出,说明在胶质瘤细胞中,S100A4可促使细胞伪足的伸出,其原因可能是S100A4能与多种细胞骨架蛋白相互结合并相互作用导致细胞骨架重排,细胞发生变形从而提高细胞的运动能力[14],其中的具体机制,本课题组将继续探索,进一步深入的研究。
综上所述,我们认为S100A4在胶质瘤侵袭、迁移的全过程中发挥了十分重要的作用。本课题组也通过实验证明了敲低S100A4的表达可降低胶质瘤细胞系SNB19的侵袭和迁移能力。胶质瘤中相关信号转导通路的作用及相互调节机制尚未完全清楚,由于信号通路间的交互作用,使得抑制单个靶点的作用效果不够明显,因此多靶点联合抑制是一种重要的靶向药物研发思路,S100A4在胶质瘤中的生物学功能被研究后,相信其可作为调控胶质瘤侵袭、迁移的靶点之一,为胶质瘤的治疗提供新的路径。
[1] Cuddapah VA,Robel S,Watkins S,et al.A neurocentric perspective on glioma invasion[J].Nat Rev Neurosci,2014,15(7): 455-465.
[2] Gross SR,Sin CG,Barraclough R,et al.Joining S100 proteins and migration:for better or for worse,in sickness and in health [J].CellMol Life Sci,2014,71(9):1551-1579.
[3] Chen D,Zheng XF,Yang ZY,etal.S100A4 silencing blocks invasive ability of esophageal squamous cell carcinoma cells[J].
[4] World J Gastroenterol,2012,18(9):915-922.
[4]LiN,Song MM,Chen XH,etal.S100A4 siRNA inhibits human pancreatic cancer cell invasion in vitro[J].Biomed Environ Sci, 2012,25(4):465-470.
[5] Huang L,Xu Y,CaiG,etal.Downregulation of S100A4 expression by RNA interference suppresses cell growth and invasion in human colorectal cancer cells[J].Oncol Rep,2012,27(4): 917-922.
[6] Donato R.Intracellular and extracellular roles of S100 proteins [J].Microsc Res Tech,2003,60(6):540-551.
[7] Wang L,Wang X,Liang Y,et al.S100A4 promotes invasion and angiogenesis in breast cancer MDA-MB-231 cells by upregulating matrix metalloproteinase-13[J].Acta Biochim Pol, 2012,59(4):593-598.
[8] Zhang G,LiM,Jin J,etal.Knockdown of S100A4 decreases tumorigenesis and metastasis in osteosarcoma cells by repression of matrix metalloproteinase-9[J].Asian Pac J Cancer Prev, 2011,12(8):2075-2080.
[9] Kwiatkowska A,Symons M.Signaling determinants of glioma cell invasion[J].Adv Exp Med Biol,2013,986:121-141.
[10] Maitre JL,Heisenberg CP.Three functions of cadherins in cell adhesion[J].Curr Biol,2013,23(14):R626-633.
[11] Pytliak M,Vargova V,Mechirova V.Matrix metalloproteinases and their role in oncogenesis:a review[J].Onkologie,2012,35 (1-2):49-53.
[12] Sayegh ET,Kaur G,Bloch O,et al.Systematic review of protein biomarkers of invasive behavior in glioblastoma[J].Mol Neurobiol,2014,49(3):1212-44.
[13] 刘志峰,杨学军,刘彬,等.Arp2/3复合物表达沉默对胶质瘤细胞侵袭和迁移的影响[J].中国神经精神疾病杂志,2013, 39(3):129-134.
[14] Li ZH,Bresnick AR.The S100A4 metastasis factor regulates cellularmotility via a direct interaction withmyosin-IIA[J].Cancer Res,2006,66(10):5173-5180.
The effects of knockdown of S100A4 on invasion and migration of SNB19 glioma cells.
ZHAO Pengfei,YANG Xuejun,ZHANG Chen,CHEN Lei,ZHOU Hua,ZHU Meng,WANG Leilei,ZHAO Kai,YU Shengping,LIN Yu,HAI Long, LIU Bo,ZHOU Xingchen,LI Shuai.
Department of neurosurgery,General Hospital of Tianjin Medical University,154 Anshan Road,Tianjin 300052,China.Tel:022-60814469.
ObjectiveTo investigate the effects of siRNA-mediated knockdown of S100A4 expression on the invasion and migration of SNB19 glioma cells.MethodsThe S100A4 expression was knockdowned using S100A4 siRNA in SNB19 glioma cells.Glioma cells were assigned into control group,siRNA-negative control treated group(siRNA-NC) and siRNA-S100A4 group.RT-PCR and western blotwere used to detect themRNA and protein expression of S100A4, respectively.The wound-healing assay and transwell invasion assay were used to determine the ability of migration and invasion of SNB19 glioma cells,respectively.The expression of matrixmetalloproteinase 9(MMP-9),matrixmetalloproteinase 2(MMP-2)and E-cadherin proteinswere evaluated by usingwestern blot.Moreover,themorphology of lamellipodia of glioma cellswere examined by using inverted phase-contrastmicroscopy.ResultsThemRNA and protein expression levels of S100A4 was obviously down-regulated after transfection of S100A4 siRNA.Compared with control group, themRNA expression levels of S100A4 in siRNA-NC group and siRNA-S100A4 group were 0.97±0.07 and 0.21±0.04,respectively(P<0.01).The protein expression levels of S100A4 in control,siRNA-NC and siRNA-S100A4 groupswere 78.12%±2.63%,77.16%±3.00%and 37.95%±2.71%,respectively(P<0.01).Themigration and invasiveness capability were decreased up to 46%and 55%in the siRNA-S100A4 group compared with the control group(P<0.01).The protein expression levels of MMP-9 and MMP-2 were inhibited up to 62%and 68%(P<0.01)whereas the expression of E-cadherin was increased up to 154%(P<0.01)in the siRNA-S100A4 group.The lamellipodia became smaller or unextended in siRNA-S100A4-treated SNB19 glioma cells.ConclusionS100A4 plays an important role in the invasion and migration of glioma cells,suggesting that S100A4might be a potential candidate for anti-glioma strategy to prevent the invasion andmigration of glioma cells.
S100A4 glioma RNA interference invasion migration
R739.4
A
2014-09-28)
(责任编辑:甘章平)
10.3936/j.issn.1002-0152.2014.12.009
☆国家自然科学基金项目(编号:81272782,81472352)资助;高等学校博士学科点专项科研基金(编号:20131202110006)资助
*天津医科大学总医院神经外科(天津 300052)
