Arc/Arg3.1在糖尿病性脑病大鼠海马组织中的表达及其与认知功能改变的关系
2014-04-28朱奕潼
朱奕潼,苗 雅,何 婷,钟 远
(上海交通大学附属第六人民医院老年病科,上海 200233)
我国糖尿病患者已超过9 200万,成为世界第一糖尿病大国。长期血糖控制不良引起的糖尿病并发症是糖尿病致残、致死的主要原因。糖尿病对中枢神经系统造成的损害形成了糖尿病中枢神经系统并发症。1963年Nielsen提出糖尿病性脑病(diabetic encephalopathy,DE)概念。DE的发病机制不明,目前的研究热点主要集中于血流动力学改变、胰岛素代谢紊乱、炎症反应、神经营养因子作用等方面。近年来,学者们普遍认为突触可塑性改变导致海马依赖性情景记忆的缺失是DE发病、长时程记忆难以形成的重要机制[1,2]。活性调节细胞骨架相关蛋白(activity-regulated cytoskeletal protein,Arc)/活性调节基因3.1蛋白同系物(activity-regulated gene 3.1 protein homolog,Arg3.1)是一种独特的即早基因(immediate early gene,IEG),其表达产物Arc蛋白与长时程增强(long-term potentiation,LTP)密切相关,对记忆巩固和突触可塑性至关重要。本课题组前期研究中采用小剂量链脲佐菌素(streptozotocin,STZ)腹腔注射联合高脂饮食建立了DE大鼠模型,证实了DE大鼠学习、记忆能力较正常大鼠明显下降[3]。本研究拟在此模型基础上,观察其海马组织Arc和β淀粉样蛋白肽(amyloidbeta peptide,Aβ)的表达变化,从而探讨突触可塑性改变在DE发病机制中扮演的角色,为预防和治疗DE提供理论依据。
1 材料与方法
1.1 实验动物
30只SPF级8周龄雄性SD大鼠(体质量180~220g),由上海交通大学实验动物中心提供。
1.2 主要试剂及设备
40%高脂饲料(上海斯莱克实验动物有限责任公司);STZ(美国Sigma-Aldrich公司);快速血糖仪(美国强生公司,SureStep);Morris水迷宫及视频分析系统(淮北正华生物仪器设备有限公司);Arc/Arg3.1兔多克隆抗体(美国Abcam公司);大鼠胰岛素ELISA试剂盒(批号:E02I0004)、大鼠Aβ1-42ELISA试剂盒(批号:E02A0050)和Aβ1-42兔多克隆抗体(均上海蓝基生物有限公司)。
1.3 动物分组和模型建立
SD大鼠适应性喂养1周后随机分为对照组(n=15)和糖尿病组(diabetes mellitus group,DM组,n=15)。对照组给予标准饲料,DM组给予高脂饲料喂养至第4周末。动物禁食不禁水12h,以30mg/kg和1ml/kg注射量对DM组动物行一次性腹腔注射,对照组腹腔注射同剂量柠檬酸缓冲液。STZ注射72h后用快速血糖仪检测两组动物尾静脉血糖,以随机血糖浓度≥16.7mmol/L视为造模成功,两组动物以各自饲料饲养至16周末。
1.4 检测指标及方法
每周监测动物体质量、随机血糖,于STZ注射1周后尾静脉采血测量空腹血糖(fasting blood glucose,FBG)和空腹血清胰岛素(fasing serum insulin,FSI)。按照公式计算胰岛素敏感指数(insulin sensitivity index,ISI)=LN[1/(FBG×FSI)][6],ISI呈非正态分布,分析时取其自然对数值。
1.5 Morris水迷宫测试
第16周行Morris水迷宫测试:(1)隐形平台实验:历时5d,实验前1d大鼠在水迷宫内游泳2min适应环境。平台置于目标象限中心水面下2cm,每天在其余3个象限随机选定4个方向,将大鼠面壁置入池内。若90s内大鼠爬上平台停留30s,则将入水至爬上平台前的时间记为逃避潜伏期;若90s内未找到平台,则将其引至平台学习30s,逃避潜伏期记为90s。每只大鼠每日进行4次入水训练。(2)探索实验:第6天撤去平台,大鼠从距离原平台位置最远的方向入水,自由游泳90s,由视频分析系统记录90s内大鼠在目标象限内游泳的时间、路程及占总时间、总路程的百分比和原平台穿越次数。
1.6 ELISA法和免疫组织化学法检测Aβ表达
按2ml/kg注射10%水合氯醛麻醉动物,迅速断头后于冰上分离出一侧海马,按2.5ml/g加入冰冻磷酸盐缓冲液(phosphate buffer solution,PBS),匀浆器冰上研磨,超声裂解细胞膜,4℃ 5000r/min离心15min后取上清,严格按照ELISA试剂盒说明书操作。将分离的海马组织用10%多聚甲醛进行固定,经乙醇脱水2次,二甲苯透明,石蜡包埋组织块,切片,片厚5µm。按SP试剂盒说明书测定Aβ的表达,光学显微镜下仔细观察大鼠海马CA1区Aβ的表达。
1.7 蛋白印迹法(Western blotting)检测Arc的表达
同样的方法分离出另一侧海马,以10ml/g比例加入总蛋白提取液,冰上匀浆,4℃12 000×g离心10min取上清,BCA法测定蛋白浓度。样品经SDS-聚丙烯酰胺凝胶电泳(PAGE)电泳转移到PVDF膜上。将膜完全浸泡于3%BSA-TBST中,摇床上室温封闭1h。后经一抗(Arc/Arg3.1兔多克隆抗体,1∶1000)和二抗[HRP标记山羊抗兔IgG(H+L),1∶5000]孵育后由Image-Pro Plus 6.0软件分析条带的积分光密度值,并计算相对密度。
1.8 统计学处理
所有数据采用SPSS13.0软件包进行统计学分析。计量资料用均数±标准差(±s)表示,对所有数据进行正态性和方差齐性检验,两组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 体质量、空腹血糖、空腹胰岛素和胰岛素敏感指数变化
实验结束两组各剩下13只,对照组2只打斗一死一伤退出实验,DM组2只大鼠因高渗性昏迷死亡。实验初DM组和对照组大鼠体质量相当,差异无统计学意义[(204.85±6.19)vs(205.46±9.98)g,t=0.189,P>0.05]。高脂饲养至第4周末DM组体质量高于对照组,差异有统计学意义[(393.77±12.34)vs(367.08±18.59)g,t=-4.312,P<0.01]。第4周末注射STZ后DM组逐渐出现多饮多食多尿现象,体质量逐渐下降,至第16周末处死前DM组体质量低于对照组,差异有统计学意义[(377.38±19.74)vs(481.38±19.50)g,t=13.515,P<0.01]。STZ注射1周后显示DM组FBG、FSI高于对照组,DM组ISI低于对照组,差异均有统计学意义(均P<0.01;表1)。
表1 两组大鼠STZ注射后FBG、FSI和ISI的比较Table 1 Comparison of FBG, FSI and ISI between two groups of rats after STZ injection (n=13, ±s )
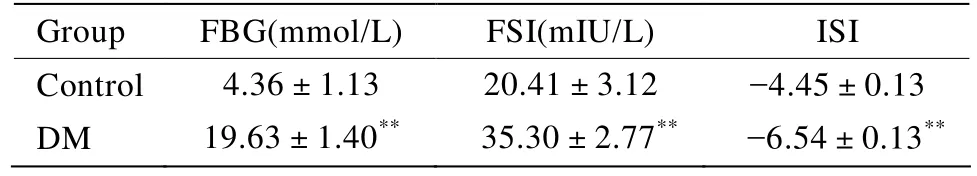
表1 两组大鼠STZ注射后FBG、FSI和ISI的比较Table 1 Comparison of FBG, FSI and ISI between two groups of rats after STZ injection (n=13, ±s )
DM:diabetes mellitus;STZ:streptozotocin;FBG:fasting blood glucose;FSI:fasing serum insulin;ISI:insulin sensitivity index.ISI=LN[1/(FBG×FSI)]. Compared with control group, **P<0.01
Group FBG(mmol/L) FSI(mIU/L) ISI Control 4.36±1.13 20.41±3.12 -4.45±0.13 DM 19.63±1.40** 035.30±2.77** 0-6.54±0.13**
2.2 行为学测试结果
Morris水迷宫测试中,隐形平台实验第3~5天DM组逃避潜伏期相比对照组长,差异均有统计学意义(P<0.01)。探索实验中DM组在目标象限的探索时间比对照组短,差异有统计学意义(P<0.01),DM组原平台穿越次数相比对照组少,差异具统计学意义(P<0.01),两组大鼠游泳平均速度差异无统计学意义(P>0.05;图1,图2)。
2.3 大鼠海马组织Arc和Aβ的表达
2.3.1 ELISA法和免疫组织化学法检测Aβ1-42的表达 Aβ1-42是构成老年斑的主要成分,测定海马组织中的Aβ可作为DE的诊断指标,确定DE模型是否成功,ELISA测定结果显示,DM组Aβ1-42表达高于对照组,差异有统计学意义[(201.41±8.31)vs(182.23±6.09)ng/L,t=-6.712,P<0.01;图3]。免疫组织化学检测发现2型糖尿病大鼠模型海马区域有明显的Aβ的沉积(图4)。

图1 两组大鼠隐形平台实验逃避潜伏期比较Figure 1 Comparison of escape latency in Stealth platform experiment between two groups
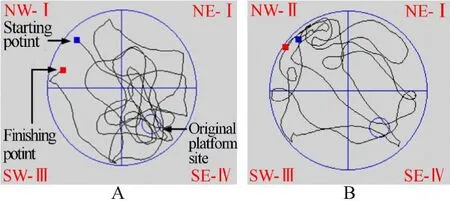
图2 两组大鼠Morris水迷宫探索实验对比Figure 2 Comparison of Morris water maze exploration between two groups
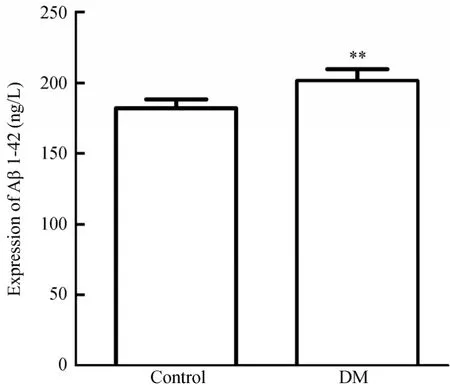
图3 两组大鼠海马组织Aβ1-42的表达的比较(ELISA检测)Figure 3 Comparison of the expression of Aβ1-42 in the hippocampus of rats in two groups (ELISA)
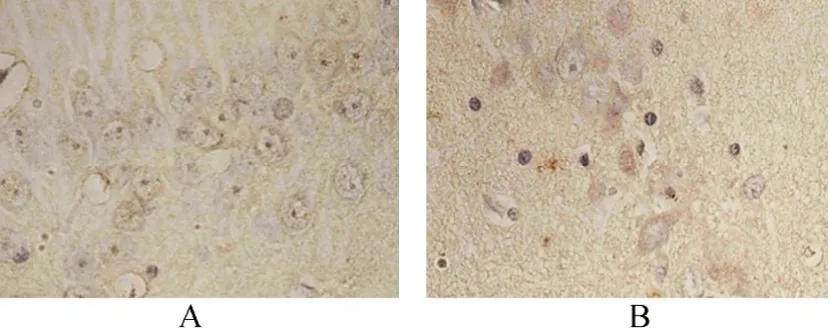
图4 对照组和糖尿病组大鼠海马组织Aβ沉积图片比较Figure 4 Aβ1-42 deposition in the hippocampus of rats from two groups (SP×400)
2.3.2 Western印迹法检测Arc的表达 DM组Arc/Arg3.1的表达低于对照组,差异有统计学意义[(0.6445±0.1046)vs(0.0460±0.0138),t=18.818,P<0.001;图5]。
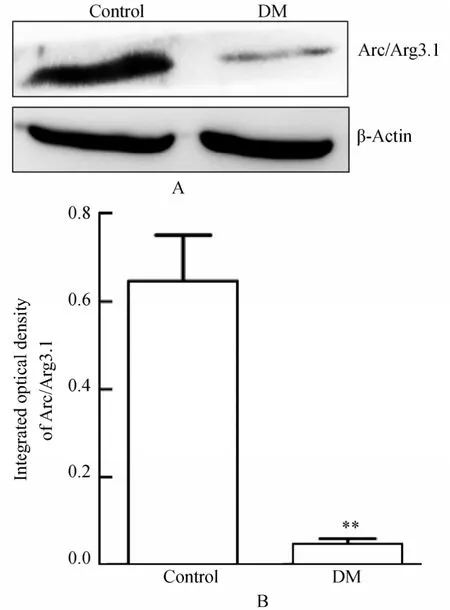
图5 两组大鼠海马组织Arc/Arg3.1的表达Figure 5 The expression of Arc/Arg3.1 in hippocampus of rats from two groups
3 讨 论
糖尿病是与遗传因素和环境因素共同作用相关、以胰岛素分泌不足和(或)胰岛素作用抵抗、慢性高血糖为特点的常见的代谢性疾病[4]。糖尿病可导致严重的并发症,如心脏病,卒中,失明,以及肾脏、神经和足部损害。随着人均寿命的延长和生活质量的提高,近年来,由糖尿病引起的中枢神经损害日益受到人们的重视。本课题组前期对328例老年患者的随访研究显示,老年2型糖尿病患者认知功能下降水平与高胰岛素血症、胰岛素抵抗以及血糖波动水平密切相关,认知评分较对照组明显下降,主要表现为延迟记忆等受损,而这些患者均无明确脑血管病的临床和影像学证据[5,6]。
本课题组前期实验中SD大鼠经过高脂饲料喂养和小剂量STZ破坏胰岛细胞后,出现了类似2型糖尿病多饮多食多尿、体质量下降、高血糖、高胰岛素血症及胰岛素敏感性下降的表现。实验末的水迷宫测试中,糖尿病组大鼠目标象限探索时间较对照组更短,原平台穿越次数更少,说明糖尿病大鼠学习和记忆能力下降,认知功能受到损害,同时EILSA检测可观察到糖尿病组大鼠海马组织的Aβ表达升高,与其他研究采用的建模方法和成模表现相似,说明该类建模方法可靠,具有良好的重复性和稳定性[7,8]。动物模型的成功建立,为后续其他指标检测提供了可靠的前提。
近年来,学者们普遍认为突触可塑性改变导致海马依赖性情景记忆的缺失是糖尿病性脑病发病、长时程记忆难以形成的重要机制。突触可塑性是神经活动引起的神经元之间信息传递效能增强或减弱的现象,其中和学习记忆相关的两种主要细胞机制是LTP和长时程抑制(long-term depression,LTD)。海马是学习记忆的重要器官,LTP的首次发现是在海马部位,心理学家和神经科学家普遍认为海马对新记忆的形成有重要作用。阿尔茨海默病(Alzheimer’s disease,AD)发病早期即可见海马的萎缩[9],值得注意的是临床上糖尿病患者出现认知功能下降的同时往往也伴随海马的萎缩超过正常的老化速度[10]。
Arc/Arg3.1作为神经活性标志物参与突触可塑性。科学家们开展了一系列实验探究Arc/Arg3.1在AD发生发展中的作用。Ginsberg等[11]发现AD患者出现神经元纤维缠结的CA1区,其Arc mRNA水平较正常组明显下降,而Lacor等[12]却在原代培养的海马神经元中发现Arc表达上升。Wegenast-Braun等[13]和Dickey等[14]利用多种转基因小鼠模型发现年幼和年老小鼠的海马中Arc的表达均下降。有趣的是,Palop等[15]在4~7月龄不等的小鼠海马中同时观测到Arc表达上升和下降的现象。可见,目前研究者对AD患者体内Arc表达的变化趋势莫衷一是。但是可以确定的是,AD患者大脑神经元中Arc表达的失调干扰了正常的神经生理活动,参与了AD的发病。在本实验中,我们通过ELISA、Western印迹法和免疫组织化学法观察到认知功能下降的糖尿病大鼠海马组织不仅Aβ表达增高,Arc的表达较对照组大鼠也明显降低,提示2型糖尿病引起的DE病理改变和认知功能下降可能与Arc蛋白表达失调有关,验证了我们的推测。
综上所述,本实验在DE大鼠模型的基础上,观察到Arc表达降低,我们推测DE引起的学习和记忆下降与Arc表达降低导致突触可塑性失衡加剧Aβ的沉积和神经元损伤有关。尽管DE具体机制仍未明,但突触可塑性可能是预防和治疗DE认知功能损害的关键。然而目前我们仍然面临许多问题需要解决,最主要的是探索一条具体的诱导途径。在DE状态下进一步研究Arc在大脑不同发育阶段和不同区域的表达以及上游各种因子的相互作用,并使用药物改善突触可塑性将作为我们下一步研究的思路和方向。
【参考文献】
[1]Kerrigan TL, Randall AD. A new player in the“synaptopathy” of Alzheimer’s disease—arc/arg3.1[J].Front Neurol, 2013, 4:9.
[2]Korb E, Finkbeiner S. Arc in synaptic plasticity:from gene to behavior[J]. Trends Neurosci, 2011, 34(11):591−598.
[3]He T, Miao Y, Zhu YT,et al. A study on correlation of cognitive function and expression with beta-amyloid,tumor necrosis factor alpha in hippocampus of diabetic rats[J]. Geriatr Health Care,2014, 20(2):93−98. [何 婷,苗 雅, 朱奕潼, 等. 糖尿病大鼠认知功能与海马组织β-淀粉样蛋白、肿瘤坏死因子α表达相关性的研究[J].老年医学与保健, 2014, 20(2):93−98.]
[4]American Diabetes Association. Diagnosis and classification of diabetes mellitus[J]. Diabetes Care, 2013,36 Suppl 1:S67−S74.
[5]Zhong Y, Zhang XY, Miao Y,et al. The relationship between glucose excursion and cognitive function in aged type 2 diabetes patients[J]. Biomed Environ Sci, 2012,25(1):1−7.
[6]Zhong Y, Miao Y, Jia WP,et al. Hyperinsulinemia, insulin
resistance and cognitive decline in older cohort[J].Biomed Environ Sci, 2012, 25(1):8−14.
[7]Liu JP, Feng L, Zhang MH,et al. Neuroprotective effect of Liuwei Dihuang decoction on cognition deficits of diabetic encephalopathy in streptozotocin-induced diabetic rat[J]. J Ethnopharmacol, 2013, 150(1):371−381.
[8]Shi X, Lu XG, Zhan LB,et al. The effects of the Chinese medicine ZiBu PiYin recipe on the hippocampus in a rat model of diabetes-associated cognitive decline:a proteomic analysis[J]. Diabetologia, 2011, 54(7):1888−1899.
[9]Epifanio I, Ventura-Campos N. Hippocampal shape analysis in Alzheimer’s disease using functional data analysis[J]. Stat Med, 2014, 33(5):867−880.
[10]Kamiyama K, Wada A, Sugihara M,et al. Potential hippocampal region atrophy in diabetes mellitus type 2:a voxel-based morphometry VSRAD study[J]. Jpn J Radiol,2010, 28(4):266−272.
[11]Ginsberg SD, Hemby SE, Lee VM,et al.Expression profile of transcripts in Alzheimer’s disease tangle-bearing CA1 neurons[J]. Ann Neurol, 2000, 48(1):77−87.
[12]Lacor PN, Buniel MC, Chang L,et al. Synaptic targeting by Alzheimer’s-related amyloid beta oligomers[J]. J Neurosci, 2004, 24(45):10191−10200.
[13]Wegenast-Braun BM, Fulgencio Maisch A, Eicke D,et al.Independent effects of intra- and extracellular Abeta on learning-related gene expression[J]. Am J Pathol, 2009,175(1):271−282.
[14]Dickey CA, Gordon MN, Mason JE,et al. Amyloid suppresses induction of genes critical for memory consolidation in APP+PS1 transgenic mice[J]. J Neurochem, 2004, 88(2):434−442.
[15]Palop JJ, Chin J, Bien-Ly N,et al. Vulnerability of dentate granule cells to disruption of arc expression in human amyloid precursor protein transgenic mice[J]. J Neurosci, 2005, 25(42):9686−9693.
