小檗碱的降糖作用独立于AMPK的信号通路
2014-04-28肖元元
肖元元,徐 淼,殷 峻,沈 丽,魏 丽
(上海交通大学附属第六人民医院内分泌代谢科,上海市糖尿病临床医学中心,上海市糖尿病重点实验室,上海市糖尿病研究所,上海市代谢病临床医学中心,上海 200233)
小檗碱又名黄连素,是中医治疗消渴疾病常用药物黄连的主要成分。早年我们在筛选有降糖作用的中药活性成分时,发现小檗碱具有良好的体外降糖效应[1,2]。随后的研究证实,小檗碱能在肝细胞、骨骼肌细胞和脂肪细胞等多种细胞类型中发挥非胰岛素依赖性的降糖作用[3]。我们将小檗碱应用于肥胖大鼠及2型糖尿病患者,发现小檗碱不仅能够降糖,还有调节脂代谢的作用[4−6]。目前一般认为,小檗碱的作用机制为激活单磷酸腺苷激活蛋白激酶(adenosine 5′-monophosphate-activated protein kinase,AMPK)[7]。AMPK被认为是“代谢总开关”,在能量平衡的调节中起到重要的作用[8]。然而,我们以往的研究发现,小檗碱在通过抑制线粒体的有氧呼吸而刺激糖酵解,以此增加葡萄糖的利用[3],这一过程中并不必须AMPK的参与。因此,本研究旨在探讨小檗碱的降糖作用与AMPK信号通路激活之间的关系,以进一步阐明小檗碱的降糖作用机制。
1 材料与方法
1.1 材料
HepG2细胞、C2C12细胞(中科院上海细胞所)。盐酸小檗碱(中国药品生物制品检定所),化合物C(Compound C,CC,默克公司)。表达显性失活突变型AMPK,即腺病毒负显性AMPK(adenovirusdominant negative-AMPK,Ad-DN-AMPK)腺病毒以及对照组,即腺病毒绿色荧光蛋白(Ad-green fluorescent protein,Ad-GFP)腺病毒(中国科学院上海药物研究所李佳教授惠赠)[9]。低糖杜尔贝科改良培养基(Dulbecco’s modified eagle medium,DMEM)培养液,高糖DMEM培养液,胎牛血清(fetal bovine serum,FBS),胰蛋白酶,青链霉素双抗(均Gibco公司),抗p-AMPK抗体,抗t-AMPK抗体,抗p-乙酰辅酶A羧化酶(acetyl coA carboxylase,ACC)抗体,抗t-ACC抗体,抗β-actin抗体(CST公司),辣根过氧化物酶标记羊抗兔二抗(Promega公司)。乳酸测定试剂盒(购自上海聚创生物科技有限公司),葡萄糖检测试剂盒(北京普利莱基因技术有限公司)。
1.2 方法
1.2.1 C2C12细胞培养与处理 小鼠骨骼肌成纤维细胞C2C12,培养于含10%胎牛血清的高糖DMEM培养液中,置于37℃,5%的CO2培养箱中进行常规培养,待细胞生长至70%~80%后,将细胞以每孔5×104个细胞接种于12孔板中,分别设置对照组和CC处理组。待细胞贴壁后,对两组细胞以含0.25%BSA的DMEM培养液培养24h,选用10µmol/L的CC预处理细胞30min后,给予不同浓度小檗碱处理24h。
1.2.2 HepG2细胞培养与病毒转染 人肝癌HepG2细胞,培养于含10%胎牛血清的低糖DMEM培养液中,置于37℃ 5%的CO2培养箱中进行常规培养,待细胞生长至70%~80%后,将细胞以每孔5×104个细胞接种于12孔板中,分别设置空白对照组(空载体腺病毒Ad-GFP转染组)和实验组(重组腺病毒Ad-DN-AMPK转染组)。待细胞贴壁24h后,对两组细胞进行转染,每孔更换500µl含病毒无血清培养基(感染复数=20),轻柔混匀并置于37℃ 5%的CO2培养箱中孵育,6h后更换成完全培养基,在转染后第24小时和48小时于荧光倒置显微镜下观察绿色荧光蛋白(GFP)的表达情况[9]。
1.2.3 葡萄糖消耗实验 HepG2细胞接种于96孔板中,铺板后,待细胞长至80%融合,给予腺病毒转染,转染后24h将培养液换为含有0.25%BSA的DMEM培养液继续孵育,12h后将培养液换为含0.25%BSA的不同浓度小檗碱的培养液,继续孵育24h。C2C12细胞接种于96孔板,待细胞贴壁后,用含0.25%BSA的DMEM培养液培养24h后,以10µmol/L的CC预处理细胞30min后,再给予不同浓度小檗碱处理24h。各组细胞用葡萄糖氧化酶法,检测细胞上清中葡萄糖含量,同时用不铺细胞的空白孔内葡萄糖含量与之相减,得出各孔的葡萄糖消耗量[2]。
1.2.4 乳酸生成实验 细胞接种于96孔板中,如上所述对细胞给予处理后,用不同浓度的小檗碱孵育细胞24h,按照乳酸检测试剂盒说明,测定各组细胞上清中乳酸生成水平。
1.2.5 Western印迹法检测 接种于12孔板中的细胞经各组处理后,以预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)洗2次,加入含有苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)和磷酸酶抑制剂的细胞裂解液,冰上裂解30min,用干净的细胞刮刀将细胞刮下并转移至离心管中。4℃12 000r/min离心15min,吸取上清,于100℃下变性10min后经8%聚丙烯酰胺凝胶电泳。低温下转膜2h,5%脱脂奶粉室温封闭1h,TBST洗膜5min,3次。4℃孵育一抗过夜,TBST洗膜5min,3次;二抗于室温孵育1h,TBST洗膜,常规显影,拍照。
1.3 统计学处理
将所得实验数据经SPSS19.0统计学处理软件分析,结果以均数±标准差(±s)表示,每组实验重复次数以n表示,多组间均数比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 小檗碱对细胞的降糖作用
为了筛选小檗碱对细胞具有最佳降糖效果时的浓度,本研究检测了用3种不同浓度药物处理24h后,细胞内的葡萄糖消耗量和乳酸生成水平。结果显示,小檗碱5,10和20µmol/L处理HepG2细胞,使细胞葡萄糖的消耗量较对照组分别升高12.34%、31.5%和34.9%(P<0.001;图1A),在C2C12细胞内,小檗碱使得细胞的葡萄糖消耗量较对照组分别升高了46.7%、63.3%和1.05倍(P<0.01;图1B)。而5,10和20µmol/L的小檗碱使HepG2细胞内的乳酸生成较对照组分别升高了59.95%、69.79%和75.90%(P<0.001;图1C),使C2C12细胞内的乳酸生成较对照组分别升高了40.67%、49.40%和40.93%(P<0.001;图1D),由此可见小檗碱可以明显促进HepG2细胞以及C2C12细胞的葡萄糖消耗,且这种作用主要是通过增加细胞的无氧呼吸促进乳酸合成而发挥的。
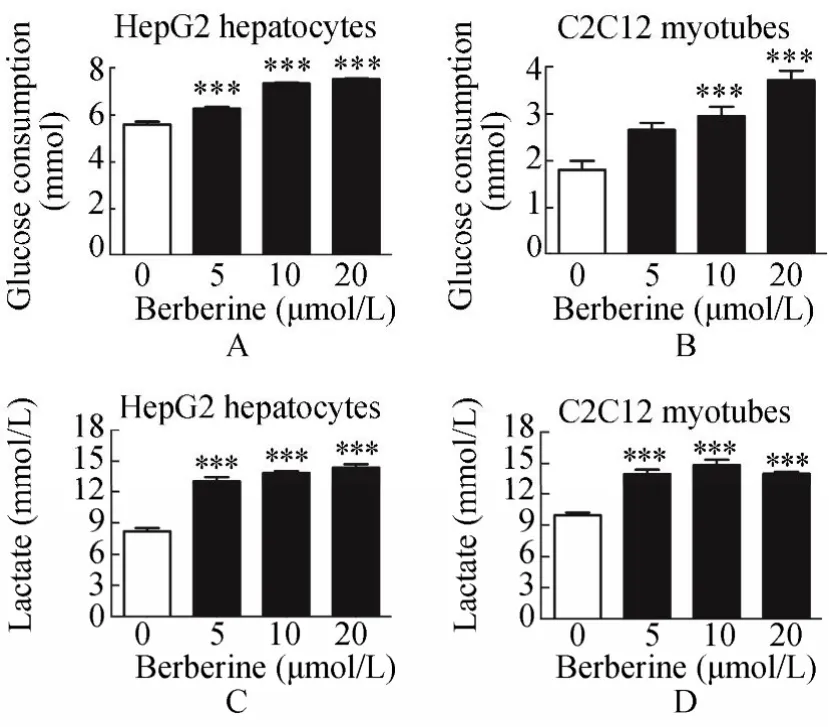
图1 小檗碱对细胞葡萄糖消耗与乳酸生成的剂量相关关系Figure 1 Dose-dependent effects of berberine on glucose consumption and lactate production in HepG2 and C2C12 cells
2.2 AMPK活性抑制时小檗碱对C2C12细胞的降糖作用
AMPK化学抑制剂CC可阻断AMPK通路,抑制AMPK下游信号的传导。因此我们利用CC抑制AMPK活性,在此基础上观察小檗碱是否仍存在明显的降糖作用。选用10µmol/L的CC预处理细胞30min后,再加入5,10µmol/L的小檗碱处理24h来阻断AMPK通路。在此基础上对细胞进行葡萄糖消耗和乳酸生成实验,结果显示,在C2C12细胞中,小檗碱处理组的葡萄糖消耗较对照组分别升高了52%和66%(P<0.01),乳酸生成较对照组分别升高了36%和45%倍(P<0.01)。但同时给予CC组的细胞在进行小檗碱处理后,葡萄糖消耗和乳酸生成水平也较单独给予CC组分别升高了52%、68.6%和46%、56%(P<0.01;图2A、B)。由此可见,当AMPK活性受到抑制时,小檗碱仍存在促进C2C12细胞葡萄糖代谢以及无氧呼吸的作用。

图2 AMPK活性抑制下小檗碱对C2C12细胞葡萄糖摄取和乳酸生成的影响Figure 2 Effect of berberine on glucose consumption and lactate production under the condition of AMPK inhibited
2.3 无活性AMPK过表达条件下小檗碱对HepG2细胞的降糖作用
为了进一步明确AMPK的激活对小檗碱降糖作用的影响,我们同时利用过表达显性失活后突变型AMPK,即负显性AMPK(dominant negative AMPK,DN-AMPK)的腺病毒转染HepG2细胞,使得细胞内过表达无活性AMPKα亚基与内源性正常AMPKα亚基竞争结合β和γ亚单位,使细胞内的AMPK总体表现为无活性状态,从而起到干扰AMPK的作用。重组Ad-DN-AMPKα感染HepG2细胞24h后,通过与转染Ad-GFP对照组比较可见,AMPK表达显著升高,而且在小檗碱处理24h后,阴性对照组中的AMPK的Thr172位磷酸化增加,并且其下游蛋白ACC的S79位磷酸化也显著增加,但是当转染Ad-DN-AMPK后,DN-AMPK高表达,小檗碱处理后AMPK对ACC的磷酸化受到抑制,这表明DN-AMPK影响了内源性AMPK自身的激酶活性(图3A)。在此基础上,对细胞进行葡萄糖消耗和乳酸生成实验,结果显示,与对照组相比,5和10µmol/L的小檗碱处理使HepG2细胞中葡萄糖的消耗和乳酸生成分别升高了13.5%、34.6%(P<0.01)和61.7%%(P<0.05)、70.9%(P<0.01),而在转染了Ad-DN-AMPK的情况下,小檗碱仍旧使得HepG2细胞的葡萄糖消耗和乳酸生成分别升高了13.2%、29.4%%(P<0.01)和63%(P<0.05)、70%(P<0.01)(图3B、C),由此说明细胞内过表达无活性AMPKα,小檗碱仍存在促进HepG2细胞葡萄糖消耗以及无氧呼吸的作用。

图3 AMPKɑ活性干扰时小檗碱对HepG2细胞葡萄糖消耗和乳酸生成的影响Figure 3 Effect of berberine on glucose consumption and lactate production in dominant negative AMPK transfected HepG2 cells
3 讨 论
小檗碱是中药黄连的主要成分,具有广泛的药理作用,临床上可以用于多种疾病的治疗,近年来的研究发现小檗碱对糖尿病的治疗也具有良好的效果。我们既往的研究证实,无论在体外培养的细胞系还是在动物或人体内,小檗碱都具有显著的降糖作用,且药物的作用模式和效果与二甲双胍相似,它们均可以增加肝脏、脂肪和肌肉等组织对葡萄糖的消耗及摄取,同时改善上述组织的胰岛素敏感性[3,4]。
以往的研究认为,小檗碱的降糖作用与二甲双胍一样,都是通过激活AMPK而发挥的。AMPK是一种保守的丝/苏氨酸激酶,被视为平衡全身及细胞能量状态的调试器,它由一个催化基团α亚基和两个调节基团β、γ亚基组成。AMPK激活药物可刺激AMPKα亚基活化环Thr172位点的磷酸化,使得AMPK活性增强,进而影响其下游代谢相关基因及蛋白的表达,最终抑制糖、脂、蛋白质合成及细胞生长,促进葡萄糖的摄取和脂肪酸的氧化[10]。但近些年的研究发现,利用基因消融的方法在小鼠肝以及原代肝细胞中抑制AMPKα及其上游激酶LKB1后,二甲双胍仍旧能够引起肝葡萄糖输出的减少,提示AMPKα和LKB1并非二甲双胍降糖作用的主要靶点[11]。该结果使得传统观念中AMPK在二甲双胍作用中的关键地位被撼动。
与二甲双胍的传统机制相似,多项研究发现小檗碱也可以增强AMPK的活性,并通过磷脂酰肌醇−3激酶(phosphatidylinositol 3 kinase,PI3K)非依赖的途径促进L6骨骼肌细胞内葡萄糖转运蛋白4(glucose transporter type 4,GLUT4)的转运和葡萄糖摄取[12,13]。同样在我们过去的研究中也发现,小檗碱确实可以促进细胞内AMPK的磷酸化,该作用可能与其抑制线粒体功能进而增加细胞内AMP/ATP比值相关[3]。但小檗碱的降糖作用是否依赖于AMPK,既往尚无相关研究。
本研究结果显示,给予HepG2细胞和C2C12细胞小檗碱处理24h,细胞内葡萄糖的消耗和乳酸生成水平显著升高,并且AMPK及其下游信号分子ACC的磷酸化水平也较对照组有所增加,这与以往的研究结果相一致,证实小檗碱确实可以激活细胞内的AMPK信号通路,但此结果是否说明小檗碱对细胞糖代谢的调节作用就是通过AMPK信号通路所发挥呢?为明确其中详细的作用机制,我们首先应用AMPK化学抑制剂CC作用细胞,并在此基础上对细胞给予小檗碱处理,结果表明,小檗碱在AMPK被抑制的条件下,依然能够显著促进细胞的葡萄糖消耗和乳酸生成水平。
此外,我们还利用Ad-DN-AMPK的腺病毒转染HepG2细胞。这种AMPK主要是通过将AMPKα1的159位天冬氨酸突变为丙氨酸,使其丧失ATP的结合能力[14],同时将AMPKα2的45位赖氨酸突变为精氨酸,从而使AMPKα2亚基激酶活性丧失[15],两者的突变使得细胞内的AMPKα处于失活状态。过表达无活性的AMPKα亚基与内源性正常的α亚基竞争β和γ亚单位,从而使细胞内的AMPK表现为无活性状态,起到干扰AMPK的作用。在此基础上我们发现,干扰了AMPK的活性后,小檗碱仍存在促进HepG2细胞葡萄糖消耗与乳酸生成的作用,并且发现Ad-DN-AMPK组细胞的这一作用与Ad-GFP对照组无明显差异。这一结果进一步提示,小檗碱促进葡萄糖消耗与无氧糖酵解的作用可能是AMPK非依赖性的。
综上所述,本研究揭示,小檗碱的降糖作用并不依赖于AMPK的激活。结合我们以往的工作,小檗碱作用的核心机制可能为抑制线粒体的有氧呼吸,导致糖酵解的上调[3],AMPK是线粒体功能抑制的结果,并非小檗碱的降糖作用所必需。
【参考文献】
[1]Yin J, Hu RM, Chen MD,et al.In vitroresearch on the effects of berberine, oleanolic acid and allitridon on glucose metabolism[J]. J Beijing Univ Traditional Chin Med, 2003, 26(2):36−38 [殷 峻, 胡仁明, 陈名道, 等.小檗碱、齐墩果酸和大蒜新素对糖代谢作用的体外研究[J]. 北京中医药大学学报, 2003, 26(2):36−38.]
[2]Yin J, Hu R, Chen M,et al. Effects of berberine on glucose metabolismin vitro[J]. Metabolism, 2002, 51(11):1439−1443.
[3]Yin J, Gao Z, Liu D,et al. Berberine improves glucose metabolism through induction of glycolysis[J]. Am J Physio1 Endocrino1 Metab, 2008, 294(1):E148−E156.
[4]Yin J, Xing H, Ye J. Efficacy of berberine in patients with type 2 diabetes mellitus[J]. Metabolism, 2008, 57(5):712−717.
[5]Yin J, Chen MD, Tang JF,et al. Effects of berberine on glucose and lipid metabolism in rat experiment[J]. Chin J Diabetes, 2004, 12(3):215−218. [殷 峻, 陈名道, 唐金凤,等. 小檗碱对实验大鼠糖脂代谢的影响[J]. 中华糖尿病杂志, 2004, 12(3):215−218.]
[6]Yin J, Chen MD, Yang Y,et al. Effects of berberine on lipid metabolism in rats[J]. J Shanghai Second Med Univ,2003, 23(z1):28−30. [殷 峻, 陈名道, 杨 颖, 等. 小檗碱对大鼠脂代谢的影响[J]. 上海第二医科大学学报,2003, 23(z1):28−30.]
[7]Brusq JM, Ancellin N, Grondin P,et al. Inhibition of lipid synthesis through activation of AMP kinase:an additional mechanism for the hypolipidemic effects of berberine[J].J Lipid Res, 2006, 47(6):1281−1288.
[8]Zhou G, Myers R, Li Y,et al. Role of AMP-activated protein kinase in mechanism of metformin action[J]. J C1in Invest, 2001, 108(8):1167−1174.
[9]Zhang LN, Xu L, Zhou HY,et al. Novel small-molecule AMP-activated protein kinase allosteric activator with beneficial effects in db/db mice[J]. PLoS One, 2013, 8(8):e72092.
[10]Viollet B, Guigas B, Leclerc J,et al. AMP-activated protein kinase in the regulation of hepatic energy metabolism: from physiology to therapeutic perspectives[J]. Acta Physiol (Oxf), 2009, 196(1):81−98.
[11]Foretz M, Hébrard S, Leclerc J,et al. Metformin inhibits hepatic gluconeogenesis in mice independently of the LKB1/AMPK pathwayviaa decrease in hepatic energy state[J]. J C1in Invest, 2010, 120(7):2355−2269.
[12]Lee YS, Kim WS, Kim KH,et al. Berberine, a natural plant product, activates AMP-activated protein kinase with beneficial metabolic effects in diabetic and insulin-resistant states[J]. Diabetes, 2006, 55(8):2256−2264.
[13]Cheng Z, Pang T, Gu M,et al. Berberine-stimulated glucose uptake in L6 myotubes involves both AMPK and p38 MAPK[J]. Biochim Biophys Acta, 2006, 1760(11):1682−1689.
[14]Olianas MC, Dedoni S, Olianas A,et al. δ-Opioid receptors stimulate the metabolic sensor AMP-activated protein kinase through coincident signaling with G(q/11)-coupled receptors[J]. Mol Pharmacol, 2012,81(2):154−165.
[15]Lu M, Tang Q, Olefsky JM,et al. Adiponectin activates adenosine monophosphate-activated protein kinase and decreases luteinizing hormone secretion in LbetaT2 gonadotropes[J]. Mol Endocrinol, 2008, 22(3):760−771.
