三种抑菌剂对蛋白核小球藻生物量和脂质含量的影响
2014-04-25王存文汪铁林吕仁亮王成成张艳芳
王存文,孟 阳,汪铁林,吕仁亮*,王成成,张艳芳
[1.武汉工程大学化工与制药学院,湖北 武汉 430074;2.绿色化工过程教育部重点实验室(武汉工程大学),湖北 武汉 430074]
0 引 言
生物柴油作为一种可再生的环保能源,在过去几十年里引起了全世界的广泛关注[1].植物油、动物脂肪和微生物油脂是生产生物柴油的主要原料[2-3].其中,微生物油脂的脂质产量高,而且与传统农业相比,微生物细胞增殖快、生产周期短、生产成本低、生长所需的原料来源广泛[4].在众多的微生物中,微藻的油脂成分较为单一、组成与普通植物油相似,且产率较高(在特定培养条件下可达到自身干重质量分数的85%)[5].微藻适应环境的能力很强,在整个生物圈均有分布,不会与农作物争抢良田[6].微藻具有较高的光合效率,可以提供更有效的方法来回收营养物质[7],其代谢产物量比传统微生物要高得多[8].用葡萄糖异养发酵培养微藻可达到51.2 g/L的生物量[9],而富油微藻能够产生大量的单细胞油脂(SCOs),产量可超过其干重质量分数的20%[10],这些单细胞油脂的主要成分是非常适合于生产生物柴油的甘油三酯(TAGs)[11].其中,蛋白核小球藻因繁殖能力强、用途广泛而受到广泛的关注,本研究选取蛋白核小球藻作为研究对象.
微藻在培养过程中通常会受到其他微生物的污染.这些微生物会对其生长速度及藻密度产生影响,其中细菌的影响较为显著.可与微藻共同生存的细菌被称为共生菌,存在竞争关系的则被称为非共生菌[12].非共生菌对微藻的生长是有害的,甚至有些具有溶藻性的细菌对微藻来说是致命的[13].抑菌剂对于细菌具有良好的抑制作用,采用抑菌剂可消除非共生菌对微藻生长的影响[14].关于抑菌剂在微藻培养中的应用的报道主要集中在藻类遗传转化中的选择性标记[15].微藻在培养过程中通常会受到放线菌和霉菌的污染.孟加拉红、制霉菌素和硫酸链霉素能够有效抑制放线菌和霉菌的繁殖线菌[16-17].据笔者所知,至今未见孟加拉红对小球藻生长影响的报道.
本实验选用孟加拉红、制霉菌素和硫酸链霉素作为抑菌剂,研究其对蛋白核小球藻生长的影响,旨在寻找可抑制或消灭微藻非共生菌而对微藻本身影响较小或有促进作用的抑菌剂.
1 实验部分
1.1 材料
孟加拉红(生物纯级)购自阿拉丁试剂,硫酸链霉素[Amresco 0382,Potency(dry basis):650~850 mcg/mg]和制霉菌素[Amresc 0418,Potency(anhydrous):4 400 u/mg]购自武汉华顺生物技术有限公司.BG-11培养基根据文献[18]配置,所用试剂全部为分析纯级.蛋白核小球藻购自中国科学院武汉水生生物研究所.
1.2 微藻培养
培养温度为25℃,将微藻置于100 m L锥形瓶中培养,培养基为BG-11培养基,并用强度为4 000 lx的冷白光灯对微藻进行光照,光暗周期L∶D=12 h∶12 h.同时每天摇动培养瓶数次,以防止微藻下沉或附壁.在实验组中加入抑菌剂,依文献选取3种抑菌剂的质量浓度分别为:孟加拉红23 mg/L、硫酸链霉素30 mg/L和制霉菌素25 mg/L[19-21].每个实验都包括实验组和不加抑菌剂的对照组,两组的其它培养条件相同.
1.3 微藻细胞密度分析
微藻细胞密度采用紫外分光光度计(天津拓普WFZ-26A)和托马血细胞计数器(上海求精生化试剂仪器有限公司,沪制02270113号)测定.利用紫外分光光度计测定蛋白核小球藻在680 nm处的吸光度,并用托马血细胞计数器测得细胞数,可得到细胞数和吸光度的关系曲线[22].经测试,孟加拉红、制霉菌素和硫酸链霉素在680 nm下均无吸收.本实验测得蛋白核小球藻的藻密度与吸光度之间的关系如图1所示.实验过程中测定样品在680 nm处的吸光度即可根据标准曲线得到微藻的细胞密度.

图1 微藻细胞密度标准曲线Fig.1 The standard curve of algal cell density
2 结果与讨论
2.1 单一抑菌剂的影响
2.1.1 孟加拉红的影响 孟加拉红对蛋白核小球藻生长情况的影响如图2所示.在初始24 h内,实验组的微藻密度略有下降,由1.229×107cells/mL减少至1.172×107cells/m L.微藻对孟加拉红有一个适应的过程,从而导致在培养初期藻密度会有所降低.随着培养时间的增加,微藻逐渐适应孟加拉红,藻密度逐渐增加.培养96 h后,藻密度增加至1.790×107cells/m L.随后藻密度急剧增加,培养时间为120 h时增加至2.264×107cells/mL,到168 h,达到4.216×107cells/m L,而不经处理的对照组小球藻细胞密度仅为3.325×107cells/mL.这是因为低浓度的活性氧可激活蛋白酶,调节基因表达的合成和诱导,导致细胞增殖[23-24],可出现毒物兴奋效应[25],即低含量的毒性介质所产生的刺激作用促使微藻生长率显著增加.随着毒性介质浓度的降低,微藻细胞的生长得到恢复和促进.结果表明,较低浓度的孟加拉红能够明显促进蛋白核小球藻的生长,提高藻密度.

图2 加入孟加拉红后小球藻的生长曲线Fig.2 Growth curve of Chlorella pyrenoidosa after exposure to Rose Bengal
2.1.2 制霉菌素的影响 如图3所示,在加入了制霉菌素的实验组中,藻密度随着培养时间的增长而降低,从1.192×107cells/mL下降至5.23×106cells/m L.微藻的颜色也从绿色转变为棕黄色.一定浓度的制霉菌素对蛋白核小球藻具有毒害作用,会导致大量藻细胞死亡,从而导致藻密度降低、藻细胞颜色改变,抑制蛋白核小球藻的生长[26].虽没有直接的证据证明制霉菌素影响小球藻的代谢过程,但可能因为制霉菌素吸收K+,导致辅因子从细胞中渗漏,最终导致代谢停止[27].制霉菌素对蛋白核小球藻的生长具有非常明显的抑制作用.

图3 加入制霉菌素后小球藻的生长曲线Fig.3 Growth curve of Chlorella pyrenoidosa after exposure to Nystatin
2.1.3 硫酸链霉素的影响 如图4所示,实验组和对照组中蛋白核小球藻的生长趋势基本相同,但实验组的藻密度始终高于对照组,藻密度的最大值分别为3.512×107cells/m L和3.325×107cells/m L.培养120 h后,两组微藻都进入稳定期,对照组的藻密度保持稳定,而实验组的藻密度则略有下降.144 h后两组的藻密度趋于相等.在培养初期,实验组中的蛋白核小球藻的生长速率比对照组要高得多.这主要是因为硫酸链霉素对微藻生长产生促进作用,在微藻进入稳定生长期后,硫酸链霉素的浓度降低,促进生长的作用减弱.

图4 加入硫酸链霉素后小球藻的生长曲线Fig.4 Growth curve of Chlorella pyrenoidosa after exposure to Streptomycin Sulphate
2.2 混合抑菌剂的影响
单一抑菌剂孟加拉红和硫酸链霉素均对微藻生长具有一定的促进作用,但在蛋白核小球藻的不同培养阶段产生的效果不同.本实验将这两种抑菌剂配合使用,研究了混合抑菌剂对蛋白核小球藻生长的影响.抑菌剂采用以下3种方式加入:A.实验初期同时加入两种抑菌剂;B.实验初期加入孟加拉红,96 h后加入硫酸链霉素;C.实验初期加入硫酸链霉素,96 h后加入孟加拉红.
如图5所示,按3种方式加入抑菌剂后,小球藻的生长均受到程度不一的抑制,严重的甚至导致死亡.可见混合抑菌剂比单一抑菌剂对蛋白核小球藻的毒性作用更大,且由于抑菌剂拥有各自的抗菌谱图,当将抑菌剂进行混合后,它们对微藻的影响也更为复杂[19,21,28].藻的细胞膜可能会被破坏,最终导致代谢停止.
2.3 抑菌剂对脂质含量的影响
本实验利用超临界CO2萃取法和索氏提取法对实验组(在培养基中加入单一的孟加拉红或硫酸链霉素)和对照组的微藻进行脂质含量测定.超临界CO2萃取法的实验条件为:萃取温度45℃,压力30 MPa,萃取时间120 min[29];索氏提取法采用无水乙醚作为提取剂,每小时虹吸6次,持续12 h,提取剂提取藻粉时已经无色可视为提取完全[30].
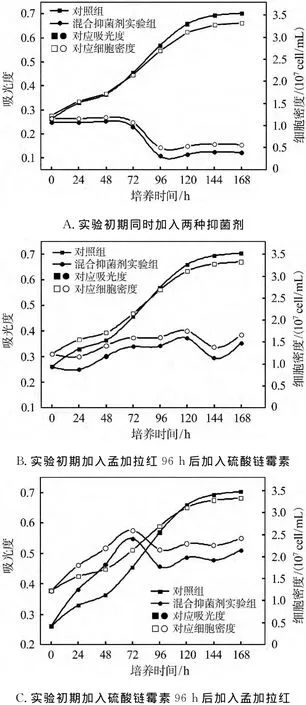
图5 不同的抑菌剂混合方式对微藻生长的影响Fig.5 The effect of mixed antibiotics on microalgae
表1列出了经超临界CO2萃取法和索氏提取法得出的微藻油脂含量,油脂含量用藻细胞干重的百分数表示.由表1可知,无论是否经孟加拉红或硫酸链霉素处理,微藻的脂质含量几乎没有受到影响.与对照组相比,在加入孟加拉红和硫酸链霉素后,虽然小球藻的脂质含量都略有下降但变化不大,对这两种油脂提取方法而言,孟加拉红实验组相对于对照组的油脂含量均下降了0.5%,下降幅度分别为2.12%和2.18%;硫酸链霉素实验组相对于对照组的油脂含量分别下降了0.1%和0.8%,下降幅度分别为0.42%和3.49%.

表1 微藻细胞内油脂含量Table 1 The lipid content of microalgae
3 结 语
本实验研究了孟加拉红,制霉菌素和硫酸链霉素对蛋白核小球藻生长情况的影响,并利用超临界CO2萃取法和索氏提取法从微藻中提取了油脂.结果表明,单独加入孟加拉红或硫酸链霉素对蛋白核小球藻的脂质含量几乎没有影响,其藻密度的最大值分别可达到4.216×107cells/m L、3.512×107cells/m L,高于对照组的 3.325×107cells/m L.制霉菌素会抑制蛋白核小球藻的生长,孟加拉红和硫酸链霉素可以促进微藻的生长,但孟加拉红和硫酸链霉素的混合物对微藻生长有抑制作用.
致谢
感谢绿色化工过程教育部重点实验室及武汉工程大学化工与制药学院提供的实验平台!
[1]VASUDEVAN P T,BRIGGS M.Biodiesel productioncurrent state of the art and challenges[J].Journal of Industrial Microbiology & Biotechnology,2008,35(5):421-430.
[2]HIMMEL M E,DING S Y,JOHNSON D K,et al.Biomass recalcitrance:engineering plants and enzymes for biofuels production[J].Science,2007,315(5813):804-807.
[3]MATA T M,MARTINS A A,CAETANO N S.Microalgae for biodiesel production and other applications:a review[J].Renewable and Sustainable Energy Reviews,2010,14(1):217-232.
[4]PRÍOS S D,TORRES C M,TORRAS C,et al.Microalgae-based biodiesel:economic analysis of downstream process realistic scenarios[J].Bioresource Technology,2013,136:617-625.
[5]MENG X,YANG J,XU X,et al.Biodiesel production from oleaginous microorganisms[J].Renewable Energy,2009,34(1):1-5.
[6]AMARO H M,GUEDES A C,MALCATA F X.Antimicrobial activities of microalgae:an invited review[J].Science Against Microbial Pathogens:Communicating Current Research and Technological Advances,2011(3):1272-1284.
[7]DEBOER K,MOHEIMANI N R,BOROWITZKA M A,et al.Extraction and conversion pathways for microalgae to biodiesel:a review focused on energy consumption[J].Journal of Applied Phycology,2012,24(6):1681-1699.
[8]OLAIZOLA M.Commercial development of microalgal biotechnology:from the test tube to the marketplace[J].Biomolecular Engineering,2003,20(4):459-466.
[9]XIONG W,LI X,XIANG J,et al.High-density fermentation of microalga Chlorella protothecoides in bioreactor for microbio-diesel production[J].Applied Microbiology and Biotechnology,2008,78(1):29-36.
[10]PRUVOST J,VAN VOOREN G,LE GOUIC B,et al.Systematic investigation of biomass and lipid productivity by microalgae in photobioreactors for biodiesel application[J].Bioresource Technology,2011,102(1):150-158.
[11]KOSA M,RAGAUSKAS A J.Lipids from heterotrophic microbes:advances in metabolism research[J].Trends in Biotechnology,2011,29(2):53-61.
[12]CROFT M T,LAWRENCE A D,RAUX-DEERY E,et al.Algae acquire vitamin B12 through a symbiotic relationship with bacteria[J].Nature,2005,438(7064):90-93.
[13]傅丽君,安新丽,郑天凌.环境中放线菌及其抑藻活性物质研究的若干进展[J].地球科学进展,2010(9):960-965.FU Li-jun,AN Xin-li,ZHENG Tian-ling.Advances in algicidal substances produced by algae-lysing actinomycetes [J].Advances in Earth Science,2010(9):960-965.(in Chinese)
[14]COTTRELL M T,SUTTLE C A.Production of axenic cultures of micromonas pusilla(prasinophyceae)using antibiotic 1[J].Journal of Phycology,1993,29(3):385-387.
[15]WALKER T L,COLLET C,PURTON S.Algal transgenics in the genomic era[J].Journal of Phycology,2005,41(6):1077-1093.
[16]司美茹,薛泉宏,来航线.放线菌分离培养基筛选及杂菌抑制方法研究[J].微生物学通报,2004,31(2):61-65.SI Mei-ru,XUE Quan-hong,LAI Hang-xian.Studies on selection of the isolation medium for actinomycetes and inhabiti on methods to miscellaneousmicroorganism[J].Microbiology,2004,31(2):61-65.(in Chinese)
[17]沈萍,范秀容,李广武.微生物学实验 [M].3版.北京:高等教育出版社,1999.SHEN Ping,FAN Xiu-rong,LI Guang-wu.Experiment of microbiology[M].3rd ed.Beijing:Higher Education Press,1999.(in Chinese)
[18]STANIER R,KUNISAWA R,MANDEL M,et al.Purification and properties of unicellular blue-green algae(order Chroococcales)[J].Bacteriological Reviews,1971,35(2):171-205.
[19]黄健,宫相忠,唐学玺,等.链霉素对海洋微藻的毒物刺激效应[J].青岛海洋大学学报:自然科学版,2000,30(4):642-644.HUANG Jian,GONG Xiang-zhong,TANG Xue-xi,et al.Hormesis of streptomycin on 6 species of marine microalgae[J].Journal of Ocean University of Qingdao,2000,30(4):642-644.(in Chinese)
[20]赵培,王雪青,朱潮峰,等.3种常用抗生素应用于海洋微藻无菌化培养的研究[J].天津师范大学学报:自然科学版,2007,27(2):27-30.ZHAO Pei,WANG Xue-qing,ZHU Chao-feng,et al.Study of three commonly antibiotics in the axenic culture of marine-microalgae[J].Journal of Tianjin Normal University:Natural Science Edition,2007,27(2):27-30.(in Chinese)
[21]刘卫东,苏浩,虞星炬.培养基琼脂浓度及抗生素对3种海洋微藻生长的影响[J].生物技术,2007,16(6):75-77.LIU Wei-dong,SU Hao,YU Xing-ju.Effects of agar concentration and antibiotics on the growth of three marine microalgae[J].Biology Technology,2007,16(6):75-77.(in Chinese)
[22]沈萍萍,王朝晖,齐雨藻,等.光密度法测定微藻生物量[J].暨南大学学报:自然科学与医学版,2001,22(3):115-119.SHEN Ping-ping,WANG Zhao-hui,QI Yu-zao,et al.An opticaldensity method for determination of micro algal biomass[J].Journal of Jinan University:Natural Science,2001,22(3):115-119.(in Chinese)
[23]DYPBUKT J M,ANKARCRONA M,BURKITT M,et al.Different prooxidant levels stimulate growth,trigger apoptosis,or produce necrosis of insulin-secreting RINm5F cells.The role of intracellular polyamines[J].The Journal of Biological Chemistry,1994,269(48):30553-30560.
[24]SCHRECK R,RIEBER P,BAEUERLE P A.Reactive oxygen intermediates as apparently widely used messengers in the activation of the NF-kappa B transcription factor and HIV-1[J].The EMBO Journal,1991,10(8):2247.
[25]STEBBING A R D.Hormesis-the stimulation of growth by low levels of inhibitors[J].The Science of the Total Environment,1982,22:213-234.
[26]ROBINSON A.The effect of anti-fungal antibiotics on the nodulation of Trifolium subterraneum and the estimation of Rhizobium trifolii populations[J].Animal Production Science,1968,8(32):327-331.
[27]DONG Z Z,DONG Z F,DING D W.A method of quick determination of algal biomass[J].Marine Sciences,2004,28(11):1-2.
[28]黄健,唐学玺,宫相忠,等.低浓度毒物对海洋微藻生长刺激效应的初步研究[J].应用生态学报,2002,13(11):1516-1518.HUANG Jian,TANG Xue-xi,GONG Xiang-zhong,et al.Preliminary study on the growth stimulation of marine microalgae stimulated by low level of toxicant[J].Chinese Journal of Applied Ecology,2002,13(11):1516-1518.(in Chinese)
[29]MENDES R L,COELHO J P,FERNANDES H L,et al.Applications of supercritical CO2extraction to microalgae and plants[J].Journal of Chemical Technology and Biotechnology,1995,62(1):53-59.
[30]RAO A R,DAYANANDA C,SARADA R,et al.Effect of salinity on growth of green alga Botryococcus braunii and its constituents[J].Bioresource Technology,2007,98(3):560-564.
