跳跃性应力刺激对大鼠血清PTH及骨代谢相关分子OPG、RANKL的影响
2014-04-25李盛村王国祥
李盛村,王国祥
(苏州大学体育学院,江苏 苏州 325000)
跳跃性应力刺激对大鼠血清PTH及骨代谢相关分子OPG、RANKL的影响
李盛村,王国祥
(苏州大学体育学院,江苏 苏州 325000)
目的:研究长期跳跃应力刺激对甲状腺激素(PTH)和骨代谢相关分子基因表达的影响,探讨跳跃运动所致的骨质破坏发生分子机制。方法:48只8周龄雄性SD大鼠,随机分为对照组、跳跃组和负重跳跃组,运动2周后每组取材8只,记为C2、J2和JL2,运动6周后各组,记为C6、J6和JL6。跳跃组进行递增负荷跳跃运动,负重跳跃组负重5%自身体重,运动方案同跳跃组。采用酶联免疫吸附试验(ELISA)检测血清甲状旁腺激素(PTH),采用比色法检测血清碱性磷酸酶(ALP)和抗酒石酸酸性磷酸(StrACP)含量。取一侧胫骨制作HE石蜡切片,另一侧应用RT-PCR法检测OPG、RANKL的mRNA表达。结果:(1)与C6和J6组相比,JL6组骨胶原纤维和骨膜排列紊乱,骨皮质出现较大程度破坏,空腔增多。(2)JL6组血清ALP高于J6和C6组(p<0.01,p<0.05)。JL6组和J6组StrACP显著高于C6组(p<0.01)。(3)J2和JL2 PTH水平组显著低于C2组(p<0.05,p<0.01),JL6组低于J6和C6组(p<0.05,p<0.01)。(4)与C6组比较,J6组和JL6组OPGmRNA表达显著升高,其中J6组表达量最高。JL6组RANKL表达显著高于J6和C6组(p<0.01),J6组RANKL的表达高于C6组(p<0.05)。结论:负重跳跃运动6周后大鼠胫骨骨质破坏较为严重,骨代谢以骨转换率升高为特征,RANKL的持续升高可能是骨质破坏的重要原因,而血清PTH水平持续下降不利于骨质修复。
跳跃性应力;甲状旁腺激素;OPG/RANKL
适宜应力刺激是维持骨骼健康生长的必要前提,运动过程中的过度应力刺激则可以导致骨质破坏而发生骨损伤,如疲劳性骨折、创伤性骨关节炎以及骨质疏松等。运动实践发现,跳跃性应力刺激是引起骨损伤最常见的方式,例如在篮球、排球和跨栏等运动员中应力性骨折发生率最高。诸多研究证实[1],应力刺激可以通过力学转导信号通路,直接对成骨细胞和破骨细胞功能产生影响,而护骨素(Osteoprotegerin,OPG)和核因子-κB受体激活因子配体(Receptor activator of nuclear factorκB ligand,RANKL)则被认为是力学信号转导过程中重要的应力敏感信号分子。甲状旁腺激素(Parathyroid hormone,PTH)是重要的骨代谢相关激素,已成为临床上治疗骨质疏松的主要药物之一[2]。生理状况下,OPG和RANKL的动态平衡是维持骨量的重要因素;在过度应力下PTH可能调节OPG/ RANKL比例,从而影响骨代谢。目前国内外有关过度应力刺激与骨损伤发生的相关研究较少,应力刺激影响骨重建和骨破坏的途径和分子机制尚不清楚。
因此,本实验以大鼠背部负重形式,建立过度跳跃性应力所致的骨质破坏大鼠模型,观察大鼠胫骨形态学的变化,检测血清骨代谢生化指标ALP、StrACP浓度和PTH水平,此外检测胫骨OPG和RANKLmRNA表达,分析PTH、OPG和RANKL在骨代谢中的作用,以期为揭示过度应力所致骨质破坏的分子机制提供实验依据,为靶向预防和治疗运动性骨损伤提供新思路。
1 实验材料和方法
1.1 实验动物及分组
8周龄雄性SD大鼠48只,购自苏州大学动物实验中心。以国家标准啮齿类动物饲料饲养,动物房室温22±6℃,相对湿度45±5%,每日按照自然昼夜照明,光照时间每天12小时。大鼠随机平均分为普通跳跃组、负重跳跃组和对照组。实验2周时各组处死8只大鼠并取材,分别记为跳跃2周组(J2),负重跳跃2周组(JL2)和对照2周组(C2),实验6周时处死剩余大鼠,记为跳跃6周组(J6),负重跳跃6周组(JL6)和对照6周组(C6)。跳跃组大鼠置于自制跳跃电刺激笼内,按运动方案进行跳跃运动。负重跳跃组大鼠按自身体重5%重量,系上铅粉背包,并进行与跳跃组相同的运动方案。对照组安静饲养。
1.2 主要仪器
自制大鼠跳跃笼及刺激装置:长宽高为1.2米,顶部没有遮盖,分割出4个室,四周为光滑塑料板材料,底部板上布置平行排列的细铜条,将间隔铜条串联,外部连接变压器和半自动通电装置,能够按照运动方案要求自动通电和断电以及通电总时间,输出电压设置为35-55v。大鼠足部接触通电铜条,将向上跳跃,回落至底板时停止通电,进入下一个通电循环。按照“低电压,长间隙”方式,减轻大鼠电应激反应,以模拟真实跳跃运动。
1.3 跳跃运动方案
按递增负荷进行每周6天运动训练,J2组和JL2组参与2周跳跃运动,J6和JL6组参与6周跳跃运动。运动方案为1-2周:每15秒通电2秒,40个循环(10分钟)为一组,组间休息5分钟,持续运动6组,总运动时间为1小时。以此类推,3-4周总运动时间为1.5小时,5-6周总运动时间为2小时。
1.4 指标测试及方法
1.4.1 检测材料的制备
(1)各组大鼠完成最后一次运动结束24小时后,用10%水合氯醛溶液腹腔注射麻醉后,经心脏取血5ml,3000 rpm/min离心20分钟,血清置于-20℃冰箱保存待测。
(2)取一侧胫骨于10%福尔马林溶液中保存,用于石蜡切片。取另一侧胫骨,于-80℃冰箱保存待测。
1.4.2 指标检测方法
(1)HE染色及切片观察:使用德国Leica-EG1160型全自动石蜡包埋机对大鼠胫骨进行包埋,使用Leica-RM2145型石蜡切片将蜡块进行纵向连续切片,切片厚度5um,HE染色。
(2)生化指标检测:应用722分光光度计,采用比色法获取ALP和StrACP浓度值。按照PTH Elisa测定试剂盒操作说明,检测大鼠血清PTH浓度。
(3)mRNA检测:截取大鼠胫骨中段,剔除骨膜以及骨髓腔软组织,使用磨骨钳将骨质碾磨至粉状。骨组织总RNA提取参照Trizol试剂盒(宝生物工程大连有限公司)说明书进行。采用real time PCR法扩增检测目的基因表达,引物序列如表1所示。目的基因(OPG、RANKL)的Ct值减去内参GAPDH的Ct值得到ΔCt值,基因的相对表达量用2-ΔCt来表示。

表1 基因引物序列
1.5 统计学分析
采用SPSS17.0统计学软件对数据进行分析处理。计量资料采用平均数±标准差(±S)表示。采用单因素方差分析进行三组之间差异显著性检验,采用最小有意义差异法(LSD)进行组内差异性检验,P<0.05为有显著性差异。
2 结果
2.1 大鼠胫骨形态学比较
C2和C6组大鼠骨膜完整平滑,骨胶原纤维排列整齐,骨质紧密均匀,骨细胞分布均匀,未见空泡明显增加(图1:C2和C6)。J2和JL2组,大鼠胶原纤维较为完整和规则,但是空泡数量和大小均开始增加(图1:J2和JL2)。与J6和C6组相比,JL6组骨胶原纤维和骨膜排列紊乱,空腔明显增多,骨皮质出现较大程度破坏,骨膜排列杂乱(图1:C6、J6和JL6)。

图1 各组大鼠HE染色结果
2.2 骨代谢生化指标和血清PTH变化
2.2.1 骨代谢生化指标
运动2周各组ALP水平无显著性差异(p> 0.05)。运动6周后,JL6组ALP水平显著高于C6组和J6(p<0.01,p<0.05)。跳跃组和负重跳跃组的StrACP水平均显著高于对应对照组,负重跳跃高于跳跃组,但无显著性差异(表2)。
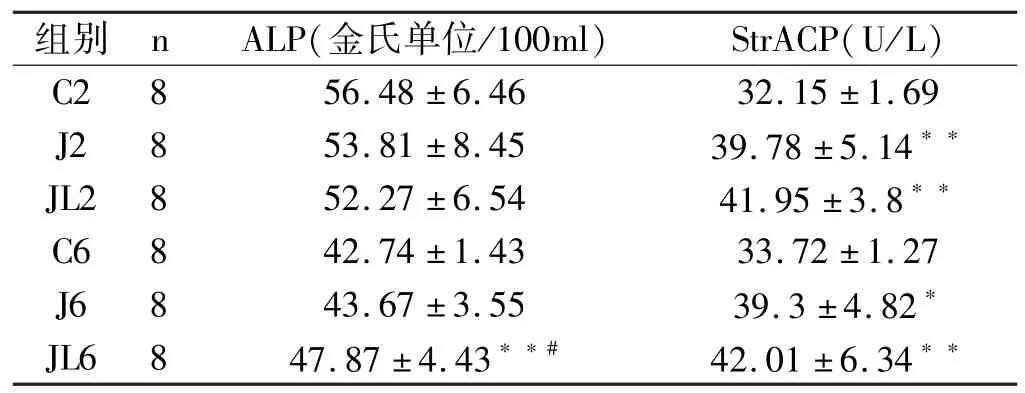
表2 各组大鼠血清ALP和StrACP比较
2.2.2 大鼠血清PTH
JL2组PTH水平显著低于J2和C2组(p<0.05,p<0.01),J2组低于C2组(p<0.05)。6周后,各组PTH水平均低于对应组别2周时水平。JL6组PTH水平显著低于J6和C6组(p<0.05,p<0.01),J6组低于C6组(p<0.05)(表3)。
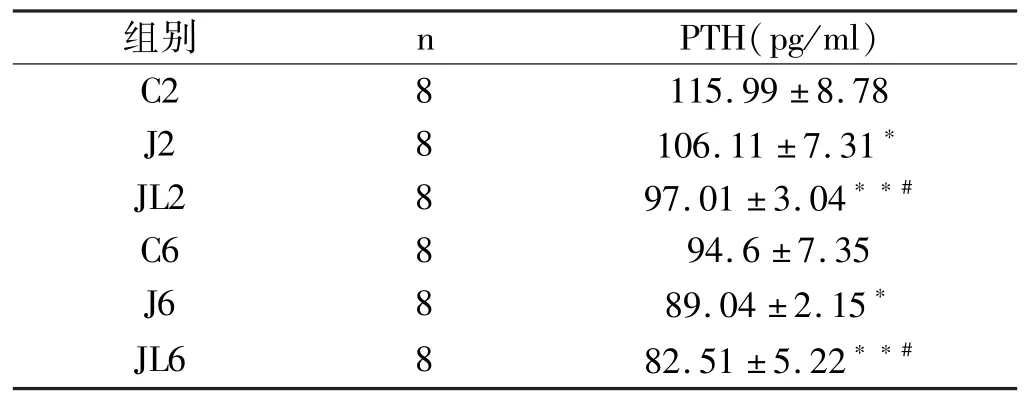
表3 各组大鼠血清PTH比较
2.3 大鼠胫骨OPG、RANKL的表达
在2周时,三组骨OPGmRNA表达量差异不显著,而6周时,J6组和JL6组OPGmRNA表达显著升高(表4,图2)。JL6组RANKL表达显著高于J6和C6组(p<0.01),J6组表达高于C6组(p<0.05)(表4,图3)。
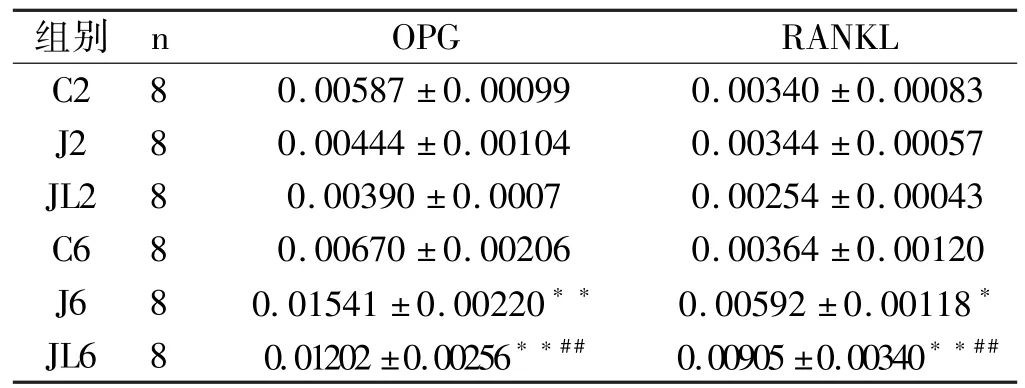
表4 各组大鼠胫骨OPG和RANKLmRNA相对表达比较
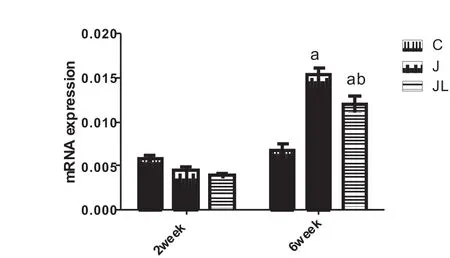
图2 各组大鼠胫骨OPGmRNA相对表达比较
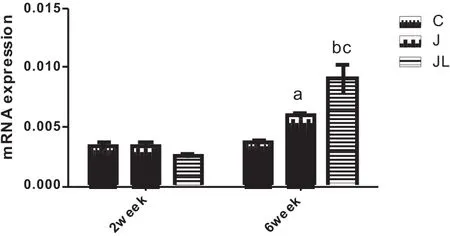
图3 各组大鼠胫骨RANKLmRNA相对表达比较
3 分析与讨论
3.1 跳跃运动对大鼠骨骼形态学和骨代谢的影响
运动对骨骼结构和功能的影响是复杂的,不同运动持续时间和运动强度以及运动方式均会产生不同的效益[3]。运动所致骨质破坏的发生机制,目前存在两种主要的观点:一是长期运动导致内分泌系统紊乱,继而引发骨代谢异常;二是应力刺激直接调控骨骼相关力学信号转导通路对骨功能细胞产生影响,继而产生骨代谢紊乱。有趣的是,研究发现8周跳跃运动比游泳运动更加能够改善去卵巢大鼠胫骨生物力学性能和骨密度,进一步的研究认为游泳运动对生长期大鼠腰椎生长发育有明显作用,而对股骨和胫骨作用不明显[4]。因此,跳跃运动对骨的局部刺激效果更加明显,我们的实验从胫骨取材和检测有利于骨质破坏机制的探讨。
研究表明长期卧床可以形成废用性骨质疏松症,而适度运动刺激有利于骨密度和骨量的维持[5]。然而,过度运动训练或过度负荷会导致骨脆性和骨折风险增加(如应力性骨折),骨量减少。陈晓红[6]等研究发现持续15周递增负荷跑台运动,引起大鼠胫骨骨密度先增加后减少,胫骨上段骨小梁面积百分比和骨小梁厚度先轻微上升后下降,表明大负荷运动导致骨质破坏,明显加剧骨吸收和骨形成,骨量降低,骨代谢呈高转换特征。
大鼠生长期血清ALP主要来源于骨,能够用于评价成骨细胞活跃程度,推断骨形成水平,此外,大量研究指出骨吸收增加,StrACP浓度增高[7]。适宜强度8周纵跳运动比游泳运动更加有效促进大鼠腰椎和股骨的骨密度,并且ALP和TRACP明显升高[4]。曹鹏[8]通过比较不同负荷跑台运动对老龄大鼠骨量及骨代谢指标发现,大强度组10周跑台运动,血清ALP水平升高最显著,但是骨密度改善不明显。本实验中C2组测定的ALP水平高于C6组数值,而StrACP的数值较为稳定,这表明8周龄大鼠处于生长期,骨代谢本身以保留型骨重建为主。负重跳跃训练6周后StrACP和ALP水平显著高于J6和C6组,这表明过度跳跃应力刺激引起破骨细胞活性显著增加,联系JL6组的组织形态学改变,提示出现以骨代谢转换率升高为特点的骨质破坏过程。
3.2 跳跃运动对大鼠血清PTH的影响
应用机械载荷和PTH局部注射的方法对大鼠骨折处进行处理,结果发现两种干预手段联合应用时,成骨细胞和破骨细胞活性增加最为明显,且骨密度和骨量随之增加,值得注意的是PTH单独处理后,也能加强早期成骨细胞活性,增加骨矿化和总骨量[9]。同样,Ellegaard等[10]研究发现通过对骨折大鼠局部注射PTH(1-34),促进骨折康复,而且不存在力学刺激下也发挥出PTH的促骨形成效益。因此,PTH具有促进成骨细胞活性而具有愈合骨折的作用,反之生理性PTH减少也不利于骨骼健康发育。本实验中PTH在C2组高于C6组的原因可能是由于生长期大鼠体内整体代谢旺盛,而引起PTH升高[11]。JL6和J6组中随着跳跃负荷强度增加和时间延长PTH持续下降,特别是JL6组PTH下降更加显著。跳跃组PTH的下降可能与破骨细胞活跃有关,研究发现骨质破坏的骨组织中骨吸收占主导作用,引起Ca2+释放入血增加,机体通过负反馈系统减少PTH分泌,PTH分泌减少又进一步减少小肠对Ca2+的吸收,不利于骨矿沉积[12]。而且,PTH分泌减少又对成骨细胞活性刺激减弱,不利于破坏骨质的康复[13]。综上认为,在过度跳跃运动后PTH分泌减少,可以通过内分泌系统介导而不利于钙离子摄入和新骨形成的增加,最终加剧骨质破坏过程。
3.3 跳跃运动对胫骨OPG和RANKL表达的影响
尽管PTH等激素对成骨细胞和破骨细胞的直接调控的分子机制目前仍不完全清楚,但是力学敏感信号通路中的某些分子可能是激素作用的关键靶点。在骨组织中,多种因素均可以通过调节OPG/RANKL之间的平衡而影响骨的生理和病理代谢。成骨/基质细胞分泌RANKL,可以和破骨细胞前体或破骨细胞表面的受体RNAK结合,继而促进破骨的分化成熟及活性增强,骨吸收代谢可随之增强;成骨细胞分泌的OPG可以与RANK竞争性结合RANKL,阻碍RANKL与RANK之间的结合,从而抑制破骨细胞的活性,起到保护骨组织作用[14]。实验表明,如果RANKL过度表达和/或OPG异常降低,导致骨吸收代谢过度增强,可产生以骨量丢失和骨质破坏为特征的骨质疏松、骨关节炎等骨代谢疾病[15]。李春雯[16]研究指出强骨胶囊可以提高骨质疏松大鼠胫骨骨密度及血清OPG含量,同时改善大鼠胫骨生物力学性能,但可以降低RANKL浓度。赵仁清[17]研究了7周大负荷运动对大鼠血清OPG和sRANKL及骨代谢生化因的影响,结果发现大负荷运动后血清OPG下降而RANKL上升,并且指出OPG/sRANKL比值下降,引起破骨细胞增多是骨密度下降的原因。由上述研究可知,不管是过度负荷还是内分泌因素异常占主导作用而引起的骨质破坏,OPG/ RANKL的变化可能是其共同的分子生物学基础。
本实验结果表明,跳跃运动6周后OPG表达显著升高,且跳跃组高于负重跳跃组,而负重跳跃组的RANKL表达显著高于6周跳跃组和对照组。与上述实验抑制,跳跃组和负重跳跃组OPG/RANKL比值下降,可能引起破骨细胞活性增强。与普通跳跃组相比,负重跳跃组由于自身负重,所受过度应力刺激不仅RANKL升高更加显著,骨质形态学破坏也更加明显。
综上所述,过度的跳跃性应力刺激能够导致骨质破坏发生,该过程以骨吸收大于骨形成的骨代谢转换率升高为特征。RANKL在过度应力刺激中通过激活破骨细胞活性,增强骨吸收,而血清PTH浓度持续下降影响破坏骨质的康复。继续深入研究骨代谢应力敏感信号通路,以及信号分子与内分泌激素之间的内在联系机制,有利于阐明骨质破坏发生的分子机制。
[1]Burgers TA,Williams BO.Regulation of Wnt/β-catenin signaling within and from osteocytes[J].Bone,2013,54(2013): 244-249.
[2]Ellegaard M,Jorgensen NR,Schwarz P.Parathyroid hormone and bone healing[J].Calcif Tissue Int,2010,87(1):1-13.
[3]Nilsson M,Ohlsson C,Mellstr¨om D,et al.Sport-specific association between exercise loading and the density,geometry,and microstructure ofweight-bearing bone in young adultmen[J].Osteoporos Int,2013,24(5):1613-1622.
[4]李世昌,季浏,刘体伟,等.不同方式运动对去卵巢大鼠骨密度、骨生物力学及代谢指标的影响[J].体育学刊,2012,19(2): 132-137.
[5]伍中庆,吴宇峰,张文宙.运动疗法在原发性骨质疏松症中应用的研究进展[J].中国康复医学杂志,2011,26(2):198-200.
[6]陈晓红,郑陆,朱一力,等.长期递增负荷运动对雌性大鼠胫骨上段骨组织形态计量学的影响[J].中国运动医学杂志, 2011,30(11):1012-1017.
[7]Marchand LH,Le Drevo MA,Chappard D.Disuse induced by botulinum toxin affects the bone marrow expression profile of bone genes leading to a rapid bone loss[J].JMusculoskeletNeuronal Interact,2013,13(1):27-36.
[8]曹鹏.不同强度跑台运动对老龄雌性大鼠骨量及骨代谢的影响[J].北京体育大学学报,2009,32(2):74-76.
[9]López-Herradón A,Portal-Nú¯nez S,García-Martín A,et al.Inhibition of the canonicalWnt pathway by high glucose can be reversed by parathyroid hormone-related protein in osteoblastic cells[J].JCell Biochem,2013,114(8):1908-1916.
[10]Ellegaard M,Kringelbach T,Syberg S,et al.The effect of PTH(1-34)on fracture healing during different loading conditions.[J].JBone Miner Res,2013:[Epub ahead of print].
[11]MoghadasiM,Siavashpour S.The effectof12 weeks of resistance training on hormones of bone formation in young sedentary women[J].Eur JAppl Physiol,2013,113(1):25-32.
[12]Roberts MD,Santner TJ,Hart RT.Local bone formation due to combined mechanical loading and intermittent hPTH-(1-34) treatmentand its correlation tomechanical signal distributions[J].J Biomech,2009,42(15):2431-2438.
[13]Sloan AV,Martin JR,Li S,et al.Parathyroid hormone and bisphosphonate have opposite effects on stress fracture repair[J]. Bone,2010,47(2):235-240.
[14]Malliga DE,Wagner D,Fahrleitner PA.The role of osteoprotegerin(OPG)receptor activator for nuclear factor kappaB ligand (RANKL)in cardiovascular pathology[J].Wien Med Wochenschr,2011,161(23-24):565-570.
[15]Narducci P,Bareggi R,Nicolin V.Receptor Activator for Nuclear Factor kappa B Ligand(RANKL)as an osteoimmune key regulator in bone physiology and pathology[J].acta histochemica, 2011,113(2):73-81.
[16]李春雯.强骨胶囊对去卵巢大鼠血清OPG、RANKL表达影响的研究[J].中国中医骨伤科杂志,2012,20(12):1-3.
[17]赵仁清.大负荷运动对大鼠血清OPG、sRANKL、骨代谢及骨量的影响[J].体育与科学,2011,32(2):88-90.
Effect of Jumping Stress on the PTH and OPG/RANKL of Bone M etabolism in Rats'Tibia
LISheng-Cun,WANGGuo-Xiang
(Suzhou University,Suzhou,Jiangsu 325000)
objective:To investigate the effects of jumping stress stimulation on the parathyroid hormone(PTH)and molecules expression of OPG and RANKL related to bone metabolism in Rat's Tibias,and to explore the molecular mechanism of bone destruction.Methods:48 eight-week old SD ratswere equally randomized into control group(C), jump group(J)and loading jump group(JL).After twoweeks,8 ratswere taken from three groups,marked as:C2,J2 and JL2 groups and after six weeks the rest taken and marked as:C6,J6 and JL6.Jgroup participated in incremental load training,JL group gained 5%of body weight load whose training plan was the same with the J6 group and the C group was not treated.The serum PTH levels weremeasured by enzyme-linked immunosorbent assay(ELISA).Alkaline phosphatase(ALP)and anti-tartaric acid acidic phosphoric acid(StrACP)in serum were assayed by colorimetric method.One side tibia wasmade HE paraffin section,the other side was assayed themRNA expression of IL-6,OPG and RANKL by RT-PCR.Results:(1)Compared with C6 and J6,collagen fibers of periost were disordered with a larger degree of damage to the cortical bone,the cavitys increases in JL6 group.(2)The serum ALP and StrACP levels in three jumping groupswere significantly higher compared with those in control groups(p<0.05).The serum StrACP levels in JL6 and J6 groupswere significantly higher compared with those in C6 groups(p<0.05).(3)Compared with the C2 group,the level of PTH was significantly lower in the J2 and JL2 groups(p<0.05).The serum PTH level in JL6 group was significantly lower compared with that in C6 and J6 groups(p<0.05).(4)The mRNA expression of OPG in JL6 and J6 groupswere higher than in C6(p<0.05),and itwas the highest in J6 group.ThemRNA expression of RANKL was significantly higher in JL6 group than in the C6 and J6 groups(p<0.01).Conclusions:Bone de-struction characterized by higher bone turnover in rats'tibiaswas severe after 6 weeks of loaded jump because of the increased expression of RANKL.The decreased level of PTH is not helpful for the heal of bone destruction.
jumping stress;PTH;OPG/RANKL
G804.2
:A
:1001-9154(2014)10-0069-05
G804.2
:A
:1001-9154(2014)10-0069-05
苏州市科技计划应用基础研究项目(SYS201312)
李盛村(1985-),男,浙江省温州市人,汉族,苏州大学体育学院在读博士研究生,研究方向:运动医学。
2014-06-20
