小牛肠碱性磷酸酶活性检测方法的建立
2014-04-24赖晓芳刘奕雄兰全学赖心田杨国武
赖晓芳,林 霖,李 意,刘奕雄,兰全学,赖心田,杨国武
(深圳市计量质量检测研究院,广东深圳 518131)
碱性磷酸酶在科研上的应用目前主要集中在用于DNA片段的去磷酸化,即从核酸中去除5’磷酸以减少质粒载体在连接反应中的环化,使DNA易受或抵抗某些作用于核酸的酶。碱性磷酸酶根据其来源不同分为小牛肠碱性磷酸酶、虾源碱性磷酸酶和细菌源碱性磷酸酶等[1]。其中,小牛肠碱性磷酸酶为目前科研中最常用的且最容易购买到的,其活性部位由Asp101-Ser102-Ala103、3个在空间上相靠近的金属离子及配体、Arg166及其他一些相邻氨基酸残基组成[1-2]。最佳反应pH取决于反应底物以及反应底物浓度和所选择的缓冲液类型,然而碱性磷酸酶对于各种已知的缓冲液及底物,其最适酶活 pH 不低于 8.0[3]。
碱性磷酸酶测定常用的缓冲体系分为激活型、抑制型和惰性型3类,其测定结果差异很大,其主要原因是其缓冲体系不仅具有缓冲作用,还可作为磷酸酰基的受体,提高酶促反应的速度,从而导致了测定结果的差异[4]。磷性磷酸酶检验方法有化学抑制法、电泳法、免疫法、分光光度法等,前2种方法的灵敏度和特异性较低,免疫法虽有较高的灵敏性和特异性但操作复杂耗时,而基于碱性磷酸酶活力的分光光度法更加方便和快捷[5]。科研用小牛肠碱性磷酸酶目前国内外均无专门的检验标准。国内关于碱性磷酸酶活性检测的现有标准有NY/T 801-2004《生鲜牛乳及其制品中碱性磷酸酶活度的测定方法》[6]、WS/T 351-2011《碱性磷酸酶(ALP)催化活性浓度测定参考方法》[7],这2个标准中采用的底物、缓冲液和酶活单位定义均大不相同。
由于NY/T 801-2004中检测对象为牛乳因此需要大量使用挥发性有机试剂正丁醇,对通常以毫克级别提供的科研用小牛肠碱性磷酸酶极不合适;WS/T 351-2011检测对象为血清,因此对试验环境条件控制严格,对分光光度计要求配制恒温模块,恒温模块价格昂贵,普通实验室难以达到[6-7]。由于科研中常用Tris·HCl缓冲液,与标准中所用不同会造成检测结果的偏差,因此有必要建立与科研中使用条件一致的检测方法。笔者比较科研中小牛肠碱性磷酸酶反应条件以及现有酶活性检测方法与条件,建立了一套适用于科研用小牛肠碱性磷酸酶活性的检测方法,以有助于统一科研中使用的小牛肠碱性磷酸酶活单位,从而保证试验结果的准确性和可靠性。
1 材料与方法
1.1 材料与试剂 碳酸钠,购自西陇化工股份有限公司;碳酸氢钠,购自天津市红岩化学试剂厂;Tris base,购自深圳新拓扑生物科技有限公司;磷酸苯二钠盐水合物(98%),购自阿法埃莎化学有限公司;铁氰化钾,购自天津市红岩化学试剂厂;硼酸,购自国药集团化学有限公司;氢氧化钠,购自天津市红岩化学试剂厂;4-氨基安替比林,购自天津市科密欧化学试剂有限公司;无水苯酚,购自国药集团化学有限公司;氯化镁,购自西陇化工股份有限公司;氯化锌,购自西陇化工股份有限公司;氯化钾,购自西陇化工股份有限公司;甘油(纯度99.9%),购自Sigma公司。
1.2 仪器与设备 紫外可见分光光度计(DU730型),为美国贝克曼库尔特公司产品。(试验使用1 cm光径、4 ml容量的石英比色皿。)
1.3 试验方法
1.3.1 酶活性的检测方法。①在空白管:加入1.0 ml 0.04 mol/L磷酸苯二钠,37℃预热5 min;加入1.0 ml 0.01 mol/L Tris·HCl缓冲液(pH 8.0),混匀后37℃中水浴10 min;加入1.0 ml 0.5 mol/L NaOH溶液、1.0 ml 4-氨基安替比林、2.0 ml铁氰化钾溶液,立即混匀。②在反应管中加入1.0 ml 0.04 mol/L磷酸苯二钠,37℃预热5 min;加入1.0 ml酶液,混匀后37℃水浴10 min;加入1.0 ml 0.5 mol/L NaOH溶液、1.0 ml 4-氨基安替比林、2.0 ml铁氰化钾溶液,立即混匀。使用紫外可见分光光度计于波长510 nm处,以零号管为空白,读取各管吸光度,绘制校正曲线。
酶活单位定义(Defined enzyme unit,DEU):在37℃0.01 mol/L Tris·HCl缓冲液(pH8.0)中,1 min水解磷酸苯二钠产生1 μg苯酚。比活力单位为DEU/mg或DEU/ml。
铁氰化钾溶液的配制:称取铁氰化钾2.5 g和硼酸17 g,各自溶于去离子水400 ml中,混合后加入去离子水至1 000 ml,置于棕色瓶中避光保存(如出现蓝绿色立即弃去)。4-氨基安替比林溶液的配制:称取4-氨基安替比林1.5 g,加去离子水溶解至500 ml置于棕色瓶中保存。
1.3.2 酶液稀释。酶活性检测影响试验所用酶为NEB M0290S小牛肠碱性磷酸酶(明示酶活为10 000 U/ml),吸取10 μl酶液置于 990 μl碱性磷酸酶贮备液(10 mmol/L Tris·HCl(pH 8.0),50 mmol/L KCl,1 mmol/L MgCl,0.1 mmol/L ZnCl2,50%甘油)中,制成 NEB的酶母液(100 U/ml),置于-20℃冰箱备用。使用0.1 mol/L碳酸盐缓冲液(pH 10.2)、Tris·HCl缓冲液(pH 8.0)分别对母液中的酶进行稀释,直至明示酶活分别如表1所示。

表1 酶液稀释度
1.3.3 标准曲线的绘制。
1.3.3.1 1 mg/ml酚标准贮存液的制备。称取重蒸馏苯酚1.0 g,溶解于0.1 mol/L盐酸中,并定容至1 000 ml。
1.3.3.2 0.05 mg/ml酚标准应用液的制备。取上述酚标准贮存液5 ml,加去离子水定容至100 ml。此溶液只能保存2~3 d。按表2添加各溶液,立即混匀,于510 nm处,以零号管为空白,读取各管吸光度,绘制校正曲线。
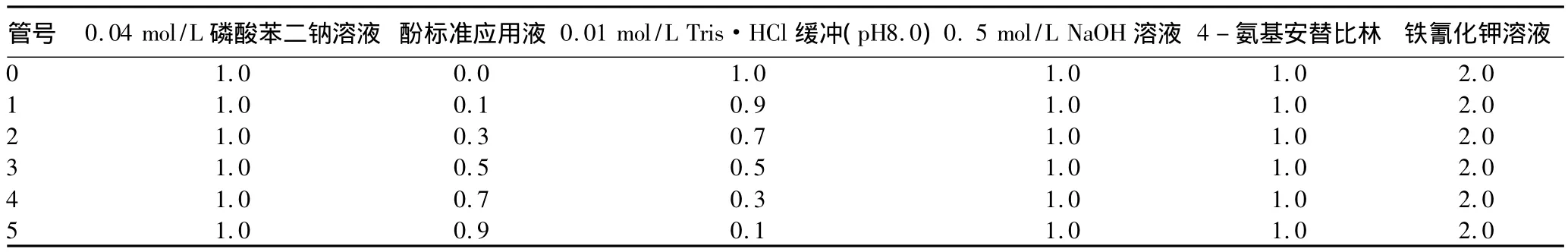
表2 各溶液的配制ml
1.3.4 缓冲液更换对酶活检测的影响试验。反应酶液按照“1.3.2”配制。按“1.3.1”中方法进行酶活性检测,比较Tris·HCl缓冲液(pH 8.0)和0.1 mol/L碳酸盐缓冲液(pH 10.2)的中酶活性变化。各酶活梯度检测时设置2个重复。
1.3.5 静止时间对酶活检测的影响试验。按“1.3.1”中方法进行酶活性检测。加入铁氰化钾后分别静止0、5、10 min进行酶活性检测,分别采用铁氰化钾溶液和加硼酸的铁氰化钾溶液(每1 L含硼酸17 g)测定。各个酶活梯度检测时设置2个重复。
1.3.6 水浴时间对酶活性检测的影响试验。按“1.3.1”中方法进行酶活性检测。加入反应酶液后分别水浴2、5、10、15 min进行酶活性检测。各个酶活梯度检测时设置2个重复。
1.3.7 底物浓度对酶活性检测的影响试验。分别配制0.01、0.02、0.04和0.06 mol/L磷酸苯二钠溶液。按“1.3.1”中方法进行酶活性检测。各个酶活梯度检测时设置2个重复。
1.3.8 温度对酶活性检测的影响试验。按“1.3.1”中酶活性检测方法,分别于25、37、45、55 ℃下水浴10 min,进行酶活性检测各个酶活梯度检测时设置2个重复。
1.3.9 pH对酶活性检测的影响试验。按“1.3.1”中酶活性检测方法,分别配制0.01 mol/L Tris·HCl(pH 7.0、7.5、8.0、9.0、9.5)缓冲液,进行酶活性检测各个酶活梯度检测时设置2个重复。
1.3.10 缓冲液离子强度对酶活性检测的影响试验。按“1.3.1”中酶活性检测方法,分别于配制的0.005、0.01、0.05、0.1 mol/L Tris·HCl(pH 8.0、)缓冲液,进行酶活性检测各个酶活梯度检测时设置2个重复。
2 结果与分析
2.1 苯酚的标准曲线 从图1可以看出,苯酚标准曲线的线性方程为y=0.023 1x-0.004 9,线性相关系数(R2值)为0.999 6。
2.2 缓冲液更换对酶活检测的影响 由表3可知,在碳酸盐缓冲液(0.1 mol/L pH 10.2)中达到相近检测吸光度值的酶液浓度比Tris·HCl缓冲液(0.01 mol/L pH 8.0)更低。若采用统一浓的度酶液溶解于不同缓冲液中会导致其吸光度值大不相同。
2.3 静止时间对酶活性检测的影响 加了硼酸的铁氰化钾溶液显色稳定。由表4可知,静止0、5、10 min后检测其吸光度值偏差在±0.005内,而不添加硼酸的铁氰化钾溶液则用肉眼即可见其颜色随时间增加而迅速褪减。
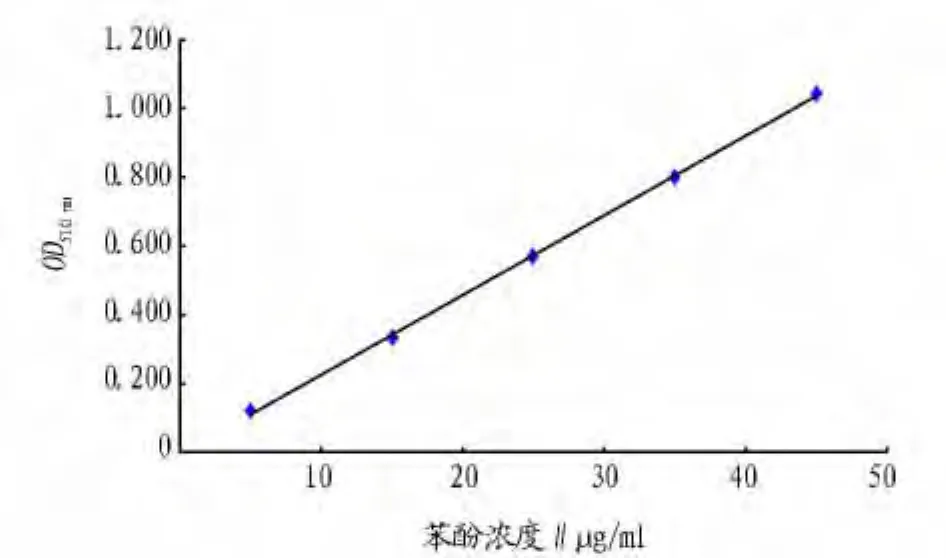
图1 苯酚的标准曲线

表3 不同浓度缓冲液的吸光度值
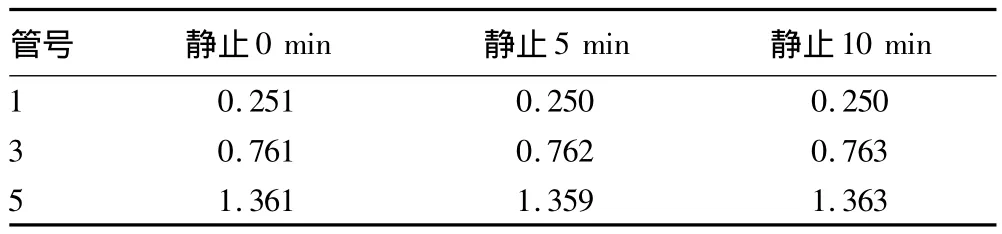
表4 不同静止时间后的吸光度值
2.4 水浴时间对酶活测定的影响 从图2可以看出,15 min内酶活性反应呈线性增长,而且线性相关系数(R2值)能达到0.99以上,因此选择10 min为最佳反应时间,此时线性区域更加符合检验需求。

图2 水浴时间对酶活性的影响
2.5 底物浓度对酶活性检测的影响 由图3可以看出,底物浓度改变时酶活性变化不大,但底物浓度为0.01~0.02 mol/L时其吸光度值差异较大(接近0.020),而当底物浓度为0.04~0.06 mol/L时吸光度值趋于稳定,因此底物浓度选用0.04 mol/L较为合适。
2.6 温度对酶活性检测的影响 从图4可以看出,随着温度的增加,对低浓度酶其活性影响变化幅度不大,但对高浓度的酶温度对其酶活性影响逐渐增大。
2.7 pH对酶活性检测的影响 从图5可以看出,pH 7.0~8.0范围内酶活性变化不大,但随着pH的升高,酶活性变化逐渐出现跳跃式的增大。因此,采用pH 7.0~8.0的缓冲液能够较好维持酶活性的稳定性。
2.8 缓冲液离子强度对酶活性检测的影响 从图6可以看出,不同缓冲液离子强度中酶活性稍有变化,但是变化幅度不大,因此确定缓冲液粒子强度对其影响不大。
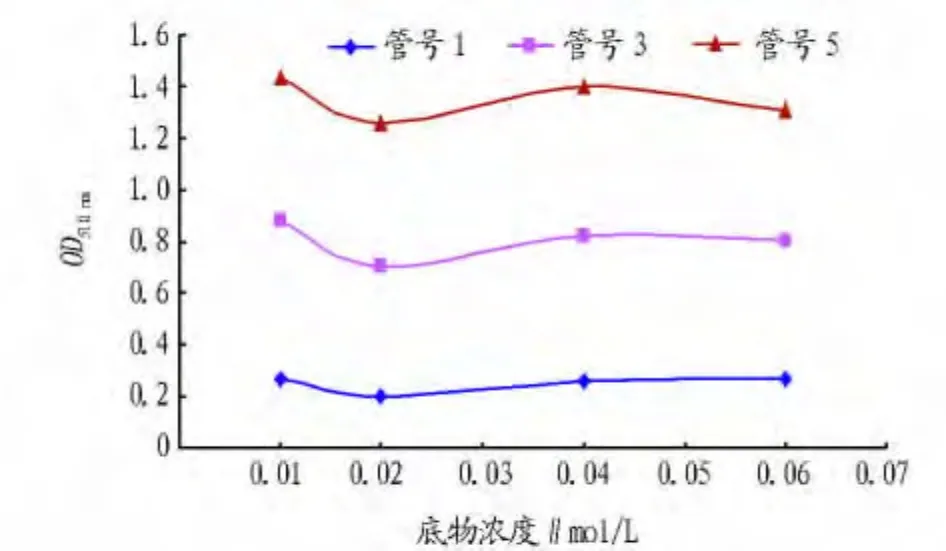
图3 底物浓度对酶活性的影响
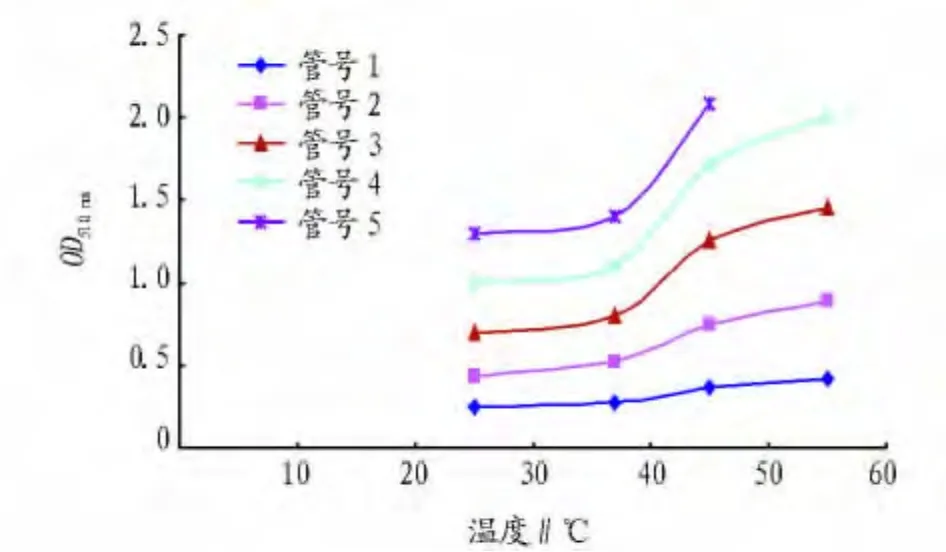
图4 温度对酶活性的影响

图5 pH对酶活性的影响

图6 缓冲液离子强度对酶活性的影响
式中,K为510 nm处分光光度值带入苯酚标准曲线的公式中计算而得产生的苯酚浓度(μg/ml);6表示反应总体积为6 ml;10表示反应水浴时间为10 min,酶活单位定义以1 min计;d表示2 min酶反应液中所含原酶粉重量(mg)或原酶液体积(ml)。
3 讨论
国内对碱性磷酸酶检测的标准分别是针对牛奶和血清中碱性磷酸酶的活性检测,由于检测对象的不同所采用的缓冲液、底物、pH、温度等也都大不相同[6-7]。其中,WS/T 351-2011标准中检测底物采用对硝基苯酚磷酸盐,由于检测对象为血清,血清中存在大量颜色干扰物质,因此其设置的加入量为100 μl,检测温度为接近体温的37℃,并且检测时使用受体激活剂2-氨基-2-甲基1-丙醇,因此其检测值应比实际使用时偏高。据报道,若处于高于25℃的环境中就会产生自分解反应,因此这也将影响检测结果的准确性[5]。选用磷酸苯二钠作为酶活性检测底物,主要原理为磷酸苯二钠在碱性磷酸酶作用下被分解、释放出苯酚,苯酚在碱性环境中经过铁氰化钾氧化作用,并与4-氨基安替比林显色剂结合产生红色的醌类化合物,于510 nm特异波长检测,在与标准曲线对比换算可计算出酶活力。由于科研中多使用0.01 mol/LTris·HCl(pH8.0)缓冲液对核酸进行保护,而对质粒进行去磷酸化反应时常使用温度为37℃,因此采用该缓冲液及温度进行酶活性检测能够更真实反映酶活性。同时,NY/T 801-2004使用2,6-二氯醌氯亚胺以及硫酸铜对苯酚进行显色检测,由于2,6-二氯醌氯亚胺容易降解产生游离物质,因此需使用当日配制,这在日常检验工作中增加了工作量也造成了一定程度的浪费[8]。
该试验中通过设置2种缓冲液,发现若使用不同的缓冲液对酶活性进行检测其测量值差异较大,因此应选用与实际使用条件一致的缓冲液;而通过设置不同的静止时间若使用加了硼酸的铁氰化钾溶液则可以实现颜色的稳定显示,以减少误差;针对目前采用磷酸苯二钠底物浓度不一致的情况[9-10];通过设置不同的底物浓度,选择较稳定的最低浓度(0.04 mol/L);通过设置不同反应时间,将反应时间缩短至10 min。笔者建立了科研用小牛肠碱性磷酸酶的活性检测方法,说明采用该方法其检测结果更加贴近实际使用活性。
[1]陈凤娟.碱性磷酸酶结构与活性的研究及DNA化学酶、MoFeco的模拟合成[D].兰州:兰州大学,2009.
[2]王秋颖.碱性磷酸酶特性及其应用的研究进展[J].中国畜牧兽医,2011,38(1):157-161.
[3]ROSS M H,ELY J O,ARCHER J G.Alkaline phosphatase activity and pH optima[J].Journal of Biological Chemistry,1951,192(2):561-568.
[4]郑铁生,叶立新,薛锦,等.不同激活型缓冲体系对碱性磷酸酶活性测定的影响[J].临床检验杂志,2005,23(6):423-424.
[5]冯春梁,李红丹,张振彦,等.催化动力学光度法测定碱性磷酸酶的理论分析与条件优化[J].辽宁师范大学学报:自然科学版,2009,32(2):195-198.
[6]中华人民共和国农业部.NY/T 801-2004生鲜牛乳及其制品中碱性磷酸酶活度的测定方法[S].北京:中国标准出版社,2004.
[7]中华人民共和国卫生部.WS/T 351-2011碱性磷酸酶(ALP)催化活性浓度测定参考方法[S].北京:中国标准出版社,2011.
[8]洪红.乳品中碱性磷酸酶活度的比色测定[J].中国乳品工业,2004,32(40):34-36.
[9]张洪渊,刘克武,石安静,等.背角无齿蚌碱性磷酸酶分离、纯化及其动力学研究[J].水生生物学报,1996,20(1):57-61.
[10]徐文华.盐浓度对人血清碱性磷酸酶活性的影响[J].青岛大学医学院学报,2002,38(3):265-266.
