高效液相色谱法同时测定黑米酒中11种酚类物质
2014-04-24周宝龙叶群梁刘学波王玉堂
姜 莉,周宝龙,杨 烨,叶群梁,刘学波,王玉堂
(1.西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100;2.陕西朱鹮黑米酒业有限公司 陕西 洋县 723300)
黑米酒以黑米为主要原料,通过传统的发酵和勾兑工艺制成,由于其具有独特的香气和风味以及较低的酒精度,受到越来越多消费的青睐[1-2]。黑米中含有丰富的淀粉、蛋白质,组成齐全的氨基酸以及多种微量元素(Se、Zn、Fe、Mn、Ge等)和维生素等营养成分[3]。此外黑米中还含有能调节人体多种生理功能的酚类成分(如花色苷、黄酮以及酚酸类物质等),这些成分具有抗氧化、延缓衰老、降血压、防龋齿、防辐射、抗过敏、抗癌、抗血小板凝聚、消炎等功能特性[4-5]。黑米作为一种天然保健食品,同时也是功能食品的理想原料[6-7]。近年来,不少地方出现以黑米、红米等为主要原料的酿酒企业,这对黑米的开发和深加工有着积极深远的意义。目前,关于黑米酒中酚类活性物质的种类和含量的研究未见报道,建立准确的定量方法对研究黑米酒的保健功能以及质量控制具有重要意义。酚酸类化合物分析的方法有纸色谱、薄层色谱、气相色谱、高效液相色谱[8-11]、毛细管电泳和胶束毛细管电动色谱等。由于高效液相色谱具有多种组分同时测定,结果准确可靠等特点,广泛用于食品中黄酮、酚酸类物质的检测。如李永库等[12]对葡萄酒、方玲玲等[13]对樱桃酒、刘群涛等[14]对啤酒、胡华等[15]对酱油、孙崇臻等[16]对蜂蜜中的多种酚酸及黄酮类物质进行测定,建立了可靠的分析方法。本实验采用高效液相色谱法-二级管阵列检测(high performance liquid chromatography-diode array detector,HPLC-DAD)法,建立了黑米酒中8种酚酸(没食子酸、原儿茶酸、对羟基苯甲酸、香草酸、咖啡酸、丁香酸、对香豆酸和阿魏酸)和3种黄酮类物质(芦丁、异槲皮苷和槲皮素)同时测定的方法,并用于同类米酒的测定。该方法灵敏度高,结果准确可靠,为研究米酒的功能成分及其质量控制提供技术支持。
1 材料与方法
1.1 材料与试剂
黑米酒:陕西朱鹮黑米酒业有限公司;红米酒:井冈山市绢花红米酒厂;黄酒:绍兴白塔酿酒有限公司。
没食子酸、原儿茶酸、对羟基苯甲酸、香草酸、咖啡酸、丁香酸、对香豆酸、阿魏酸、芦丁、异槲皮苷和槲皮素标品购于上海纯优生物科技有限公司。色谱级甲醇、乙腈、冰乙酸和乙酸乙酯购于美国天地公司。水为蒸馏水和超纯水。
1.2 仪器与设备
LC-20A高效液相色谱仪(配SPD-M20A检测器,SIL-20A自动进样器及CLASS-VP工作站):日本岛津公司;SHB-Ⅲ循环水式真空泵:郑州长城科工贸有限公司;RE52AA旋转蒸发仪:上海亚荣生化仪器厂;生化仪器KQ-600DB数控超声波清洗器:江苏昆山超声仪器公司;PHS-3C酸度计:上海雷磁精科仪器厂;万分之一天平:梅特勒-托利公司。
1.3 色谱条件
色谱柱C18柱(250mm×4.6mm,5μm);流动相A为100%超纯水水(含1%乙酸),B 为50%乙腈溶液(含1%乙酸)。低压梯度洗脱,洗脱程序见表1,流速1mL/min。没食子酸、原儿茶酸、对羟基苯甲酸、香草酸、丁香酸、芦丁、异槲皮苷和槲皮素检测波长260nm,咖啡酸、香豆酸和阿魏酸检测波长320nm,柱温30℃,进样量为20μL。
1.4 方法
1.4.1 样品处理[17-18]
取一定样品,用浓盐酸调至pH=2.0,然后准确吸取样品10mL于125mL分液漏斗中,加入20mL 水,再加入30mL乙酸乙酯,振摇1min,静置10min,待分层完全后将下层液再次进行萃取,合并乙酸乙酯层。40℃条件下减压浓缩至干。残渣用2mL20%乙腈溶解,0.45μm滤膜过滤,上机测定。
1.4.2 标准溶液的配制
分别精确称取各标准品5.0mg,用甲醇溶解定容至10mL,得到每个标准品的贮备溶液500mg/L,置于4℃冰箱中避光保存。分别移取1mL 各单个标准贮备溶液混合,用20%乙腈溶液定容至50mL 得到质量浓度为10mg/L混合标准品使用液。
2 结果与分析
2.1 色谱条件的选择
2.1.1 检测波长的选择
将11种500mg/L的标准储备液稀释后进行进行全波长光谱扫描,各待测的最大吸收波长见表2。实验确定,定量测定没食子酸、原儿茶酸、对羟基苯甲酸、香草酸、丁香酸、芦丁、异槲皮苷和槲皮素检测波长为260nm,咖啡酸、对香豆酸和阿魏酸检测波长为320nm。
2.1.2 流动相的选择[19]
以C18色谱柱为固定相时,常用的流动相有甲醇-水、乙腈-水等[20]。但是由于酚羟基、羧基在水溶液中发生电离,极性增强,在固定相表面形成双重保留,易出现拖尾现象。加入少量酸性试剂,可抑制酚类物质的电离,以中性分子的形态存在,极性减弱,有利于增强在固定相上的保留,提高分离度,避免色谱峰拖尾。分别对水-甲醇体系,水-乙腈体系作为流动相进行比较,实验最终选择水为A相,50%乙腈为B相,二者均含有1%乙酸,在此条件下,梯度洗脱时,基线发生较小的飘移,并获得较好的分离效果。
2.1.3 梯度洗脱条件
由于酚类物质结构性质相似,要实现11种酚类物质的同时检测,需采用梯度洗脱的方式改善分离度。实验对洗脱梯度进行优化,确定洗脱程序。洗脱程序见表1。在此梯度洗脱条件下,11种酚类物质达到很好的色谱分离,标样色谱图见图1。
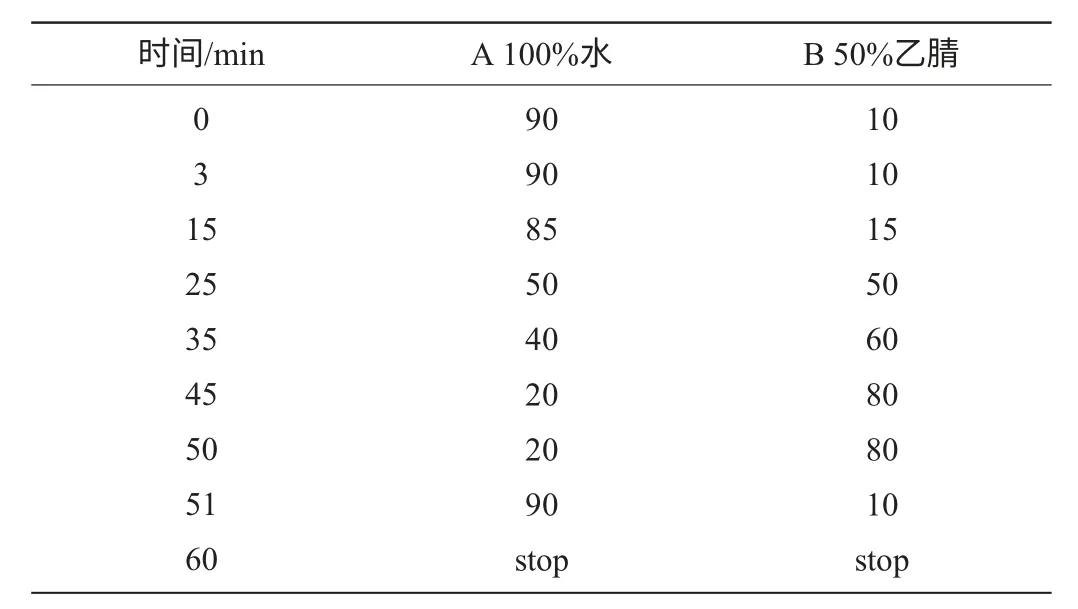
表1 流动相梯度洗脱程序Table 1 Elution program of mobile phase
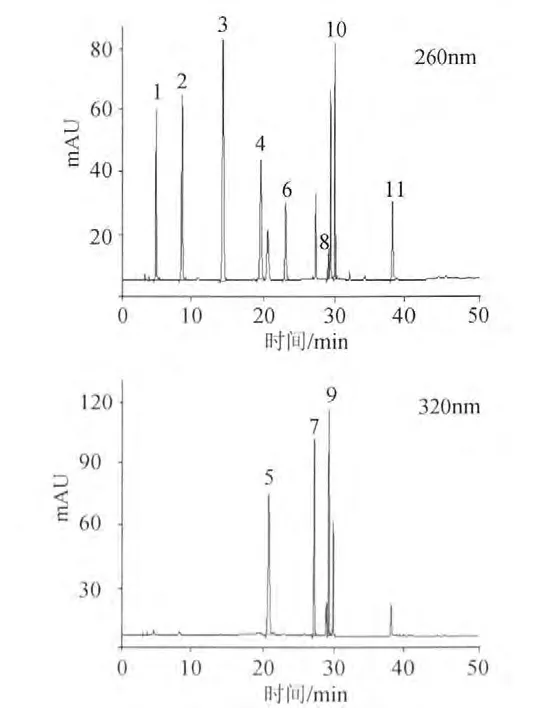
图1 11种酚酸标准品色谱图(260nm、320 nm)Fig.1 Chromatograms of 11 phenolic acid standards at 260nm and 320nm
2.2 标准曲线的建立
分别取储备液适量,用甲醇配制0.5mg/L、1.0mg/L、2.5mg/L、5.0mg/L、10mg/L的混合标准溶液,在确定的色谱条件下进样分析,平行测定3次,以浓度为横坐标,以峰面积为纵坐标绘制标准曲线。结果表明,11种酚类物质在质量浓度为0.5~10.0mg/L范围内的线性良好,相关系数R2≥0.996,结果见表2。
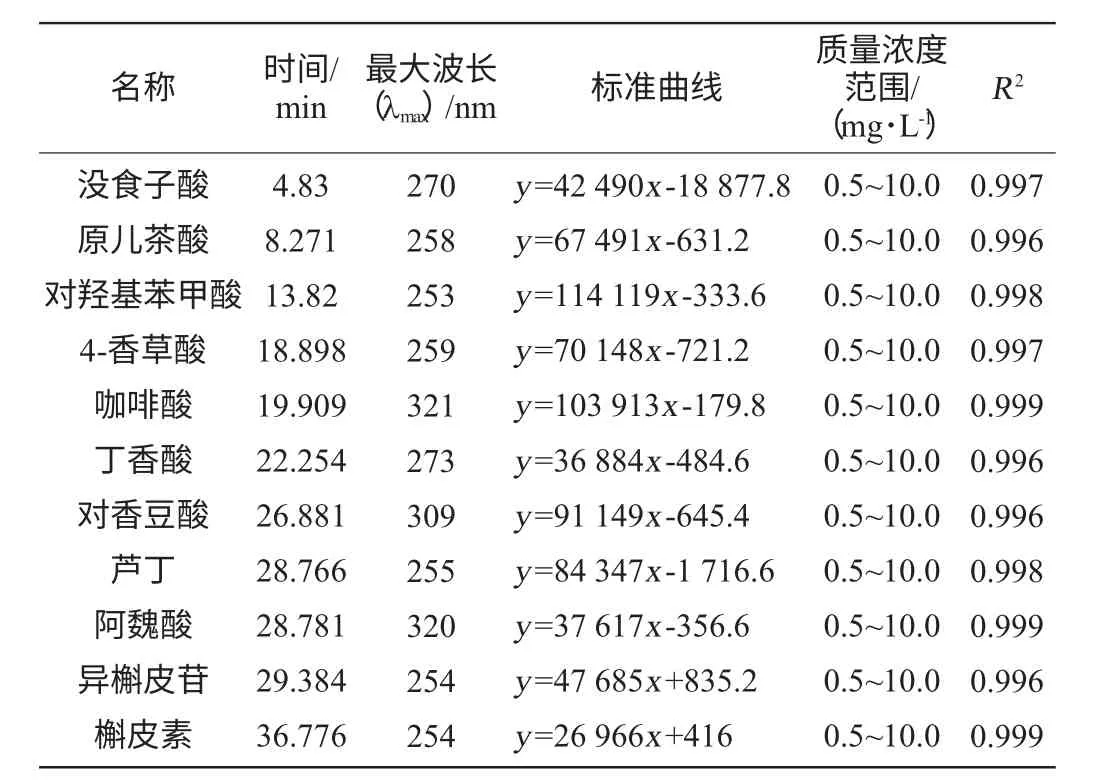
表2 11种酚类物质的标准曲线与相关系数Table 2 Standard curves and correlation coefficients of eleven phenolic substances
2.3 精密度实验
为考察方法的稳定性和重现性,对加标样品进行重复6次测定,以各组分色谱峰峰面积的计算其相对标准偏差(relative standard deviation,RSD),结果见表3,RSD为1.3%~3.3%,由此可见,该方法稳定性和精密度较好。
2.4 加标回收率实验
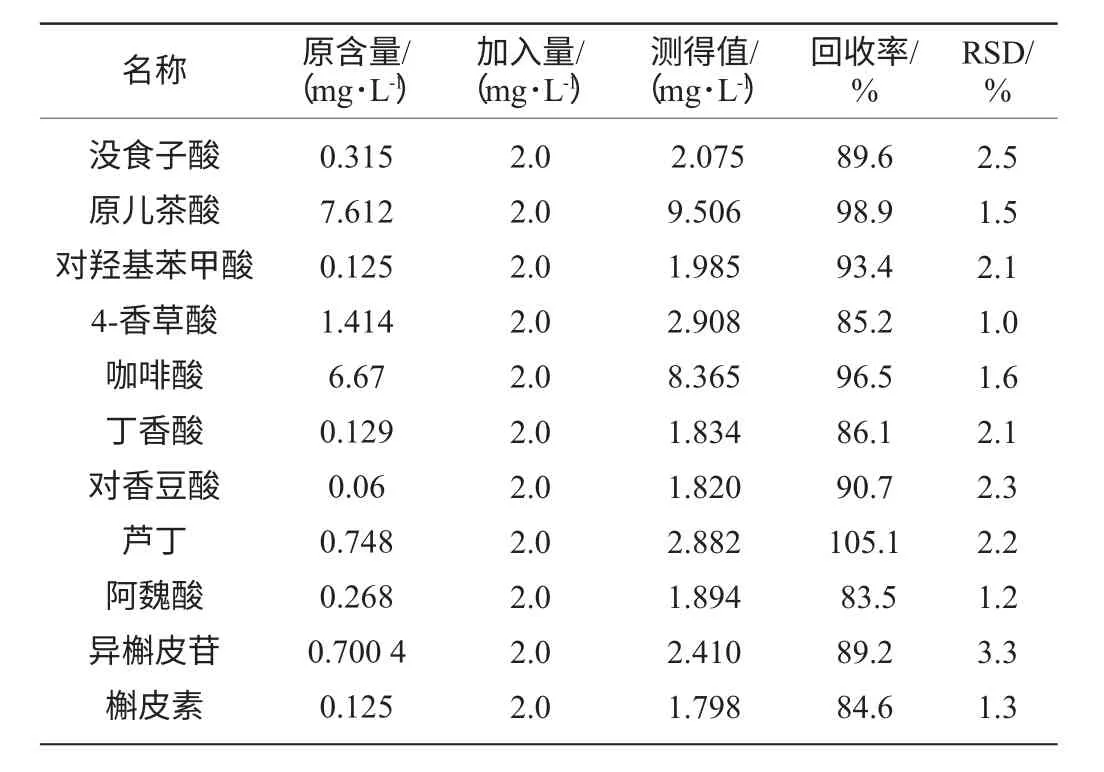
表3 方法的精密度和黑米酒加标回收率(n=6)Table 3 Precision and recovery of standard addition of black rice wine
为考察方法的准确度,实验准确吸取黑米酒10mL,加入2mL 10mg/L的混合标准液,混匀后按照样品处理的方法进行处理,在上述色谱条件下测定,重复3次,测得回收率结果见表3。11种酚类物质加标回收率为83.5%~105.1%。
2.5 样品测定
根据前述的样品提取条件和色谱条件,对黑米酒中的酚类物质进行测定。黑米酒提取液色谱图见图2。实验同时对其他米酒产品的多酚类物质进行分析测定。结果见表4。由此可见,不同米酒中的酚类物质含量差别较大,黑米酒中11种组分均有检出,其中原儿茶酸含量最高,为7.612mg/L,咖啡酸含量较高,异槲皮苷、芦丁也明显高于其他2种米酒。红米酒、糯米酒中对羟基苯甲酸、咖啡酸相对含量较高。
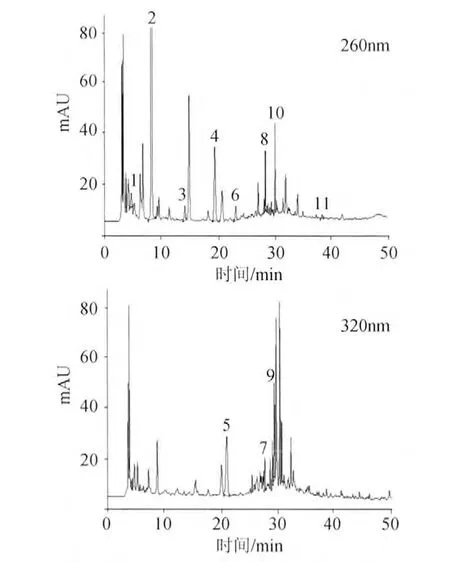
图2 黑米酒中酚酸色谱图(260nm、320nm)Fig.2 Chromatograms of black rice wine at 260nm and 320nm

表4 几种米酒中黄酮和酚酸类物质的测定结果Table 4 Contents of flavonoids and phenolic acids in rice wine
3 讨论与结论
3.1 建立了可用于黑米酒中酚类化合物分析的高效液相色谱方法。采用50%乙腈-超纯水(含1%乙酸)为流动相,低压梯度洗脱,11种酚类物质在45min内得到了较好分离。回收率在83.5%~105.1%,相对标准偏差为1.3%~3.3%。表明该方法准确可靠,可用于米酒中酚类物质测定。
3.2 通过对采用不同原料酿造米酒中的酚类物质检测发现,米酒中酚类物质的含量和种类与原料来源密切相关,这为米酒类产品的开发及其保健功能的研究提供依据。
3.3 实验过程中标准物质种类有限,尚有多种酚类物质未能确定,将进一步结合质谱进行判断。
[1]SHEN F,NIU X Y,YANG D T,et al.Determination of amino acids in Chinese rice wine by fourier transform near-infrared spectroscopy[J].J Agr Food Chem,2010,58(17):9809-9816.
[2]XU C L,RUO L H,FANG C,et al.Bacterial community dynamics during the traditional brewing ofWuyiHong Qu glutinous rice wine as determined by culture-independent methods[J].Food Control,2013,34(2):300-306.
[3]游月华.紫黑米的色素和营养成分研究综述[J].中国稻米,2006(5):7-8.
[4]陈世平,邹锁柱,吴惠芳,等.黑米黄酒工艺及产品稳定性研究[J].酿酒科技,2006,141(3):75-77.
[5]REVILLA E,RYAN M.Analysis of several phenolic compounds with potential antioxidant properties in grape extracts and wines by high-performance liquid chromatography photodiode array detection without sample preparation[J].J ChromatographyA,2000,881(1-2):461-469.
[6]刘达玉,马艳华,王新惠,等.黑米酒的酿造及其品质分析研究[J].食品研究与开发,2012,33(9):86-90.
[7]陈祈磊,夏兵兵,丁琦峰,等.红米/大米半固态酿制米酒的比较研究[J].成都大学学报:自然科学版,2011,30(3):209-211.
[8]JAKOBEK L,SERUGA M,VOCA S,et al.Flavonol and phenolic acid composition of sweet cherries(cv.Lapins)produced on six different vegetative rootstocks[J].Sci Hortic-Amsterdam,2009,123(1):23-28.
[9]康俊杰,李 艳.HPLC 检测葡萄酒中有效成分的研究进展[J].酿酒科技,2009,183(9):112-115.
[10]VICHAPONG J,SOOKSERM M,SRIJESDARUK V,et al.High performance liquid chromatographic analysis of phenolic compounds and their antioxidant activities in rice varieties[J].LWT-Food Sci Technol,2010,43(9):1325-1330.
[11]王祥军,齐军仓,贾力群,等.反相高效液相色谱法快速测定大麦子籽粒中13 种酚酸类化合物[J].分析试验室,2011,30(11):5-10.
[12]李永库,李晓静,欧小辉.固相萃取-高效液相色谱法同时测定葡萄酒中没食子酸等8 种多酚类化合物[J].食品科学,2008,29(4):283-286.
[13]方玲玲,肖作兵,牛云蔚,等.超高效液相色谱串联质谱法测定樱桃酒中的5 中酚酸[J].食品与发酵工业,2011,37(6):172-176.
[14]刘群涛,李 崎,武千钧,等.反相高效液相色谱法测定啤酒中的酚酸[J].分析实验室,2006,25(12):68-70.
[15]胡 华,张惟广,肖昭竞,等.HPLC 法测定酱油中的8 种酚酸[J].食品与发酵工业,2009,35(8):122-125.
[16]孙崇臻,王 超,蔡子哲,等.高效液相色谱测定蜂蜜中的脱落酸、黄酮和酚酸[J].食品科学,2013,34(10):281-285.
[17]成宇峰,张振文.HPLC 测定葡萄酒中单体酚样品预处理方法的优化[J].酿酒科技,2008,164(2):116-118.
[18]YAO L H,DATTA N,TOM?S-BARBER?N F A,et al.Flavonoids,phenolic acids and abscisic acid in Australian and New ZealandLeptospermumhoneys[J].Food Chem,2003,81(2):159-168.
[19]谢 越,俞 浩,汪建飞,等.高效液相色谱法同时测定滁菊样品中的九种酚酸[J].分析化学,2013,41(3):383-388.
[20]吴燕华,刘文力,阎 红,等.高效液相色谱法测定苹果中的酚类物质[J].分析化学,2002,30(7):826-828.
