响应面优化超声波辅助提取桑葚花色苷工艺的研究
2014-04-24程秀玮
程秀玮,魏 玮
(天津现代职业技术学院 生物化工系,天津 300350)
花色苷(anthocyanin)是一类广泛存在于植物的根、茎、叶、花、果实等器官的细胞液中的天然的水溶性色素。花色苷是由花色素苷配基(苷元)与各种糖通过糖苷键结合而成的一类黄酮多酚类化合物,使植物胞呈现出红色、蓝色或紫色等颜色[1-3]。
花色苷作为一种天然色素,安全、无毒,资源丰富,且对人体具有许多保健功能,如清除体内自由基、抗炎、抗癌、抑制脂质过氧化和预防糖尿病、保护视力等。因此,花色苷现已被广泛应用于食品、保健品、化妆品、医药等行业。
桑葚有很高的营养价值,成熟的桑椹果营养丰富,含有丰富的活性蛋白、维生素、氨基酸、胡萝卜素、矿物质、白藜芦醇、花青素等成份,其营养是葡萄的4倍、苹果的5~6倍,具有提高人体免疫力、延缓衰老、促进造血细胞生长、防止动脉硬化、促进新陈代谢等多种功能[4]。由于桑葚成熟的季节性很强,且外无果皮,水分含量少,不耐碰撞,易霉变,桑葚果实不易储藏、运输。因此,开发桑葚果实深加工技术不仅可解决桑葚的贮存、保鲜问题,还可增加桑葚果实的综合利用,增加产品附加值,扩大产品消费领域。
超声波提取技术利用其空化效应、机械振动作用、热效应等破坏植物细胞壁,使有效成分迅速溶解到溶剂里,提高了有效成分的提取得率,缩短了提取时间,减少了高温对提取成分的影响[5-7]。本文对超声波辅助提取桑葚花色苷的工艺进行响应面优化,选择出最佳提取条件。
1 材料与方法
1.1 材料与试剂
桑葚:市购;盐酸、无水乙醇、Na2HPO4、NaH2PO4、氯化钾等均为国产分析纯:天津科密欧试剂有限公司。
1.2 仪器与设备
UV-1600紫外可见分光光度计:北京瑞利分析仪器有限公司;AB204-S型电子分析天平:瑞士METTLER TOLEDO公司;KQ-250DB超声波发生器:昆山市超声仪器有限公司;HH2电热恒温水浴锅:常州智博瑞仪器制造有限公司、DT5A低速台式离心机:金山市科析仪器有限公司。
1.3 方法
1.3.1 桑葚花色苷提取
新鲜桑葚→洗净→研磨成浆→加入一定量酸化乙醇溶液(体积分数85%乙醇,含0.4%HCl)→超声波抽提(20 min,50 ℃,430 W)→离心(3 000 r/min、10 min)→取上层清液为待测原液。
1.3.2 桑葚花色苷含量测定方法
花青苷含量测定采用pH示差法[8-10]。依据pH示差法的原理取0.025 mol/L(pH 1.0)的氯化钾缓冲液和0.4 mol/L(pH 4.5)的乙酸钠缓冲液各5 mL分别加入1 mL的待测样品,混匀,室温下避光平衡30 min,用蒸馏水作空白,在矢车菊素-3-葡萄糖苷最大吸收波长510 nm和700 nm(校正浑浊度)下,测定吸光度值,稀释样品的吸光度值以及原始样品中花青苷含量按如下公式计算:
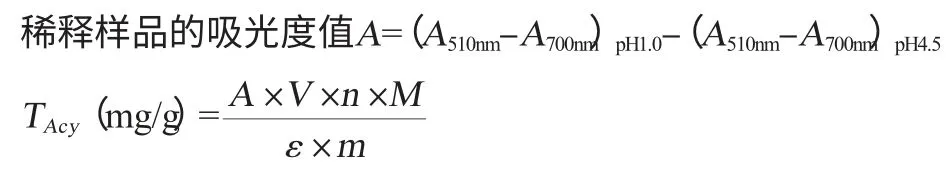
式中:TAcy为桑葚花色苷含量,mg/g;V为提取液总体积,mL;n为稀释倍数;M为矢车菊素-3-葡萄糖苷的分子质量,449.2;ε为矢车菊素-3-葡萄糖苷的消光系数,26900;A为样品的吸光度值;m为原料的质量,g。
1.3.3 单因素试验
称取果浆3.0 g,采用酸性乙醇作为浸提溶剂,以桑葚花色苷含量为考察指标,依次对其进行超声时间、料液比、超声温度及超声功率的单因素试验。
1.3.4 响应面优化试验
在单因素试验基础上,根据Box-Benhnken 的中心组合试验设计原理,采用响应面法进行3因素3水平的中心组合试验设计,对超声波提取桑葚花色苷的条件进行优化。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 超声时间对桑葚花色苷提取的影响

图1 超声时间对花色苷含量的影响Fig.1 Effect of ultrasonic time on anthocyanin content
称取3.0 g果浆,按料液比1∶15加入体积分数85%乙醇(含0.4%HCl)浸提溶剂,在40 ℃下,以300 W功率超声条件分别提取10 min、15 min、20 min、25 min、30 min后,抽滤、离心(3 000 r/min、10 min)取1 mL上清液,测定其吸光度值A,计算花色苷含量,结果如图1所示。由图1可知,超声提取时间从10 min增加到20 min,桑葚花色苷含量逐渐增大[11],并于20 min达到最大值;继续增加超声波提取时间至30 min,花色苷提取率逐渐降低,因此,超声时间宜控制在20 min。
2.1.2 料液比对桑葚花色苷提取的影响
称取3.0 g果浆,分别按料液比1∶10、1∶15、1∶20、1∶25、1∶30(g∶mL)加入体积分数85%乙醇(含0.4% HCl)浸提溶剂,在40 ℃下,以300 W功率超声波提取20 min后,抽滤、离心(3 000 r/min、10 min),取1 mL上清液,测定其吸光度值A,计算花色苷含量,结果如图2所示。由图2可知,随着料液比的增加,花色苷含量呈现出单一性增长的变化趋势,但料液比从1∶10(g∶mL)增加到1∶20(g∶mL),花色苷含量变化非常大,而从1∶20(g∶mL)继续增大到1∶30(g∶mL),含量虽然增加,但变化非常小。因此,考虑料液比过大,反应体系较浓稠,不利于花色苷的溶出以及试验材料的成本问题,料液比为1∶20(g∶mL)较适宜。
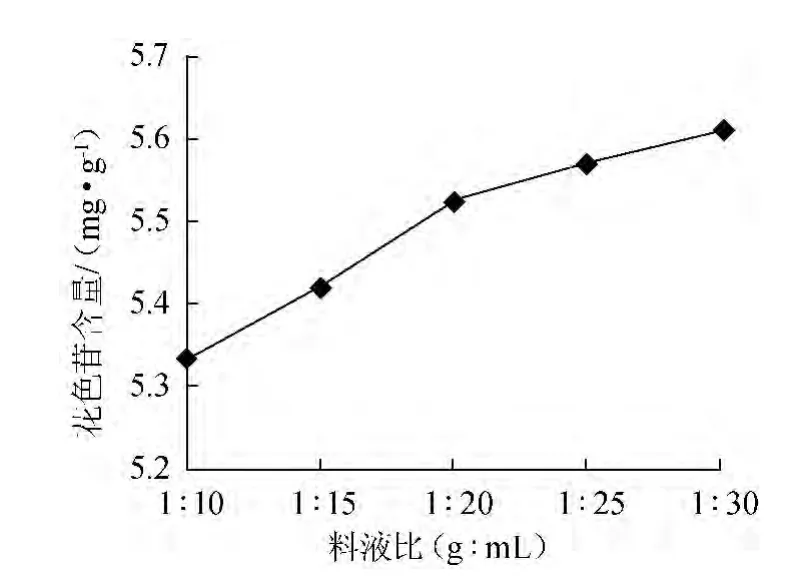
图2 料液比对花色苷含量的影响Fig.2 Effect of solid-liquid ratio on anthocyanin content
2.1.3 超声温度对桑葚花色苷提取的影响
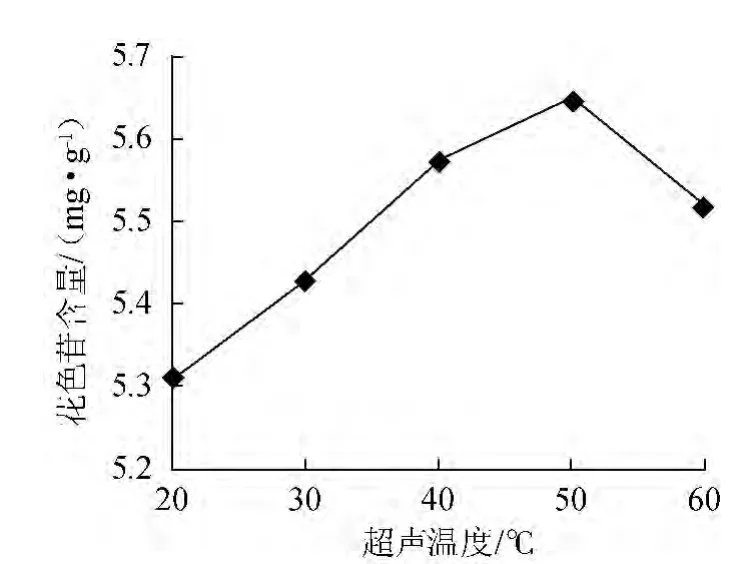
图3 超声温度对花色苷含量的影响Fig.3 Effect of ultrasonic temperatue on anthocyanin content
称取3.0 g果浆,按料液比1∶20(g∶mL)加入体积分数85%乙醇(含0.4%HCl)浸提溶剂,分别在20 ℃、30 ℃、40 ℃、50 ℃、60 ℃下,以300 W功率超声波提取20 min后,抽滤、离心(3 000 r/min、10 min),取1 mL上清液,测定吸光度值A,计算花色苷含量,结果如图3所示。由图3可知,当超声温度从20 ℃升高到50 ℃,桑葚花色苷含量逐渐增大,并于50 ℃达到最大值;继续升高温度,含量反而下降,可能是由于色素在高温条件下逐步降解的缘故,因此,温度宜控制在50 ℃。
2.1.4 超声功率对桑葚花色苷提取的影响
称取3.0 g果浆,按料液比1∶20(g∶mL)加入体积分数85%乙醇(含0.4%HCl)浸提溶剂,在50 ℃下,分别以250 W、300 W、350 W、400 W、450 W、500 W功率超声波提取20 min后,抽滤、离心(3 000 r/min、10min),取1 mL上清液,测定吸光度值A,计算花色苷含量,结果如图4所示。由图4可知,当超声功率从250 W增大到400 W,桑葚花色苷的含量逐渐增大,并且在超声功率为400 W时,含量达最大值,此后继续增大超声功率,含量开始出现下降的变化趋势,这可能是由于功率过大,反应体系内局部产生热量过高[12],引起花色苷降解,降低了提取效果。因此,适宜的超声功率应控制在350~450 W范围内。

图4 超声功率对花色苷含量的影响Fig.4 Effect of ultrasonic power on anthocyanin content
2.2 以桑葚花色苷含量为响应值的响应面试验结果分析
2.2.1 响应面优化设计方案
综合单因素试验结果分析,超声功率、超声温度和超声时间对花色苷提取的影响均表现为随着超声功率、超声温度和超声时间的增长,花色苷含量出现不同程度的先增长后下降的变化趋势;而料液比对花色苷提取的影响则表现为随着料液比在一定范围内的增大,花色苷的含量则只呈现出单一性增长的变化趋势,故不将料液比作为优化设计考察因素。
因此,根据Box-Behnken 的中心组合试验设计原理[13-14],在单因素试验结果基础上,选取超声波功率、超声温度和超声时间对花色苷含量影响显著的3个因素,以桑葚花色苷含量(Y)为考察指标,采用3因素3水平的响应面分析方法[15],因素与水平见表1。
表2中1~12为析因试验,13~17为中心试验。17个试验点分为析因点和零点,其中析因点为自变量取值在各因素所构成的三维顶点,共有12个析因点;零点为区域的中心点,零点试验重复5次,用以估计试验误差。

表1 响应面试验因素水平Table 1 Factors and levels of response surface analysis experiment
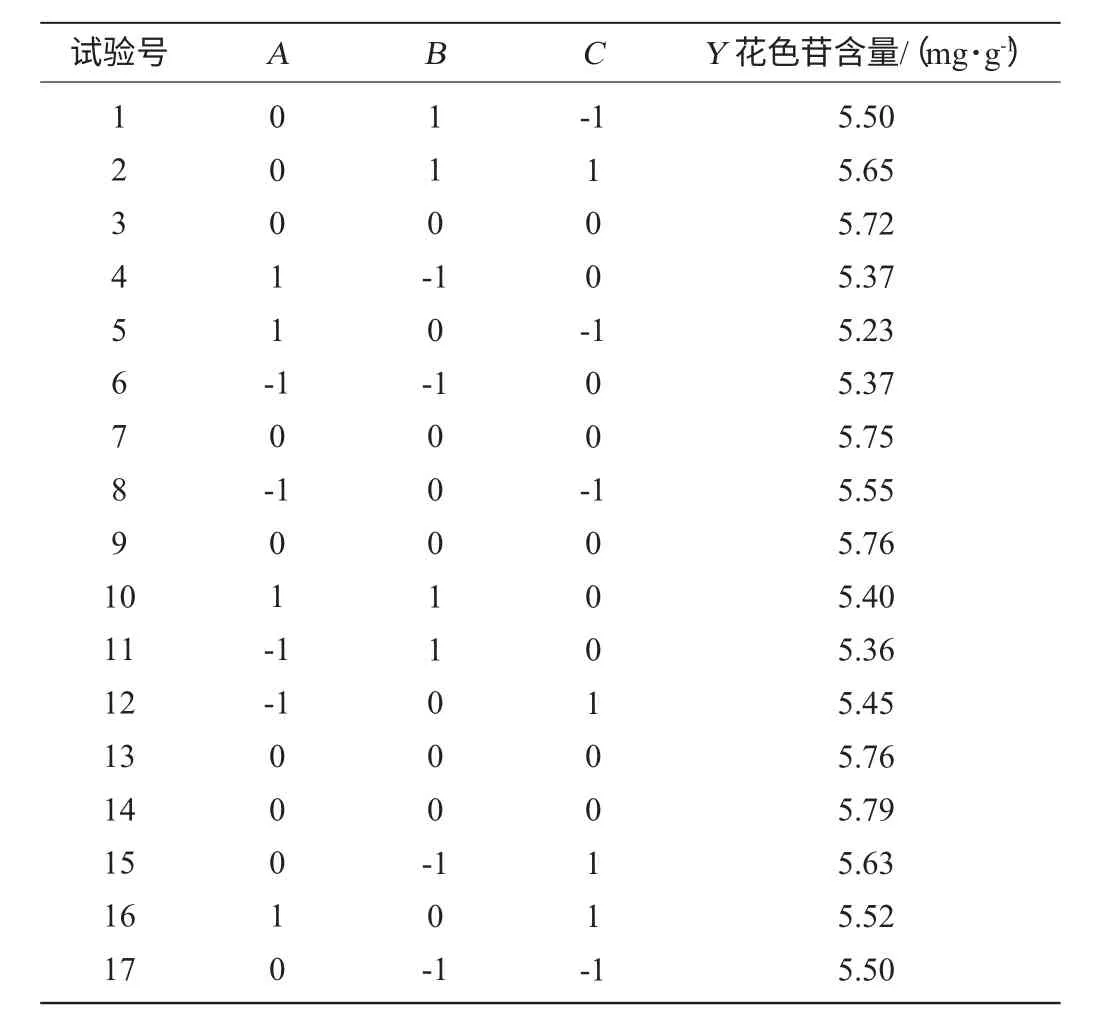
表2 花色苷提取工艺优化响应面分析试验设计及结果Table 2 Experimental design for response surface analysis and corresponding experimental data
2.2.2 回归方程和方差分析
采用Design Expert 7.0 软件对表2试验数据进行多元回归拟合分析得到花色苷含量与各因素变量的多元二次方程模型为:Y=5.76-0.036A+0.028B+0.046C+0.030AB+0.097AC-0.020BC-0.28A2-0.12B2-0.039C2
从表3二次响应面回归模型的方差分析结果可知,模型的P<0.000 1,说明对桑葚花色苷超声波提取建立的回归模型是极显著的;失拟项P=0.161 6>0.05不显著,模型在整个回归区域的拟合度很好;变异系数(coefficient of variation,CV)=0.61%,较低,表明该模型精确度高,试验可信;模型决定系数R2=0.984 1,校正系数R2Adj=0.963 6,表示模型的拟合度良好,预测值与实际值之间具有高度相关性,试验误差较小;信噪比=19.113>4,表明该模型拟合度与可信度均较高。因此可用该回归方程代替试验真实点对试验结果进行分析和预测。
将二次回归方程中一次项系数绝对值大小作为各参数对花色苷含量影响的比较依据,得出3因素对花色苷含量影响的大小依次为:C>A>B,即超声功率、超声时间和超声温度。

表3 回归模型方差分析Table 3 Variance analysis of regression model
2.2.3 响应面曲面分析

图5 各因素交互作用对花色苷含量影响的响应面及等高线Fig.5 Response surface plots and contour line of interaction among each factors on the yield of melberry anthocyanin
为进一步探究A、B、C的交互作用对响应值Y的影响,采用Design-Expert软件绘制了三维响应曲面图(见图5),从图5可看出AC交互作用对桑葚花色苷提取影响极显著,而且随着超声功率的增加和超声时间的延长,花色苷含量呈现先上升后下降的趋势,AB、BC交互作用对含量的影响作用较小。
利用Design Expert 软件分析,当花色苷含量即响应值(Y)为最大值时,与其相对应的桑椹花色苷的最佳提取条件为:超声时间20.24 min,超声温度50.34 ℃,超声功率431.60 W,理论最佳花色苷含量为5.770 7 mg/g。
2.3 验证实验
为了验证响应面分析结果的可行性,采用响应面法优化的工艺条件,进行了超声波辅助提取桑葚花色苷的验证试验。考虑到操作的便利性,将提取条件修正为:提取时间20 min,提取温度50 ℃,超声功率430 W。平行3次,花色苷的实际平均含量为5.768 1 mg/g,与预测值基本相符,说明响应面法对超声波提取桑葚花色苷条件的优化是可行的。
3 结论
在单因素试验的基础上,将响应面分析方法应用于超声波辅助提取桑葚花色苷的条件优化。回归分析结果表明,超声温度对超声波提取花色苷得率的影响最显著。回归分析和验证试验结果表明,此方法合理可行。得到超声波提取花色苷的最佳条件为:超声时间20 min,超声温度50 ℃,超声功率430 W,花色苷的实际含量为5.768 1 mg/g。
[1]孙建霞,张 燕,胡小松,等.花色苷的结构稳定性与降解机制研究进展[J].中国农业科学,2009,42(3):996-1008.
[2]于 东,陈桂星,方忠祥,等.花色苷提取、分离纯化及鉴定的研究进展[J].食品与发酵工业,2009,35(3):127-133.
[3]BRIDLE P,TIMBERLAKE C F.Anthocyanins as natural food coloursselected aspects[J].Food Chem,1997,58(1-2):103-109.
[4]帕丽旦·克里木.桑椹的开发研究进展[J].新疆师范大学学报:自然科学版,2003,22(3):71-73.
[5]冯 若,赵逸云,李化茂,等.超声在生物技术中应用的研究进展[J].生物化学与生物物理进展[J].1994,21(6):500-505.
[6]袁谋村,成昌梅,义志忠,等.超声溶剂提取法研究[J].湘潭大学自然科学学报,1992,14(4):43-46.
[7]张卫红,吴晓霞,马空军.超声波技术强化提取天然产物的研究进展[J].现代化工,2013,33(7):26-29.
[8]霍琳琳,苏 平,吕英华.分光光度法测定桑葚总花色苷含量的研究[J].酿酒,2005,32(4):88-89.
[9]杨兆艳.pH 示差法测定桑椹红色素中花青素含量的研究[J].食品科技,2007(4):201-203.
[10]WROLSTAD R E,ACREE T E,DECKER E A,et al.Handbook of food analytical chemistry.water,proteins,enzymes,lipids,and carbohydrates[M].New York:John Wiley&Sons Inc,2005.
[11]BENNETT A,BOGORAD L.Complementary chromatic adaptation in afilamentous blue-green alga[J].J Cell Biol,1973,58(2):419-435.
[12]马亚琴,叶兴乾,吴厚玖,等.超声波辅助提取植物活性成分的研究进展[J].食品科学,2010,31(21):459-463.
[13]田胜元.实验设计与数据处理(第四版)[M].北京:中国建筑工业出版社,2001.
[14]BOX G E P,HUNTER W G.Statistics for experiments:anintroduction to design,data analysis and model building[M].New York:John Wiley&Sons Inc,1990.
[15]YAMAZAKI J,KUSHIDA N,OGUCHI A,et al.Response surface design and analyses[M].New York:Marcel Dekker Inc,1987.
