胡杨花序乙醇提取物体内抗氧化活性研究
2014-04-24汪河滨
汪河滨,苏 华,张 博
(省部共建国家重点实验室培育基地 新疆生产建设兵团塔里木盆地生物资源保护与利用重点实验室,新疆 阿拉尔 843300)
胡杨(Populus euphraticaOliv.)别名梧桐、异叶杨,属于杨柳科(Salicaceae)杨属(Populus)胡杨亚属木本植物,是自白垩纪起源并保存下来的古老树种,也是杨属中最古老的一个种。
胡杨研究现状主要涉及其独特的形状、起源、分类归属等同题,以后逐渐扩展到其他方面,取得了一定的研究成果,近年来,胡杨潜在的基因资源价值和在造纸等工业方面的用途也逐渐受到有关人士的关注。
本研究以胡杨花序为研究材料,初步研究胡杨花序乙醇提取物对小鼠血清和肝匀浆中的超氧化物歧化酶(superoxide dismutase,SOD)的活性及丙二醛(malondialdehyde,MDA)的含量的影响,以初步揭示胡杨花序抗氧化能力,因此对其进行研究和开发有重要意义。
1 材料与方法
1.1 材料与试剂
胡杨花序:实验所用胡杨花序采自新疆阿拉尔市塔里木大学校内及周边地区,干燥后粉碎,用乙醇浸泡提取3次,提取液45 ℃减压浓缩成浸膏,干燥后待用。
实验动物:小鼠,雌、雄各半,6~8周龄,体质量(20±2)g,购自塔里木大学动物科技学院实验动物中心,实验动物中心内恒温18~22 ℃,恒湿50%~80%,自由摄入无菌水和灭菌标准词料。
剂量选择:试验设胡杨花序乙醇提取物低剂量组(165 mg/kg BW)、胡杨花序中剂量组(330 mg/kg BW)、胡杨花序高剂量组(660 mg/kg BW)和空白对照组(生理盐水灌胃)。
试剂及试剂盒:冰醋酸(分析纯,纯度>99%):上海化学试剂公司;无水乙醇(纯度>99%):洛阳市化学试剂厂;生理盐水(0.9%、0.86%):江苏恒瑞医药股份有限公司;双蒸水实验室自制;超氧化物歧化酶(SOD)测试盒、丙二醛(MDA)测定试剂盒:南京建成生物工程研究所。
1.2 仪器与设备
DZF6050MBE型真空干燥箱:上海博迅实业有限公司;BS124S电子天平:北京赛多利斯仪器系统有限公司;SK3200H超声波清洗机:上海科导超声仪器公司;DK-8D数显恒温水浴锅:金坛市医疗仪器厂;T6新世纪紫外-可见分光光度计:北京普析通用仪器有限责任公司;TGLL-18B台式高速冷冻离心机:江苏太仓医疗器械厂;FSH-2A型可调高速匀浆机:江苏金元市医疗仪器厂。
1.3 方法
1.3.1 试验设计
小鼠按性别随机分为4组,每个试验组10只小鼠,雌雄各半,分别用低、中、高三个剂量组的胡杨花序乙醇提取物和空白对照组,给试验小鼠每日每只灌胃胡杨花序提取物一次,饲喂普通饲料,30d后处死,检测小鼠血清中的SOD的活性以及肝组织中MDA的含量进行分析测定,并比较各处理对小鼠血清中的SOD的活性以及肝组织中MDA的含量的影响。
1.3.2 试验方法
小白鼠的分组灌胃:小鼠按性别随机分为4组,每个试验组10只小鼠,雌雄各半,分别用低、中、高三个剂量组的乙醇提取物和空白对照组,给试验小鼠每日每只灌胃胡杨花序一次,饲喂普通饲料,30 d后将小鼠摘眼球取血液,并制备肝组织匀浆,检测各项指标。
SOD活力检测:血清凝固后4 ℃,3 000 r/min离心10 min,轻取血清20 μL,按照SOD检测试剂盒说明书操作,依次加入各种试剂,混匀,置37 ℃恒温水浴锅加热40 min,加入显色剂,混匀,室温静置10 min,于波长550 nm处,1 cm光径比色杯,蒸馏水调零,比色。测定测试管及对照管的吸光度(OD550nm)值。
取肝组织样品4 μL,3 000 r/min离心10 min,按照SOD检测试剂盒说明书操作,依次加入各种试剂,混匀,置37 ℃恒温水浴锅加热40 min,加入显色剂,混匀,室温静置10min,于波长550 nm处,1 cm光径比色杯,用蒸馏水调零,进行比色。测定测试管及对照管的吸光度OD550nm值。
活力定义:每毫升反应液中SOD(MDA)抑制率达到50%时所对应的SOD(MDA)量为一个亚硝酸盐单位,U。
SOD活力的计算:
血清中SOD含量=(对照管吸光度值-测定管吸光度值)×反应体系的稀释倍数/(对照管吸光度值×50%)
组织中SOD含量=(对照管吸光度值-测定管吸光度值)×反应体系的稀释倍数/(对照管吸光度值×50%×蛋白含量)
(SOD活力的表示单位:U/mg)
组织匀浆蛋白含量的测定:准确称取待测肝组织的重量,按体重体积比加生理盐水制备成10%的组织匀浆,1 000 r/min~3 000 r/min离心10 min,然后取组织匀浆上清再用生理盐水按1∶9稀释成1%组织匀浆,待测。
取肝组织匀浆20 μL,按照考马斯亮兰蛋白测定试剂盒说明书的要求,依次加入各种试剂,混匀,静置10 min,于波长595 nm处,1 cm光径比色杯,用蒸馏水调零,进行比色。测定各管的OD值。

MDA含量的检测:血清中MDA含量的测定:取血清15 μL,按照丙二醛(MDA)测定试剂盒说明书的要求,依次加入各种试剂,混匀器混匀,试管口用封口膜扎紧,用针头刺一小孔,95 ℃水浴40 min,取出后流水冷却,然后4 000 r/min离心10min,取上清液,于波长532 nm处,1 cm光径比色杯,用蒸馏水调零,进行比色。测定各管的OD532nm值。
肝组织匀浆中MDA含量的测定:取肝组织匀浆20 μL,按照丙二醛(MDA)测定试剂盒说明书的要求,依次加入各种试剂,混匀器混匀,试管口用封口膜扎紧,用针头刺一小孔,95 ℃水浴40 min,取出后流水冷却,然后4 000 r/min离心10 min,取上清液,于波长532 nm处,1 cm光径比色杯,用蒸馏水调零,进行比色。测定各管的OD值[5-7]。

2 结果与分析
2.1 胡杨花序对血清中超氧化物歧化酶(SOD)活性的影响

表1 胡杨花序对血清中超氧化物歧化酶活性的影响Table 1 Effect of P.euphratica inflorescence on SOD content in mice serum(mean±sd)
由表1可知,实验组与对照组间血清SOD活力都有显著差异(F=165,df=3,P<0.05),中剂量组和高剂量组的血清SOD活力均显著高于生理盐水对照组,但3个实验组间的血清SOD活力没有达到显著差异。
2.2 胡杨花序对血清中丙二醛(MDA)含量的影响
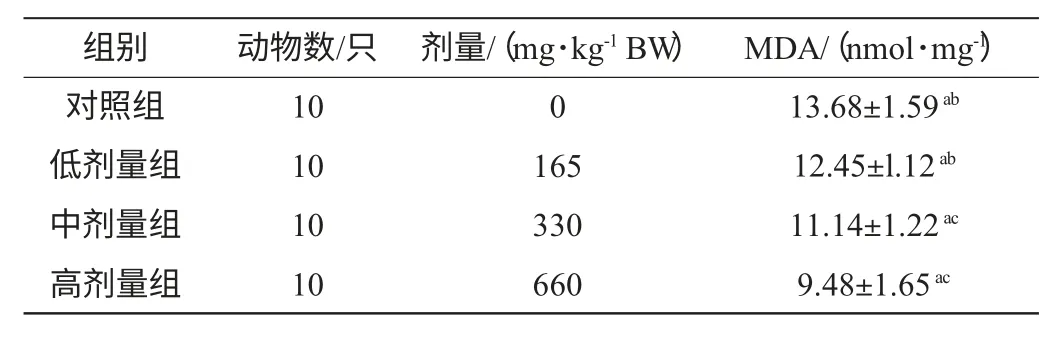
表2 胡杨花序对血清中丙二醛含量的影响Table 2 Effect of P.euphratica inflorescence on MDA content in mice serum(mean±sd)
由表2可知,实验组与生理盐水对照组间血清中MDA含量都有显著差异(F=137.37,df=3,P<0.05,)中剂量组与高剂量组均显著高于与低剂量组(P<0.05)。
2.3 胡杨花序对小鼠肝组织中SOD活性的影响

表3 胡杨花序对小鼠肝组织中SOD活性的影响Table 3 Effect of P.euphratica inflorescence on SOD content in hepatic tissue of mice(mean±sd)
由表3可知,实验组与对照组间肝脏中SOD活力都有显著差异(F=304.25,df=3,P<0.05),中剂量组和高剂量组的肝脏SOD活力均显著高于生理盐水对照组,但3个实验组间的肝脏SOD活力没有达到显著差异。
2.4 胡杨花序对小鼠肝组织中MDA含量的影响
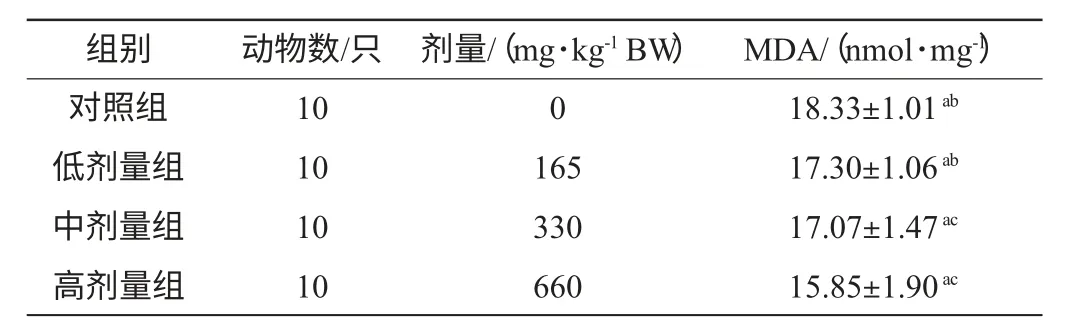
表4 胡杨花序对小鼠肝组织中MDA 含量的影响Table 4 Effect of P.euphratica inflorescence on MDA content in hepatic tissue of mice(mean±sd)
由表4可知,实验组与生理盐水对照组间肝脏中MDA含量都有显著差异(F=129,df=3,P<0.05,)中剂量组与高剂量组均显著高于与低剂量组,但这3个实验组肝组织MDA含量均显著低于生理盐水对照组。
3 结论
胡杨花序提取物可以显著增加血清及肝组织蛋白含量,降低血清及组织MDA含量,提高小鼠的血清、肝组织SOD活力,提高老龄小鼠体内抗氧化能力。
胡杨花序属天然植物,提取物提取过程中环保无污染,无细胞毒性及其他副作用,因此对其进行研究和将其开发成天然抗氧化剂或自由基清除剂对保障机体健康、预防疾病有重要意义。
[1]刘埃心.中国沙漠植物志[M].北京:科学出版社,1985.
[2]孙雪新,康向阳,李 毅.胡杨的研究现状及发展建议[J].世界林业研究,1993,20(4):48-52.
[3]高 焱,于文功,韩 峰,等.甘糖酯对高脂血症大鼠血脂及脂蛋白脂酶的调节作用[J].药学学报,2002,37(9):67-69.
[4]刘建涛,赵 利,苏 伟,等.蜂花粉生物活性物质的研究进展[J].食品科学,2006,27(12):245-250.
[5]段智变,江 晓,江汉湖,等.纳豆粗提物抗兔高脂血症及抗氧化作用的研究[J].营养学报,2004,26(4):296-299.
[6]许子俊,许子俊,余海茹,等.油菜蜂花粉对小鼠免疫功能的影响[J].西北药学杂志,1993,8(1):24-26.
[7]钱伯初,钱 芸,臧星星,等.蜂花粉对小鼠体内外脂质过氧化的影响[J].营养学报,1989,11(4):355.
[8]辛 琳.色氨酸对应激小鼠抗氧化能力和行为的影响[D].无锡:江南大学硕士论文,2013.
[9]唐 静.不同剂量川牛膝多糖对小鼠抗氧化活性的影响[D].雅安:四川农业大学硕士论文,2013.
[10]程云辉,文新华,王 璋.麦胚蛋白酶解物对小鼠抗氧化作用的研究[J].食品科学,2007(7):486-489.
[11]杨建雄,王丽娟,田京伟.槐米提取液对小鼠抗氧化能力的影响[J].陕西师范大学学报:自然科学版,2002,02:87-90.
[12]郑王巧,郭春花,张晓一,等.葛根黄酮对亚急性衰老模型小鼠抗氧化作用的研究[J].四川生理科学杂志,2009(4):145-146.
[13]邹 翔,季宇彬,武晓丹,等.西兰花中葡萄糖异硫氰酸盐对S_(180)小鼠抗氧化功能的影响[J].中国天然药物,2007(2):134-136.
[14]尹 进,胡怡秀,胡余明,等.葡萄籽原花青素提取物对小鼠MDA、SOD 和GSH-Px 的影响[J].中国热带医学,2007(8):1285-1286.
[15]段 荟,付成效,邹 瑾.黄芪对酒精性肝损伤小鼠MDA、GSH 和TG的影响及肝脏保护作用的研究[J].陕西医学杂志,2010(3):271-273.
[16]刘月丽,黄奕弟,林连波.海南山苦茶提取物对衰老小鼠脑组织抗氧化能力的影响[J].海南医学院学报,2012(7):872-874.
